
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
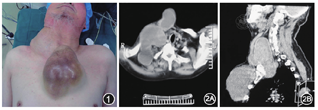
患者男,76岁,回族,主因发现右颈部肿物42年,胸前肿物20年并逐渐增大收住我科。查体:右侧颈部见一约15 cm×11 cm大小肿物,触诊质韧,表面光滑,活动度差。前胸壁见一大小17 cm×13 cm肿物,表面皮肤发黑,张力较大,质软,表面光滑,无压痛,活动度差,边界清楚(图1)。双侧颈部未触及明显肿大淋巴结。彩超所见(1)甲状腺左侧腺叶大小为1.47 cm×0.99 cm,形态规则,内部回声均匀,血流信号未见异常;(2)甲状腺右侧腺叶未见正常甲状腺组织回声,可见两处分别为4.50 cm×4.26 cm、10.00 cm×6.93 cm低回声团块,边界清,形态不规则,内部回声不均匀,内可见不规则液区及强回声伴声影,边缘可见少许血流信号。其外侧还可见一6.92 cm×6.60 cm囊性团块,边界清,形态规则,内呈均匀的密集点状回声,加压有流动感。(3)胸前包块处可见一约17.0 cm×7.0 cm低回声团块,边界清,形态不规则,内部回声不均匀,前半部为均匀的密集点状回声,加压有流动感,后半部呈实性回声,边缘可见少许血流信号。彩超提示:甲状腺左侧叶未见异常;右颈部及胸前包块:多考虑源于甲状腺。胸片提示:颈部巨大软组织影,向纵隔延伸,气管受压向左推移。CT提示:右侧甲状腺及右侧颈部多发囊实型占位,同时向胸壁及胸骨后延伸(图2)。患者术前甲状腺功能示:T3、T4、TSH以及甲状腺球蛋白抗体(TG-Ab)、甲状腺微粒体抗体(TM-Ab)均在正常范围,甲状腺球蛋白为1.22 μg/L,低于正常范围(4.14~14.16 μg/L)。术前未能完善甲状腺核素扫描。入院后全麻下行"右颈部、胸壁、胸骨后巨大肿物并右侧甲状腺腺叶切除术"。颈部手术切口采用Kocher's切口并向右侧延长,胸壁切口则沿瘤体表面做纵向梭形切口。术中探查右颈部肿物大小约15 cm×12 cm,上至右侧颌下,下至右侧锁骨下2 cm,后至斜方肌,前至胸骨柄,并与右侧甲状腺、前胸壁及胸骨后肿物贯通。右侧甲状腺大小约5 cm×4 cm,无正常甲状腺组织,内见多发囊实型占位。前胸壁肿物为17 cm×13 cm囊性肿物,张力大,部分区域呈坏死样结构。胸骨后占位向胸骨后延伸近10 cm,囊壁纤维化增厚,因右侧颈内静脉与瘤体粘连紧密,无法保留,予以切除,术中完整保护右侧副神经、膈神经。术后病理:(右侧甲状腺)结节性甲状腺肿并坏死、出血囊性变及纤维化,合并微小乳头状癌(直径0.2 cm);(右颈、右胸壁及胸骨后)纤维结缔组织构成的囊壁样结构,囊内壁出血并玻璃样变性,部分区域可见多核巨细胞反应,淋巴细胞、浆细胞浸润并含铁血黄素沉积。患者术后颈胸部切口甲级愈合,无手足抽搐、饮食呛咳及声嘶等症状,术后3 d复查血钙1.93 mmol/L。术后2周治愈出院。

临床最常见的良性或胸壁囊肿病变是淋巴管瘤、皮样囊肿、畸胎瘤以及炎性囊肿。而结节性甲状腺肿是由单纯甲状腺肿逐渐演变而来,通常结节性甲状腺肿长期发展会向上纵隔生长,形成胸骨后甲状腺肿,并且会对气管及颈部组织产生压迫症状[1]。甲状腺乳头状癌向甲状腺外扩散概率为4%~16%,增加了甲状腺癌复发与死亡的概率[2],常见的甲状腺癌腺外侵犯主要包括喉返神经、喉部、气管及食管。甲状腺肿瘤表现为胸壁肿物报道较少,国外Gertz等[3]报道1例滤泡型甲状腺癌患者胸壁转移病例,另有印度学者[2]报道1例甲状腺乳头状癌患者表现为胸壁囊性占位。二者均认为胸壁占位形成与甲状腺癌肿瘤转移或淋巴结转移相关。但本例患者病理变化以结节性甲状腺肿为主,颈部、胸骨后及胸壁病变病理以囊肿合并出血变性为主,故笔者认为该患者胸壁囊实型肿物为结节性甲状腺肿慢性出血,出血灶沿组织间隙延伸至胸骨后和胸壁皮下组织并囊性变而形成,不考虑为癌性转移灶。因此对于部分有较长病史的结节性甲状腺肿患者,不仅表现为颈部或胸骨后巨大肿物,部分出血囊性变可能会沿组织间隙达到胸壁皮下组织,对于该患者,彩超及颈部CT及重建提示胸壁瘤体与颈部及胸骨后肿物相连,对病变来源及病变性质诊断提供了有益的信息。手术切除是治疗的主要方式,手术过程中由于瘤体巨大,整块切除较困难,因与颈内静脉粘连紧密,故无法保留,右侧甲状腺周围组织粘连紧密,甲状旁腺旁腺困难,无法明确保留,但术中左侧甲状腺无明显病变,予以保留,减少了永久性甲状旁腺功能减退症的发生概率。该患者经外科切除后,目前随访,预后良好。


























