
NUT癌是以染色体15q14上睾丸基因核蛋白(NUTM1)重排为特征的一种罕见的恶性肿瘤,其发病机制及治疗方法目前尚不明确。上海长征医院医院耳鼻咽喉头颈外科收治了1例发生于鼻腔的NUT癌患者,为28岁男性,其鼻腔肿瘤发展迅速,并有上颌窦骨质破坏。初次活检病理诊断为非角化未分化癌,进一步手术治疗后,经荧光标记的原位杂交技术证实为NUT癌。本文结合文献回顾报告了鼻腔NUT癌这一少见实体瘤的临床、病理特征及治疗策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,28岁,因"左侧鼻塞1个月"于2018年9月26日收入上海长征医院耳鼻咽喉头颈外科,患者伴有嗅觉减退、左侧鼻腔流黄脓涕、左侧额部持续胀痛等症状。否认既往病史,有吸烟及饮酒史。体格检查:左侧鼻腔狭窄,左侧下鼻甲及邻近鼻腔外侧壁可见隆起新生物,约2 cm×2 cm大小,质韧,表面不光滑,附着有黄脓性分泌物,无出血,鼻中隔稍左偏,右侧鼻腔通畅,鼻甲未见明显肿大,双侧鼻窦区无压痛。鼻窦CT显示左侧鼻腔新生物侵犯下鼻甲及上颌窦内侧壁,左侧上颌窦、筛窦可见不规则软组织密度影,上颌窦内壁、筛窦骨质局部可见虫噬样破坏(图1)。颈部超声检查未发现肿大淋巴结。新生物活检病理提示为未分化细胞癌。于2018年11月21日行左侧鼻腔鼻窦恶性肿瘤切除及左侧上颌骨次全切除术,手术切除范围包括上颌窦前壁、内侧壁、下鼻甲、鼻底及部分牙槽骨。术中探查发现肿瘤累及上颌骨牙槽突,切牙牙根未受侵犯。为保全患者容貌及咀嚼功能,于左上1~3切牙牙根上方距肿瘤底部0.5 cm水平凿断牙槽骨,保留切牙,将肿瘤连同周边上颌骨扩大切除。
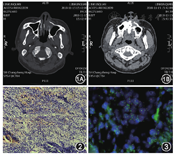

术后病理检查显示标本体积3.5 cm×3.0 cm×2.2 cm,切面呈灰白褐色,质软,部分为碎骨样组织,镜下形态符合低分化癌或高级别小细胞样癌(图2)。免疫组织化学(免疫组化):HMB45、S-100、FIL-1、MyoD1、Myogenin、Desmin、EMA、NF、NSE、CD56、CGA、TTF1、Leu-7、P40、P63、CK20、GFAP、CEA、PR、ACTH、CD34、Vim呈阴性表达;CK5/6、CK(Pan)、CAM5.2、CK7、INI1呈部分阳性表达;MDR1、Syn、TLE-1、CD68、TS/5-FU呈弱阳性表达;Ki-67(>85%)。NUT基因荧光标记的原位杂交技术(FISH)检测:NUT基因断裂,NUT基因异常百分比为18%(图3),支持NUT癌诊断。最终诊断:左鼻腔NUT癌(cT3N0M0)。
术后给予患者同步放化疗。治疗方案为鼻腔、上颌窦50 Gy/25 Fx+左侧鼻腔上颌窦加量10 Gy/5 Fx,顺铂40 mg每周1次。本例患者于术后6个月出现了骨转移征象,拒绝进一步诊治。
NUT癌是一个相对较新的概念,于1991年首次报道[1],且在2003年发现了其NUT和BRD4基因融合的主要特征[2]。学者们认为,其发病是由BRD4-NUT融合基因刺激组蛋白高乙酰化,进而招募额外的BRD4加强转录激活而诱发的一系列下游反应所致[3,4]。因其多见于纵隔、头颈等身体中线部位,NUT癌曾一度被称为中线NUT癌。Giridhar等[5]系统回顾了2017年7月之前报道的119例患者,其发生部位以肺部、头颈及纵隔居多,分别为42例(35.3%)、40例(33.6%)和31例(26%),头颈部属于NUT癌相对多见的发病部位。NUT癌的实际发病率可能高于已报道的水平,Bishop和Westra[6]对未诊断为NUT癌的鼻部肿瘤研究发现,75%的50岁以下鼻腔未分化癌的患者实际上都存在NUT癌细胞。
NUT癌是一种罕见的、侵袭性强的恶性肿瘤。整体生存率低,但溴结构域外结构基因序列(BET)抑制剂靶向药物治疗的临床反应强调了与其他低分化鼻腔、鼻窦癌鉴别诊断的重要性[7]。头颈部的NUT癌在临床表现上几乎没有特征性症状体征,本例患者的症状体征与其他鼻腔恶性肿瘤相比也并无异常,因此病理学诊断显得尤为重要。在病理诊断中,对小圆细胞瘤的鉴别诊断应将NUT癌列入考虑范围,尤其是来源于纵隔和头颈部的肿瘤。NUT癌的细胞学特征与其他肿瘤有相当多的重叠,在细胞学涂片上,NUT癌细胞生长密集,大小单一,呈散在分布。肿瘤细胞的细胞核呈圆形至椭圆形,大部分为裸核,细胞质缺失,细胞核的染色质密度变化大,常伴有细胞间的局灶性成型,大多数病例有明显的小核仁[8]。因此,从细胞形态上本病与小圆细胞肿瘤几乎无法鉴别。在免疫组化染色方面,弥漫性NUT>50%阳性是可以支持NUT癌诊断的标准,除此之外,p63、CD34阳性,S100、HMB45、desmin、NSE阴性等指标的特异性并不强,例如曾有p63完全阴性的NUT癌病例报道[7],本病例的p63亦是阴性表达。文献报道骨髓受侵的NUT病例中CD34表达强阳性[9],这与本病例中的阴性表达也不一致。本病例在细胞形态学上类似于低分化癌或高级别小圆细胞样癌,通过免疫组化检测,基本上排除了常见的神经内分泌癌、横纹肌肉瘤、尤文肉瘤、恶性黑色素瘤、嗅神经母细胞瘤、滑膜肉瘤、恶性神经鞘瘤等小圆细胞性肿瘤的可能后,遂考虑到NUT癌和INI-1缺失的低分化癌。本病例进一步通过FISH检测,明确了NUT基因断裂发生分离,最终确诊为NUT癌。该病的诊断还可依靠NUT特异性抗体检测(灵敏度87%,特异度100%)或通过染色体分析等手段证实NUT易位的存在[10]。
该病患者的中位生存时间小于1年,5年生存率为7.09%[6,11],有21%的患者出现骨转移,PET/CT在判断其分期、活检部位及治疗效果等方面具有一定价值[12]。目前,该病尚无确切有效的治疗手段,手术彻底切除对提高生存率的作用是积极的。根据Bauer等[13]的回顾性研究,完全切除瘤体的患者生存时间明显更长。有研究表明,由于NUT癌可能存在固有的放疗敏感性,无论术前、术后或单纯放疗都是有益的,且接受50 Gy以上放疗剂量的患者生存效果较好[6]。大部分NUT癌使用细胞毒性药物化疗的效果较差。新的靶向药物如BET抑制剂和组蛋白去乙酰化酶(HDAC)抑制剂具有良好的临床应用前景[1,14,15,16],目前尚处于临床前期研究阶段。
所有作者均声明不存在利益冲突



























