
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺癌是内分泌系统和头颈部肿瘤中最常见的恶性肿瘤,约占全身恶性肿瘤的1.75%[1]。甲状腺癌发生颅骨及脑转移极为少见,常因不典型的临床表现和影像学特征使其诊断困难。暨南大学附属第一医院神经外科于2016年4月、6月分别收治分化型甲状腺癌颅骨转移和分化型甲状腺癌脑转移患者各一例,笔者现将其诊治过程报道如下,以期为临床工作者提供参考。
患者1 女性,75岁,因"左顶部头皮下肿物进行性增大8个月余"于2016年4月19日入院。患者在8个月前发现左顶部头皮下无痛性肿物,因肿物逐渐增大而就诊,无头痛、头晕,无恶心、呕吐,无视物模糊,无肢体活动障碍,无抽搐。自起病来,精神食欲可,二便无异常。既往史无特殊。体检:神清,一般情况良好,卡氏功能状况(KPS)评分100分。左顶部头皮下可触及大小约为5.0 cm×7.0 cm类圆形肿物,边界清楚,质地较软,活动度较差、无波动感,局部头皮无红肿热痛、无溃烂。双侧甲状腺不大,未触及明显肿物。神经系统和实验室检查均未见明显异常。胸部CT、心脏、肝胆胰脾、泌尿生殖系彩超均未见明显异常。头颅MRI示:左顶部头皮下硬膜外一类圆形肿块,边界清楚,左侧顶叶受压、中线无明显移位,呈长T1信号,颅骨破坏明显;增强后肿块呈不均匀强化(图1A)。头颅三维飞行时间磁共振血管成像(3D-TOF MRA)示:肿物内部条索状血管影(图1B)。MRA示:肿物血供丰富,以颞浅动脉和脑膜中动脉供血为主。头颅CT示:左顶部头皮下硬膜外一个高密度、边界清楚的肿物,大小约5.1 cm×7.2 cm×6.5 cm,左顶颅骨明显破坏(图1C)。临床诊断:恶性脑膜瘤和颅骨恶性肿瘤可能。于2016年4月22日行左额顶肿瘤切除术,术中见肿瘤位于骨膜内,未侵犯头皮,质地中等,边缘清楚,颅骨破坏明显。在肿瘤边缘外旁开1.5~2.0 cm正常颅骨处切开骨膜,钻孔后铣开颅骨,将骨瓣和肿瘤一起从硬膜上完整剥离。肿瘤血供丰富,源于颞浅动脉、颅骨板障血管、脑膜中动脉,肿瘤基底与硬脑膜粘连紧密、侵及硬膜外层,硬膜内层完整。肿瘤切除后用钛网行一期颅骨成形术。术中出血约350 mL。术后切开肿瘤,见肿瘤呈灰红色、鱼肉状、质地韧。术后CT示肿瘤已完整切除(图1D),骨窗由钛网修复。术后病理结果:HE染色:镜下见肿物大部分由甲状腺滤泡构成,小区域滤泡上皮乳头状增生,细胞核增大,呈毛玻璃样改变;可见异型甲状腺滤泡浸润骨质(图2A)。免疫组化染色:细胞角蛋白19片段(CK19)(+),甲状腺转录因子-1(TTF-1)(+),磷脂酰肌醇蛋白聚糖-3(G-3)(+),甲状腺球蛋白(+),P53(-),肿瘤增殖抗原67(Ki-67)<5%(图2B)。诊断为甲状腺乳头状癌转移瘤。术后患者恢复良好,甲状腺彩超发现多个病灶,考虑甲状腺肿瘤。患者及家属考虑其年龄大,拒绝进一步治疗,自动出院。随访1年,患者死亡,原因不明。
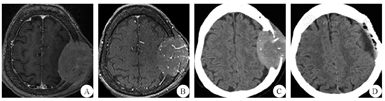

A:术前轴位T1 FLAIR增强;B:术前轴位3D-TOF MRA;C:术前轴位CT所示脑窗;D:术后轴位CT所示脑窗FLAIR:液体衰减反转恢复序列;3D-TOF MRA:三维飞行时间磁共振血管成像
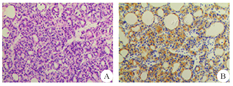

A:HE染色;B:免疫组化染色
患者2 女性,61岁,因"右下肢乏力2个月余"于2016年6月2日入院。患者于2个月前自觉右下肢乏力伴言语欠流利,无头晕、头痛,无恶心、呕吐,无视物模糊,无抽搐。自起病来,患者精神尚可,二便无异常。既往有甲状腺肿大病史30余年,未行治疗。体检:神清,一般情况良好,KPS评分100分。甲状腺检查示左侧甲状腺二度肿大,左、右侧甲状腺均可触及结节,边界清楚,质地较韧,表面光滑,可随吞咽上下移动。神经系统检查:左侧肢体肌力正常,右下肢肌力4+级,右上肢正常,其他无异常。实验室检查无异常,胸部CT、心脏、肝胆胰脾、泌尿生殖系彩超均未见明显异常。甲状腺彩超示:双侧甲状腺内多个低回声光团,右侧甲状腺内最大直径约为2 cm,考虑甲状腺肿瘤。头颅MRI示:左枕叶一个类圆形肿物,呈稍长T2信号,边界清楚,左枕顶叶大片脑水肿灶,左侧脑室受压变形,中线右偏1.5 cm;增强后肿物明显强化,基底与硬膜相连(图3A)。磁共振波谱(MRS)示:N-乙酰门冬氨酸(NAA)/胆碱(Ch)、NAA/肌酸(Cr)值降低,Cr峰及NAA峰降低、Ch峰增高(图3B),考虑为脑膜瘤或血管周细胞瘤。颈部CT示:甲状腺增大,左右叶及峡部内多个大小不等、混杂密度肿块,边界欠清,左侧甲状腺最大肿块直径为1.8 cm×2.1 cm×2.2 cm,右侧最大直径为3.3 cm×2.7 cm×2.8 cm;颈部Ⅰ~Ⅳ区均可见数枚小淋巴结影,较大者约0.6 cm×0.5 cm(图3C),考虑甲状腺肿瘤。2016年6月11日行左侧枕叶肿瘤切除术,术中见肿瘤位于蛛网膜下腔,与硬脑膜无黏连,呈紫红色,边界清楚,有薄层包膜,质地偏软,血供丰富,与脑表软膜关系密切,将肿瘤与正常脑组织分离后完整切除。术后患者恢复良好,MRI复查示:肿瘤已完整切除(图3D)。术后病理结果:HE染色为腺癌,部分腺腔内见红染胶质样物(图4A)。免疫组化染色:CK19(部分+),TTF-1(90%+),G-3(+),甲状腺球蛋白(+),P53(-),Ki-67(5%+)(图4B)。诊断为转移性甲状腺癌。2016年6月28日患者在本院行双侧甲状腺全切术+峡部锥状叶切除术,术后病理结果:甲状腺滤泡癌。术后转核医学科行131I、甲状腺激素替代治疗。随访4年,未见肿瘤复发。
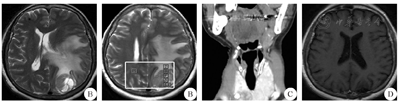

A:术前轴位T2 FLAIR增强;B:术前MRS;C:术前冠状位颈部CT;D:术后轴位T1 FLAIR增强;FLAIR:液体衰减反转恢复序列;MRS:磁共振波谱
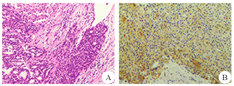

A:HE染色;B:免疫组化染色
近年来随着肿瘤筛查手段的普及,甲状腺癌的检出率呈迅速上升的趋势,在我国以每年超过20%的速度增长,甲状腺癌患者一般预后良好,死亡率低,5年相对存活率为67.5%[2]。甲状腺癌根据组织学分化程度可分为分化型甲状腺癌和未分化型甲状腺癌。分化型甲状腺癌包括乳头状腺癌(PTC)、滤泡状腺癌(FTC),其中,PTC占分化型甲状腺癌的80%~85%,FTC占10%~15%[3]。分化型甲状腺癌一般预后良好,但5%~23%有远处转移,预后较差,远处转移常好发于肺,其次是骨,骨转移发生率为4%~13%,常转移至肋骨、椎骨和胸骨、肱骨等,颅骨转移仅占骨转移中的2.5%[5]。颅骨转移以FTC为主,多数为60~70岁女性患者[6]。甲状腺癌发生脑转移更为少见,以PTC为主,约占0.3%,大多数在45~70岁,性别无明显差异,甲状腺癌脑转移发展迅速,预后差,自然病程中位生存时间仅1~2个月[6]。
甲状腺癌颅骨转移少见,多为个案报告,且其临床表现不典型,故容易被误诊为其他颅骨病变,如嗜酸性肉芽肿、骨肉瘤、脑膜瘤等。本文中患者1无明显的甲状腺肿瘤临床表现及病史,影像学表现与恶性脑膜瘤和颅骨恶性肿瘤极为相似,术前难以确诊。因肿瘤侵犯颅骨和硬脑膜,且血供丰富,故手术难点在于如何控制术中出血及完全切除肿瘤。Sisson等[7]报道1例甲状腺颅骨转移患者在第1次手术中,因术中出血较多而未能完全切除肿瘤所侵犯的颅骨而导致肿瘤复发。在本文患者1的手术中,我们从正常颅骨处切开,将颅骨瓣和肿瘤从硬膜上完整剥离,从而减少了出血。同时一期行颅骨成形术,可避免再次行颅骨修补术的必要。另外,对甲状腺癌原发病灶的处理也不容忽视。Sheikh等[8]检索近30年文献显示,共有21例PTC患者发生颅骨转移,其中2例死亡,1例因拒绝任何治疗而死亡,另一例仅接受转移病灶切除术而未接受其他任何治疗,其余患者接受了相应的手术+放化疗,都取得了良好的疗效。本文中患者1虽然颅骨转移瘤全切除,影像学检查也未见其他部位存在转移灶,且术后免疫组化染色结果显示P53(-)、Ki-67<5%,提示肿瘤增长速度缓慢,恶性程度较低,但家属因其年龄大而放弃治疗,术后1年死亡,原因不明,故原发灶的治疗及后续的综合治疗十分重要。
甲状腺癌脑转移临床少见,其临床表现和影像学特点无明显特征,从而增加了术前诊断的难度[9]。本文中患者2虽有30余年甲状腺肿病史,但术前临床资料未提示甲状腺癌,且头颅MRI示肿瘤位于脑实质外面、与硬膜关系密切、瘤周水肿严重,故影像学诊断为脑膜瘤或血管周细胞瘤。
目前,甲状腺癌颅内转移的治疗仍以手术治疗为主,放化疗为辅。对于KPS评分大于70分患者,颅内单个病灶切除后可以明显改善其长期预后[10]。除了切除颅内病灶外,对甲状腺原发病灶的处理同样重要,目前国际上公认的分化型甲状腺癌综合治疗措施为甲状腺全切或近全切除术+术后131I照射靶向治疗+甲状腺激素抑制治疗[11]。在对原发病灶和转移灶处理之后,综合治疗可以明显改善预后,如国外研究指出立体定向放射治疗、全脑放射治疗及酪氨酸激酶抑制剂治疗能显著提高生存率。根据美国癌症联合委员会甲状腺癌分期系统第八版所述,对于年龄大于或等于55岁的患者,出现远处转移即处于肿瘤淋巴结转移(TNM)分期的Ⅳ B期,预后较差,治疗目的在于延长生命,故应兼顾原发病灶及转移病灶的治疗[12]。本文患者2脑肿瘤术后病理结果为转移性甲状腺癌,进一步行甲状腺癌原发灶切除术、131I治疗及甲状腺激素代替等综合治疗,随访4年肿瘤无复发。
综上所述,由于甲状腺癌转移至颅骨或颅内在临床罕见、影像学表现不典型,术前难确诊,应高度警惕。对难以鉴别的颅脑肿瘤,详细病史咨询、体格检查、相应的实验室和影像学检查是非常必要的,以排除甲状腺癌或其他肿瘤转移。
对甲状腺癌转移至颅骨或颅内的患者,其已为全身性病变而不再是局部病变,治疗应兼顾转移瘤和原发肿瘤,因此我们认为手术完全切除转移病灶和原发病灶,术后进一步综合治疗可明显改善患者预后。
所有作者均声明不存在利益冲突


























