
评估C-反应蛋白(CRP)与非小细胞肺癌(NSCLC)化疗患者总生存时间的相关性。
纳入96例进展期(ⅢB/Ⅳ期)NSCLC患者。依据纳入时间将所有患者分为两组,分别为初治组(48例)和复治组(48例)。依据CRP水平将患者分为低、中、高水平三组(将所有患者依据CRP水平由高到低排序,取其1/3和2/3切点为分界点,即0.6 mg/L和7.3 mg/L)。采用Kaplan-Meier法和Cox比例风险模型评估CRP与生存时间的相关性。
在不同年龄、性别、吸烟史、病理分型和分期间,CRP与生存时间显著相关(P<0.05)。不同病理分型下,CRP水平与生存时间亦显著相关(腺癌:P<0.001;鳞状细胞癌:P=0.032)。复治组CRP水平与总生存时间有相关性(P<0.001)。与CRP低水平组相比,CRP高水平组NSCLC总生存时间风险比为1.15(95% CI 0.82~1.61)。初治组和复治组患者的风险比分别为0.52(95% CI 0.16~1 .74)和1.77 (95% CI 0.73~4.26)。CRP高水平组患者化疗效果差。
NSCLC化疗患者CRP水平越高,化疗疗效越差,预后亦越差。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在我国,肺癌是导致患者死亡的主要癌症之一[1,2]。进展期肺癌患者5年生存率为2%,平均中位生存时间为6~12个月[3,4]。为了尽可能降低肺癌患者病死率,很多研究者通过鉴别基因标记来预测肺癌患者的风险或选择有效的治疗措施,包括核糖核苷酸还原酶M1 (RRM1)基因表达[5]、表皮生长因子受体(EGFR)基因突变[6,7]等。同时,另有研究通过鉴别一些潜在基因标记,如PTEN[8]、RRM1和切除互补交叉基因1(ERCC1)[9]。然而,因为实验操作复杂,未得到广泛应用。目前,血液中很多因子已被用来作为癌症患者生存的预后指标[10],而且可为治疗提供有效的生物靶点[11]。C-反应蛋白(CRP)是一种非特异性的炎症指标,其在细菌、真菌、病毒性感染中均会显著升高[12,13,14,15]。目前,恶性肿瘤患者炎性指标基线水平的升高与预后呈负相关已得到证实,其中包括非小细胞肺癌(NSCLC)[16]、结直肠癌[17]、肝细胞癌[18]、肾细胞癌[19]、卵巢癌[20]。此外,研究表明对于NSCLC患者,基线CRP水平的升高与预后呈负相关[21,22,23]。本研究中,我们通过小样本数据来评估基线CRP及化疗4个周期后CRP水平与NSCLC患者总生存时间的关系,同时对CRP水平与化疗疗效的相关性进行分析。
2010年1月至2014年1月间在南京大学医学院附属鼓楼医院就诊的96例进展期(ⅢB/Ⅳ期) NSCLC患者,其中腺癌73例,鳞状细胞癌23例。纳入标准:18岁以上的成年人,病理和细胞学诊断均为NSCLC,无影响CRP的合并疾病(如其他肿瘤、炎症、感染等)。
CRP水平可从常规的实验室检查中获得。依据纳入时间将所有患者分为两组,分别为初治组(48例)和复治组(48例)。初治组为即将开始首次化疗的患者(CRP值:基线CRP值);复治组为完成第4个周期化疗的患者(CRP值:第4个周期化疗结束后的CRP值)。依据CRP水平将患者分为低水平、中等水平、高水平三组(将所有患者依据CRP水平由高到低排序,取其1/3和2/3切点为分界点,即0.6 mg/L和7.3 mg/L)。
患者首次化疗前、化疗过程中每个月或化疗后、疾病进展时或下次化疗前进行胸部包括肝脏的CT扫描检查。肿瘤放射学评估在临床需要或怀疑疾病进展的情况下进行。每例患者的评估策略均一致,记录化疗前后患者的肿瘤评估参数总值。化疗反应的分类依据RECIST 1.0标准[24]。
总生存时间指从明确诊断开始到患者死亡的时间。死亡日期通过住院记录或当地派出所电脑联网系统进行查询。
采用SPSS 19.0软件进行统计学分析。通过Pearson χ2检验和one-way ANOVA比较三组不同CRP水平患者的基线特点和临床信息。采用Kaplan-Meier法评估总生存时间与CRP水平的关系,进一步分层分析不同病理分型和化疗状态下生存时间与CRP间的关系。各组间生存曲线差异性通过Log-rank检验评估。采用Cox比例风险模型评估不同临床病理患者CRP水平与生存时间的关系。所有统计学检验均为双侧,以P<0.05为差异有统计学意义。
以CRP水平分组的三组患者平均年龄分别为56、61、59岁,男性、吸烟、腺癌、Ⅳ期者更倾向于有较高的CRP水平(表1)。CRP低、中、高水平组中位生存时间分别为23.7、12.1、6.5个月,CRP水平越高生存时间越短,各组间差异有统计学意义(P<0.001)。
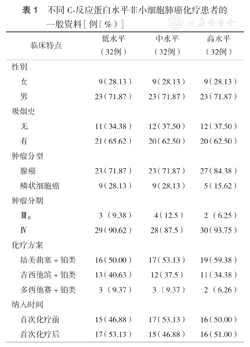
不同C-反应蛋白水平非小细胞肺癌化疗患者的一般资料[例(%)]
不同C-反应蛋白水平非小细胞肺癌化疗患者的一般资料[例(%)]
| 临床特点 | 低水平(32例) | 中水平(32例) | 高水平(32例) | |
|---|---|---|---|---|
| 性别 | ||||
| 女 | 9(28.13) | 9(28.13) | 9(28.13) | |
| 男 | 23(71.87) | 23(71.87) | 23(71.87) | |
| 吸烟史 | ||||
| 无 | 11(34.38) | 12(37.50) | 12(37.50) | |
| 有 | 21(65.62) | 20(62.50) | 20(62.50) | |
| 肿瘤分型 | ||||
| 腺癌 | 23(71.87) | 23(71.87) | 27(84.38) | |
| 鳞状细胞癌 | 9(28.13) | 9(28.13) | 5(15.62) | |
| 肿瘤分期 | ||||
| ⅢB | 3(9.38) | 4(12.5) | 2(6.25) | |
| Ⅳ | 29(90.62) | 28(87.5) | 30(93.75) | |
| 化疗方案 | ||||
| 培美曲塞+铂类 | 16(50.00) | 17(53.13) | 19(59.38) | |
| 吉西他滨+铂类 | 13(40.63) | 12(37.5) | 11(34.38) | |
| 多西他赛+铂类 | 3(9.37) | 3(9.37) | 2(6.26) | |
| 纳入时间 | ||||
| 首次化疗前 | 15(46.88) | 17(53.13) | 16(50.00) | |
| 首次化疗后 | 17(53.13) | 15(46.88) | 16(51.00) | |
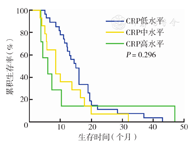
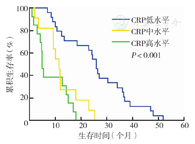
三组不同CRP水平的NSCLC患者生存时间差异有统计学意义(P<0.001)(图1)。不同病理分型患者亦存在类似差异(P<0.001,P=0.032)(图2、图3)。此外,复治组患者CRP水平与生存时间有相关性(P<0.001),初治组患者CRP水平与生存时间无相关性(P=0.296)(图4、图5)。
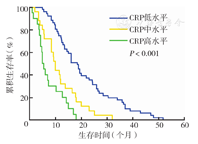

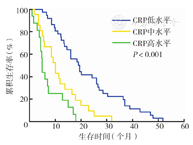

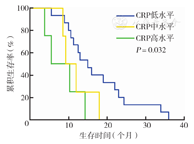



Cox比例风险模型分析结果显示CRP水平越高,患者预后越差(风险比为2.14; 95 % CI:1.28,3.59)(表2)。复治组患者CRP水平与生存时间显著相关(风险比为1.72;95 % CI:0.68,4.33;P<0.001),而在初治组患者中二者无相关性(P=0.296) (表3)。
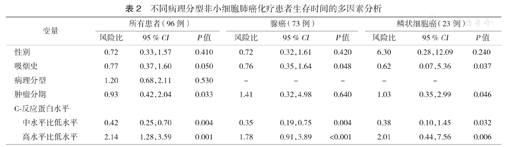
不同病理分型非小细胞肺癌化疗患者生存时间的多因素分析
不同病理分型非小细胞肺癌化疗患者生存时间的多因素分析
| 变量 | 所有患者(96例) | 腺癌(73例) | 鳞状细胞癌(23例) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 风险比 | 95 % CI | P值 | 风险比 | 95 % CI | P值 | 风险比 | 95 % CI | P值 | ||
| 性别 | 0.72 | 0.33,1.57 | 0.410 | 0.72 | 0.32,1.61 | 0.420 | 6.30 | 0.28,12.09 | 0.240 | |
| 吸烟史 | 0.77 | 0.37,1.60 | 0.050 | 0.76 | 0.35,1.64 | 0.048 | 0.62 | 0.07,5.36 | 0.037 | |
| 病理分型 | 1.20 | 0.68,2.11 | 0.530 | - | - | - | - | - | ||
| 肿瘤分期 | 0.93 | 0.42, 2.04 | 0.033 | 1.41 | 0.32,4.98 | 0.640 | 1.03 | 0.35,2.99 | 0.046 | |
| C-反应蛋白水平 | ||||||||||
| 中水平比低水平 | 0.42 | 0.25, 0.70 | 0.004 | 0.35 | 0.19, 0.75 | 0.004 | 0.38 | 0.10,1.45 | 0.032 | |
| 高水平比低水平 | 2.14 | 1.28, 3.59 | 0.001 | 1.78 | 0.91, 3.89 | <0.001 | 2.01 | 0.44,7.56 | 0.006 | |
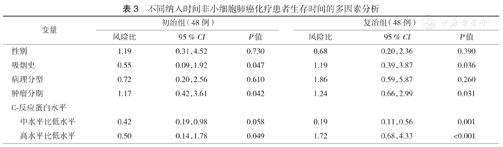
不同纳入时间非小细胞肺癌化疗患者生存时间的多因素分析
不同纳入时间非小细胞肺癌化疗患者生存时间的多因素分析
| 变量 | 初治组(48例) | 复治组(48例) | |||||
|---|---|---|---|---|---|---|---|
| 风险比 | 95 % CI | P值 | 风险比 | 95 % CI | P值 | ||
| 性别 | 1.19 | 0.31,4.52 | 0.730 | 0.68 | 0.20,2.36 | 0.390 | |
| 吸烟史 | 0.55 | 0.09,1.92 | 0.047 | 1.19 | 0.39,3.87 | 0.036 | |
| 病理分型 | 0.72 | 0.20,2.56 | 0.610 | 1.86 | 0.59,5.87 | 0.260 | |
| 肿瘤分期 | 1.17 | 0.42, 3.61 | 0.042 | 1.24 | 0.66,2.99 | 0.031 | |
| C-反应蛋白水平 | |||||||
| 中水平比低水平 | 0.42 | 0.19,0.98 | 0.058 | 0.19 | 0.11,0.56 | 0.001 | |
| 高水平比低水平 | 0.50 | 0.14,1.78 | 0.049 | 1.72 | 0.68,4.33 | <0.001 | |
CRP低水平组疾病进展率为6.3 %,较CRP中、高水平组患者的31.3 %、59.3%低,差异有统计学意义(P=0.017,P<0.001)(表4)。因此,CRP水平可以作为评估化疗疗效的潜在指标。
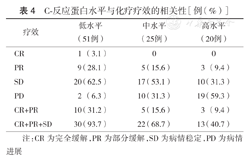
C-反应蛋白水平与化疗疗效的相关性[例(%)]
C-反应蛋白水平与化疗疗效的相关性[例(%)]
| 疗效 | 低水平(51例) | 中水平(25例) | 高水平(20例) |
|---|---|---|---|
| CR | 1(3.1) | 0 | 0 |
| PR | 9(28.1) | 5(15.6) | 3(9.4) |
| SD | 20(62.5) | 17(53.1) | 10(31.3) |
| PD | 2(6.3) | 10(31.3) | 19(59.3) |
| CR+PR | 10(31.2) | 5(15.6) | 3(9.4) |
| CR+PR+SD | 30(93.7) | 22(68.7) | 13(40.7) |
注:CR为完全缓解,PR为部分缓解,SD为病情稳定,PD为病情进展
已有研究表明CRP水平的升高与癌症患者生存时间的缩短相关[16,17,18,19,20,21,22,23]。本研究通过分层分析和回归模型分析表明,高水平CRP预示着较短的生存时间,该结果不受年龄、性别、吸烟史和病理分型等因素影响。此外,本研究结果还表明CRP水平与NSCLC患者化疗疗效显著相关。
本研究结果表明,CRP升高者倾向于男性和有吸烟史的患者,与已有研究结果一致。同时,Cox比例风险模型结果显示,即使在不同年龄、性别和吸烟史等因素下,CRP与生存时间依旧相关。为了进一步分析CRP与NSCLC患者生存时间的关系是否受病理分型的影响,我们将所有患者分为腺癌和鳞状细胞癌两组。结果显示CRP水平的升高依旧与NSCLC患者生存时间相关,且该结果不受吸烟史的影响。此外,为了观察不同化疗状态下CRP对预后的影响,本研究依据纳入时间将患者分为初治组和复治组,结果表明,相比初治组,复治组患者的CRP水平可更好地预测生存时间。综上,CRP可作为NSCLC患者独立的预后指标;CRP水平越高,患者化疗疗效越差,预后亦越差。
然而,到目前为止,血清CRP水平影响NSCLC患者生存时间的潜在机制尚不明确。可能与以下两方面有关:一方面可能是其介导的炎症促进肿瘤进展;另一方面也可能是高水平CRP会对宿主细胞产生分解作用从而降低机体免疫力[24]。CRP水平的升高与NSCLC的进展是否存在关键性的因果关系,或升高的CRP水平是否仅为NSCLC的一个炎性标记,尚不得而知。目前认为,肿瘤微环境中的慢性炎症可通过诱导DNA损伤、促进血管生成、促进肿瘤扩散转移来营造适合癌细胞生存的环境。炎症与癌症的联系是双向的,炎症可促进肿瘤的发生、发展,反过来肿瘤的发生、发展会诱导炎症产生[25]。通过这种方式,癌细胞可聚集大量的免疫细胞作为自己的"同谋",从而形成恶性循环[26,27]。因此,肿瘤的发展不仅依赖于肿瘤细胞和其基因,而且依赖于肿瘤细胞与周围细胞复杂的联系[28]。CRP作为一种炎性标记,其升高意味着癌症的发生与炎症相关。不论癌症分期如何,高水平CRP与进展性癌症的预后差均相关。
此外,本研究中通过不同纳入时间患者的比较,提示CRP可能与化疗患者的耐药性相关。已有研究表明白细胞介素-6(IL-6)与癌症耐药相关[29],Wang等[30]研究显示在人卵巢癌细胞中紫杉醇可上调IL-6;有研究[28]表明在脑癌中铂类药物可诱导IL-6表达,从而增加癌细胞的致瘤潜力。而IL-6作为前炎性因子,可进一步诱导CRP的产生。因此,我们认为,出现该现象可能是因为对于化疗无效的患者,在IL-6的刺激诱导下CRP在化疗后依旧处于高水平;其所介导的炎症反应可进一步促进NSCLC的恶性发展。但是,CRP与癌症耐药的关系尚无确切结论,需进一步研究。






























