
探讨D-二聚体、高密度脂蛋白(HDL)、癌胚抗原(CEA)和糖类抗原724 (CA724)联合检测在胃癌诊断中的价值。
选择胃癌患者103例和健康体检者111名,采用胶乳增强免疫比浊法测定D-二聚体水平,直接法测定血清HDL水平,化学发光法测定血清CEA和CA724水平,数据以中位数(四分位距)表示。通过ROC曲线分析每种检测指标及不同组合方式的敏感性、特异性。
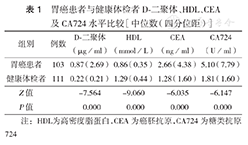
胃癌患者血清D-二聚体、CEA和CA724水平[中位数(四分位距)]分别为0.87 (2.69)μg/ml、2.66 (4.38) ng/ml和5.10 (7.79) U/ml,高于健康体检者的0.22 (0.21)μg/ml、1.28 (1.60) ng/ml和1.81 (1.60) U/ml(均P= 0.000);胃癌患者HDL水平为0.86 (0.35) mmol/L,低于健康体检者的1.29 (0.44) mmol/L (P=0.000)。D-二聚体、HDL、CEA、CA724的ROC曲线下面积分别为0.799、0.859、0.739、0.743。D-二聚体诊断分界点为0.46 μg/ml,敏感度为68.0 %,特异度为86.5 %;HDL诊断分界点为0.995 mmol/L,敏感度为73.8 %,特异度为84.7 %;CEA诊断分界点为3.585 ng/ml,敏感度为44.7 %,特异度为92.0 % ;CA724诊断分界点为3.765 U/ml,敏感度为57.3 %,特异度为89.2%。D-二聚体+HDL+CA724的ROC曲线下面积为0.942,敏感度为83.5 %,特异度为89.2 %。四者联合检测的ROC曲线下面积为0.948,敏感度为84.5 %,特异度为89.2 %。
D-二聚体、HDL、CEA和CA724联合检测可提高诊断的敏感性和特异性,对胃癌的诊断具有一定价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2012年全球肿瘤流行病学统计数据(GLOBOCAN2012)显示我国是胃癌的高发地区,2012年新发病例约40万,居所有恶性肿瘤发病率和病死率的第二位。但因胃癌临床症状不典型,缺乏敏感性和特异性高的肿瘤标志物,故早期诊断率不高。近年来,有临床研究认为胃癌患者存在不同程度的凝血功能障碍和血脂异常[1,2,3],且一些研究认为部分凝血指标如D-二聚体作为肿瘤标志物的诊断价值不劣于癌胚抗原(CEA)等常规肿瘤标志物[4]。因此本研究对103例胃癌患者及111名健康体检者的D-二聚体、高密度脂蛋白(HDL)、CEA和糖类抗原724 (CA724)进行分析,探讨四者联合检测对胃癌的诊断价值。
选择秦皇岛市第一医院2012年3月至2013年12月经胃镜确诊的胃癌患者103例,其中男性53例,女性50例,年龄31~ 78岁,中位年龄55岁。健康对照者来自该院健康体检人员,共111名,其中男性58名,女性53名,年龄29~ 79岁,中位年龄54岁。全部研究对象排除高血压病、糖尿病、心脏病、脑血管疾病、甲状腺疾病、出血、血栓性疾病、炎症及原发性血脂代谢异常。
抽取所有研究对象清晨空腹静脉血,分别采用日本日立7180全自动生化分析仪和德国罗氏esecsys2010全自动电化学发光仪测定D-二聚体、HDL、CEA和CA724。应用胶乳增强免疫比浊法检测D-二聚体水平,参考值范围为<1.5 μg/ml;直接法检测HDL,参考值范围为1.05~ 1.94 mmol/L。电化学发光法检测CEA和CA724,参考值范围分别为0~ 4.7 ng/ml, 0~ 8.2 U/ml。
应用SPSS 13.0统计软件分析数据,因大多数据不服从正态分布,故计量资料以中位数(四分位距)表示,两样本计量资料比较采用Wilcoxon秩和检验,采用ROC分析方法确定各指标的诊断界点并绘制ROC曲线。使用Binary logistic和ROC曲线进行多变量(多项测量指标)观察值的ROC曲线分析。以P<0.05为差异有统计学意义。
胃癌患者的血浆D-二聚体、CEA、CA724水平均高于健康体检者,胃癌患者HDL水平低于健康体检者,差异均有统计学意义(均P<0.05)(表1)。
胃癌患者与健康体检者D-二聚体、HDL、CEA及CA724水平比较[中位数(四分位距)]
胃癌患者与健康体检者D-二聚体、HDL、CEA及CA724水平比较[中位数(四分位距)]
| 组别 | 例数 | D⁃二聚体(μg/ml) | HDL(mmol/L) | CEA(ng/ml) | CA724(U/ml) |
|---|---|---|---|---|---|
| 胃癌患者 | 103 | 0.87(2.69) | 0.86(0.35) | 2.66(4.38) | 5.10(7.79) |
| 健康体检者 | 111 | 0.22(0.21) | 1.29(0.44) | 1.28(1.60) | 1.81(1.60) |
| Z值 | -7.564 | -9.060 | -6.035 | -6.147 | |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 |
注:HDL为高密度脂蛋白,CEA为癌胚抗原,CA724为糖类抗原724
D-二聚体、HDL、CEA、CA724的ROC曲线下面积分别为0.799、0.859、0.739、0.743,在胃癌的诊断中均具有一定价值。D-二聚体诊断分界点为0.46 μg/ml,敏感度为68.0 %,特异度为86.5 %;HDL诊断分界点为0.995 mmol/L,敏感度为73.8%,特异度为84.7 % ;CEA诊断分界点为3.585 ng/ml,敏感度为44.7 %,特异度为92.0 % ;CA724诊断分界点为3.765 U/ml,敏感度为57.3 %,特异度为89.2 %。各指标ROC曲线见图1、图2。
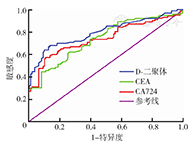

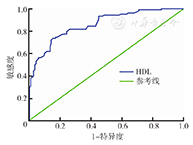

D-二聚体+HDL、HDL+CA724、D-二聚体+HDL+ CA724、D-二聚体+HDL+CEA、HDL+CA724+CEA、D-二聚体+ HDL+CA724+CEA联合检测的ROC曲线下面积均大于0.9,说明以上联合检测均具有较高的准确性(表2)。
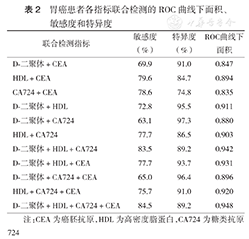
胃癌患者各指标联合检测的ROC曲线下面积、敏感度和特异度
胃癌患者各指标联合检测的ROC曲线下面积、敏感度和特异度
| 联合检测指标 | 敏感度(%) | 特异度(%) | ROC曲线下面积 |
|---|---|---|---|
| D⁃二聚体+CEA | 69.9 | 91.0 | 0.847 |
| HDL+CEA | 79.6 | 84.7 | 0.894 |
| CA724+CEA | 78.6 | 74.8 | 0.835 |
| D⁃二聚体+HDL | 72.8 | 95.5 | 0.911 |
| D⁃二聚体+CA724 | 63.1 | 97.3 | 0.880 |
| HDL+CA724 | 77.7 | 86.5 | 0.903 |
| D⁃二聚体+HDL+CA724 | 83.5 | 89.2 | 0.942 |
| D⁃二聚体+HDL+CEA | 77.7 | 93.7 | 0.931 |
| D⁃二聚体+CA724+CEA | 65.0 | 96.4 | 0.896 |
| HDL+CA724+CEA | 75.7 | 91.0 | 0.920 |
| D⁃二聚体+HDL+CA724+CEA | 84.5 | 89.2 | 0.948 |
注:CEA为癌胚抗原,HDL为高密度脂蛋白,CA724为糖类抗原724
针对胃癌的实验室诊断,目前临床及实验研究多集中于几种比较敏感和特异的肿瘤标志物的联合检测,关于非肿瘤标志物D-二聚体、HDL与胃癌相关肿瘤标志物的联合检测在胃癌诊断中的价值,目前尚鲜见相关报道。本研究将D-二聚体和HDL作为研究指标,评价其与CEA、CA724联合检测在胃癌诊断中的临床价值。
近年研究表明恶性肿瘤患者存在凝血功能异常,尤其是血清D-二聚体水平升高,且D-二聚体水平的增高常与患者的临床分期和不良预后相关[5,6,7,8]。Blackwell等[4]研究发现在转移性结直肠癌患者中,D-二聚体阳性率为88 %,CEA阳性率为86 %;疾病进展时84%的患者D-二聚体水平高于正常值,71 %的患者CEA水平高于正常值,且D-二聚体是患者总生存的独立预测因子。Aliustaoglu等[9]研究显示在胃癌患者中,D-二聚体的敏感度为86 %,特异度为81 %,阳性预测值和阴性预测值均为84%。Nagy等[10]发现在Ⅰ~Ⅱ期乳腺癌、结肠癌和卵巢癌中D-二聚体的阳性率分别为32.2 %、53.3 %、36.3 %,高于CEA的9 %、35.7%和8.3 %;在Ⅲ~Ⅳ期乳腺癌、结肠癌和卵巢癌中D-二聚体的阳性率分别为63.3%、60.0 %、61.5 %,高于CEA的23.3 %、33.3%和18.5 %;在各期乳腺癌、结肠癌和卵巢癌中D-二聚体的阳性率分别为41.6 %、57.7 %、53.8 %,高于CEA的12.9 %、34.8%和15.6 %。因此他们认为在恶性肿瘤患者中D-二聚体的阳性率等同于甚至高于传统肿瘤标志物CEA。本研究也发现胃癌患者血清D-二聚体水平明显高于健康体检者(P=0.000),D-二聚体的ROC曲线下面积为0.799,诊断分界点为0.46 μg/ml,敏感度为68.0 %,特异度为86.5 %,其在胃癌诊断中具有一定价值。
2010年Jafri等[11]对24项随机对照研究结果进行Meta分析,结果显示HDL水平与肿瘤发病率呈负相关,HDL浓度每增高100 mg/L,肿瘤发病率相对降低36 %。Tamura等[1]的研究进一步发现低HDL水平患者淋巴管和血管浸润率明显增高,其预后明显差于正常HDL水平患者。本研究结果显示HDL的ROC曲线下面积为0.859,高于CEA和CA724的曲线下面积,诊断分界点为0.995 mmol/L,敏感度为73.8 %,特异度为84.7 %,其在胃癌诊断中具有一定价值。
CEA是临床应用最广泛的肿瘤标志物之一。Bagaria等[12]报道CEA在胃癌中的敏感度为30.00 %,阴性预测值为58.82 %,曲线下面积为0.734。国内陈佳佳和吴荣[13]的研究结果显示CEA在胃癌中的阳性率为29.3 %,且男性患者CEA水平及阳性率(36.67 %)高于女性患者(15.63%),其水平随着肿瘤直径、浸润范围及分期增加而升高。唐箐等[14]报道CEA在胃癌诊断中的敏感度为24%,特异度为100%,准确度为78 %。本研究结果显示CEA的曲线下面积为0.739,诊断分界点为3.585 ng/ml,敏感度为44.7 %,特异度为92.0 %,与文献报道相符。
CA724是一种高分子质量糖类蛋白分子,存在于消化系统肿瘤中。Chen等[15]对中国33项相关研究的Meta分析结果显示,CA724的准确度为77%,高于CEA、CA199、CA125和CA242。唐箐等[14]报道CA724在胃癌诊断中的敏感度为36 %,特异度为92 %,准确度为72 %。另外Sun和Zhang[16]的研究表明术前CA724升高患者的总生存期明显短于CA724正常的患者,其值可提示疾病预后。本研究结果显示CA724的曲线下面积是0.743,诊断分界点为3.765 U/ml,敏感度为57.3 %,特异度为89.2 %。
以上结果显示,各检测指标的敏感性和特异性不能兼顾,能否通过联合检测提高敏感性和特异性从而减少漏诊和误诊成为我们研究的方向。本研究中,两项联合检测中HDL+CA724的敏感度为77.7 %,特异度为86.5 % ,ROC曲线下面积为0.903; D-二聚体+ HDL的敏感度为72.8 %,特异度为95.5 %,ROC曲线下面积为0.911;以上两种两项联合检测方法的ROC曲线下面积均大于0.9,具有较高的诊断准确性。三项联合检测中,D-二聚体+HDL+CA724的敏感度为83.5 %,特异度为89.2 % ,ROC曲线下面积为0.942; D-二聚体+HDL+CEA的敏感度为77.7%,特异度为93.7 % ,ROC曲线下面积为0.931;HDL+ CA724+CEA的敏感度为75.7 %,特异度为91.0%,ROC曲线下面积为0.920;以上三种三项联合检测方法的ROC曲线下面积较两项联合检测进一步提高,诊断准确性进一步增高。尤其是D-二聚体+HDL+ CA724组合,敏感性和特异性兼顾,准确性提高。D-二聚体+HDL+CA724+CEA四项联合检测的敏感度为84.5 %,特异度为89.2 % ,ROC曲线下面积为0.948,敏感性进一步提高。
由此可见,胃癌患者存在不同程度的D-二聚体和HDL水平异常。联合检测D-二聚体、HDL、CEA、CA724这些常规体检项目具有很高的敏感性和特异性,可作为很好的肿瘤标志物组合用于健康体检时胃癌的筛查,对提高无特异性症状胃癌的诊断率具有一定价值。






























