
苦参碱是苦参的提取物,可以抑制恶性肿瘤的增殖及迁移,诱导肿瘤细胞凋亡。细胞间的信号转导影响着肿瘤的生物学行为和生长状态,目前对于苦参碱抑制恶性肿瘤相关的信号通路研究除了被广泛研究的MAPK、JAK-STAT、NF-κB等外,还有近年来研究较热的Wnt/β-catenin和mTOR。这些通路主要经关键蛋白的磷酸化而激活,并联络其他不同通路,进而减轻肿瘤炎症反应、抑制肿瘤细胞的生长及生物学行为。研究苦参碱在抗癌过程中所经过的信号通路,可为苦参碱的分子靶向治疗提供理论基础,而与苦参碱相关的不同通路间的具体关系是今后值得深入研究的课题。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
恶性肿瘤目前严重威胁人类健康,其发生与相关信号通路密切相关。现应用于临床治疗恶性肿瘤的放化疗药物及分子靶向药物也较多,但面临着毒副作用大、费用高昂等问题,而中药在抗肿瘤方面发挥着独特作用[1]。苦参属于豆科植物,一般选取其干燥的根作为中药来源,在抑制恶性肿瘤及辅助放化疗方面应用广泛。苦参的提取物苦参碱(matrine)具有低毒性,属于四环的喹嗪啶类。目前有研究认为苦参碱可以通过抑制肿瘤增殖[2]及端粒酶活性[3],并通过抑制肿瘤细胞的侵袭与迁移[4],来阻止肿瘤的继续生长。随着对其抑癌机制的深入研究,信号通路成为其研究热点,现综述如下。
MAPK是广泛存在于哺乳动物细胞内的一类丝氨酸/苏氨酸蛋白激酶。最近对MAPK信号通路的研究取得很大进展。MAPK家族分4个成员:(1)细胞外信号调节激酶[MAPK/细胞外调节蛋白激酶(ERK)];(2)另类端激酶(c-JunN),又称应激激活的蛋白激酶系统;(3)p38 MAPK;(4)ERK5/BMK1 (BMK1)。其中ERK也被称为丝裂原激活的MAPK信号通路,而后3条为应激激活的通路。已有相关研究证实[5],MAPK信号转导通路可被一系列的细胞外信号或刺激物所激活,激活后的MAPK信号通路将细胞外信号转导至细胞及其核内,通过磷酸化核转录因子、细胞骨架蛋白及酶类等引起细胞生物学反应(如细胞增殖、分化、转化及凋亡等),并与炎症、肿瘤等多种疾病的发生密切相关。不同的MAPK信号通路,可由不同的刺激因素激活,形成不同的转导通路,通过其相互调控而介导不同的细胞生物学反应[6]。
与ERK相关的细胞内信号转导途径被认为是经典MAPK信号转导途径,ERK是MAPK的家族成员之一,在细胞信号转导网络中处于枢纽地位,是膜受体信号向细胞内传递的重要途径。该通路由一系列的磷酸化级联反应促成,其主要途径是Ras/Raf/MEK/ERK通路,外界刺激物与受体结合形成复合物,通过衔接蛋白将信号转给Ras蛋白后再与Ras-GDP结合,Ras-GDP与Raf形成一个短暂的膜锚定信号,活化的Raf可使MEK1/2(MAP-KK)磷酸化并被激活,随后经双磷酸化使ERK1/2激活,进而磷酸化许多与胞质和胞膜相连的底物,最终参与调节细胞的生长、增殖、分化、侵袭及肿瘤的发生、发展、转移。ERK还可被快速地转运入细胞核去磷酸化,并激活涉及增殖的转录分子,促进细胞增殖[7]。
阮梦然等[8]发现经苦参碱作用人横纹肌肉瘤RD细胞后,其ERK mRNA及磷酸化的ERK1/2表达水平被抑制,说明苦参碱对于横纹肌肉瘤细胞的抑制作用可能是通过MAPK/ERK信号通路实现的。蛋白激酶B(Akt)是MAPK/ERK途径上游的关键酶[9],Niu等[10]研究发现苦参碱可以通过抑制Akt来抑制ERK通路,从而抑制肺癌细胞。卢进昌等[11]研究认为MAPK/ERK信号通路在各种血管生成因子刺激内皮细胞中被激活,而其激活的结果主要是促进血管内皮细胞的增殖。当用苦参碱干预人脐静脉内皮细胞时,细胞增殖及ERK磷酸化明显受抑,其抑制程度近似于ERK抑制剂PD98059的抑制程度,提示苦参碱通过抑制MAPK/ERK信号通路中的关键信号分子ERK的磷酸化,从而抑制肿瘤环境下内皮细胞的增殖过程。由此可见,苦参碱对肺腺癌细胞的抑制是多方面的,不仅可以直接抑制肺腺癌细胞的生长,还可能对肺腺癌新生血管的形成产生抑制。
MAPK通路的一个重要分支之一为p38 MAPK信号通路。p38 MAPK通路可以被细胞外炎症因子、紫外线、细胞毒物质等多种应激刺激激活。p38 MAPK也是由3种激酶(MAPKKK、MAPKK、p38 MAPK)[12]构成一个连续的蛋白激酶反应链,把细胞外信号逐级向细胞内甚至细胞核传递,从而把膜受体结合的胞外刺激物与细胞质和细胞核中的效应分子连接起来。细胞受体与这些刺激物(细胞外信号)结合后,通过激活MAPKKK,由MAPKKK磷酸化激活MAPKK,再由MAPKK对MAPK双位点磷酸化,从而激活p38 MAPK。激活的p38可进入细胞核或转移到其他部位,进而诱导p38 MAPK基因转录,影响细胞的增殖、分化和细胞因子的合成[13]。
大量研究发现p38 MAPK通路的主要作用表现在细胞凋亡过程中,它通过转录因子的磷酸化而改变基因的表达水平,能对广泛的细胞外刺激发生反应,并被细胞外的多种应激(包括紫外线、放射线、热休克、促炎因子、特定抗原)激活。Ren等[14]认为在结肠癌中,苦参碱可以通过p38抑制结肠癌细胞的增殖及迁移。Liu等[15]则发现苦参碱能够通过p38信号通路促进人伯基特淋巴瘤细胞的凋亡。Yang等[16]认为苦参碱可以抑制MAPK信号通路中的ERK、JNK、及p38蛋白磷酸化,从而启动MAPK信号通路,达到对髓系白血病细胞株U937细胞的抑制作用。
JAK-STAT由一组转录因子活性的多肽配体组成,如细胞因子、受体相关的底物蛋白等,这条信号通路最先在干扰素信号转导研究中发现[17]。由于部分细胞及生长因子的受体分子缺乏酪氨酸蛋白激酶活性,不能依赖酪氨酸蛋白激酶启动信号通路,但其近端膜有能与非受体型酪氨酸蛋白激酶JAK相互作用的激酶,此类缺乏酪氨酸蛋白激酶的受体借助JAK激活STAT,从而最终影响基因的转录调节。不同的JAK-STAT信号转导通路被不同的细胞因子激活[18]。
Ma等[19]通过建立小鼠肺组织纤维化模型,研究苦参碱对肺癌组织纤维化的抑制作用。结果表明,JAK、STAT1和STAT3在肺癌纤维化模型组中有显著表达,这些表达逐渐积累,随后启动了JAK-STAT信号转导通路,从而刺激成纤维细胞及纤维母细胞增殖,最终形成肺纤维化,因此JAK-STAT信号通路在肺癌纤维化的形成中起重要作用,而苦参碱可以显著抑制JAK、STAT1和STAT3的表达,并可以清除氧自由基与细胞毒性效应。张培[20]则发现苦参碱对子宫颈癌SiHa细胞的抑制作用有可能通过JAK-STAT信号通路实现。炎症也是肿瘤形成及发展的重要机制,Yu等[21]认为,炎症因子白细胞介素-6也可促进STAT3信号通路的致癌作用。王秀玉等[22]则认为STAT1/STAT3几乎参与了所有炎症因子的细胞内信号转导过程,他们在大鼠脓毒症模型肺组织中检测到JAK2及STAT3的表达明显升高,经苦参碱干预后,JAK2、STAT3和炎性因子的水平明显下降,提示苦参碱可能是通过抑制JAK-STAT信号通路,进而抑制促炎因子(肿瘤坏死因子-α、白细胞介素-6)、细菌、病毒等对JAK2的激活作用完成的,这提示通过抑制JAK-STAT信号通路的活化,可以减轻肿瘤的炎症表现。
综上,可以推测苦参碱通过JAK-STAT信号转导通路抑制恶性肿瘤主要集中在肿瘤所致的纤维化和炎症方面,其抑制机制可能并不像其他信号通路一样直接影响肿瘤细胞的形态和行为,而是减缓恶性肿瘤所致的纤维化及炎症,提示苦参碱可以通过JAK-STAT信号转导通路减缓恶性肿瘤并发症。
NF-κB首先被Sen和Baltimore于1986年在真核细胞的转录因子中发现,哺乳动物NF-κB家族包括5个成员:p65 (RelA)、RelB、c-Rel、p50/p105(NF-κB1)和p52/p100 (NF-κB2),其参与的NF-κB信号通路主要涉及机体防御反应、组织损伤和应激、细胞分化、凋亡以及肿瘤生长抑制过程中的信息传递[23]。NF-κB是一种核转录因子,在未受刺激时以同源或异源二聚体形式与抑制因子IκBα结合,形成无活性的三聚体而滞留在细胞质。细胞受到外界刺激或处于应激状态时,可直接激活IκB激酶(IKK),诱使IκB发生磷酸化,随之IκB经泛素化改变其三维结构后使IκB蛋白迅速被水解释放,从而解除了IκB抑制作用。释放出的NF-κB二聚体在核定位信号的介导下,转位入核行使其转录因子功能,引发多种基因启动区特异的DNA结合序列结合,诱导靶基因mRNA的合成与表达,参与感染、炎症、免疫反应等多种病理生理反应[24],同时对肿瘤发生和发展进行调节。
研究表明NF-κB信号转导通路可以下调抑制肿瘤凋亡的基因,同时抑制肿瘤的恶性度[25]。该通路的信号转导分子为IκB和IKK。目前有文献报道苦参碱可通过该条通路抑制乳腺癌及肝癌,并可控制肿瘤炎症。Shao等[26]研究认为,苦参碱可以抑制乳腺癌细胞系细胞,并且抑制IKKβ的表达,提示苦参碱对乳腺癌的抑制作用可通过NF-κB信号通路。而Yu等[27]研究认为苦参碱作用于乳腺癌细胞MDA-MB-231后,可以抑制其增殖,降低bcl-2/bax蛋白、基质金属蛋白酶-9及其mRNA的表达,从而促进乳腺癌细胞凋亡,抑制其侵袭和迁移,同时他们还在癌细胞中检测到磷酸化的NF-κB表达,提示苦参碱抑制乳腺癌细胞MDA-MB-231的迁移及凋亡的过程可能是通过NF-κB信号通路完成的。有研究认为,苦参碱在细胞水平、代谢水平和基因水平上均诱导了HepG2细胞分化[28]。而李权林[29]发现苦参碱在诱导肝癌细胞凋亡的过程中活化了NF-κB,而苦参碱对NF-κB表达的下调作用在不同肝癌细胞系中存在差异。在减轻肿瘤炎症方面,杨志云等[30]通过建立2/3肝切除模型,研究苦参碱对肝再生及修复的作用机制,揭示肝大部分切除模型大鼠再生肝组织中有NF-κB蛋白表达,术后14 d为表达高峰,21 d表达下降,而苦参碱干预后NF-κB表达均减少,提示苦参碱通过降低NF-κB的活性来减轻炎症反应引起的肝损伤。
Wnt/β-catenin信号通路几乎参与了人体常见的恶性肿瘤,主要包括经典和非经典两条通路。经典Wnt/β-catenin信号通路调节细胞黏附、细胞形态、细胞增殖和组织重构,而非经典Wnt信号通路则调节细胞迁移、侵袭性和转移。据报道,在肿瘤细胞中,非经典通路可以对抗经典通路而发挥作用[31]。Wnt/β-catenin信号转导通路调节组织自我平衡和癌症的发生,它参与轴突形成的起始过程,在维持胚胎干细胞的自我更新及多能性中具有重要作用。
β-catenin、C-myc和Cyclin D1是该条通路的关键蛋白。周陈姣等[32]认为人类婆罗双树样基因(SALL4)调控Wnt/β-catenin信号通路,经苦参碱作用后,该基因及Wnt/β-catenin信号通路的3个下游靶基因β-catenin、C-myc和Cyclin D1均受到苦参碱的影响,并且基因的表达量对苦参碱有浓度依赖性,均随苦参碱浓度的增加而逐渐下调。而SALL4蛋白表达量的减少也与苦参碱浓度有关,提示苦参碱可能通过抑制人急性红白血病细胞株TF-1细胞的SALL4基因而抑制人红白血病细胞增殖、诱导细胞凋亡,并阻断Wnt/β-catenin信号通路的激活,以达到抗白血病的作用。在人肝癌细胞HepG3B细胞系中,Guo等[33]研究发现(0.05~ 0.8)mg/ml的苦参碱作用72 h,对该细胞的增殖、凋亡和细胞周期效果最为显著,并有可能通过β-catenin信号转导通路实现对上述细胞学行为的影响,从而抑制肝癌细胞。
mTOR是Heitman等[34]在分析啤酒酵母突变体对博雷霉素抵抗时首次发现的,它广泛存在于哺乳动物中,是一种进化保守的非典型的丝氨酸/苏氨酸蛋白激酶,主要通过PI3K/Akt/mTOR途径来实现对细胞生长、细胞周期等多种生理功能的调控作用。目前发现PI3K/Akt/mTOR信号通路的过度激活可加速细胞周期、减少细胞凋亡、并促进肿瘤细胞的迁移化,与肿瘤的发生、发展密切相关,是肿瘤治疗的一个重要靶点。
任志俭[35]认为苦参碱经过24 h不间断干预人肝癌HepG2细胞后,mTOR随着苦参碱浓度的增加而增加,磷酸化的mTOR用不同浓度的苦参碱作用24 h后,其蛋白的表达随着苦参碱浓度的增高而下降,呈剂量依赖性,说明了苦参碱呈剂量依赖性的规律抑制了mTOR蛋白的磷酸化,并且用Western blot技术检测到自噬现象发生过程中必不可少的基因Bechn mRNA及自噬发生的标志性分子LC3,提示mTOR信号转导通路可能是苦参碱作用于肝癌细胞HepG2而诱发其发生自噬现象的必经之路。
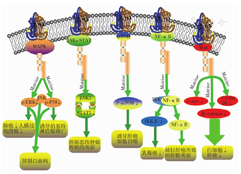
综上所述,在各种重要的信号转导通路中,苦参碱可以作用于不同肿瘤细胞的细胞系,经过不同的信号通路而发挥抗肿瘤作用(图1),苦参碱通过MAPK信号通路以ERK、p38、JNK为靶点,下调靶点的磷酸化水平,从而抑制肺癌、人横纹肌肉瘤、伯基特淋巴瘤、白血病;苦参碱仅对JAK-STAT通路上的JAK2-STAT3发挥作用,抑制恶性肿瘤所致的炎症;苦参碱通过下调磷酸化的mTOR而诱导肝癌自噬;在NF-κB信号通路中,IKK与NF-κB分开后发挥作用,苦参碱可以下调IKKβ抑制乳腺癌,通过NF-κB缓解肝癌所致的肝脏炎症;Wnt信号通路中,苦参碱可同时作用于C-myc、β-actenin和Cyclin D1 3个靶点来抑制白血病和肝癌。

随着苦参碱在临床上的广泛应用,对其作用机制的研究也逐步深入,涉及全身各个系统的恶性肿瘤。苦参碱可以联合信号通路上的不同细胞靶点增强其抗癌效果,为苦参碱抑制肿瘤的分子靶向治疗提供新思路。展望未来几年,对信号通路的探讨与研究仍是苦参碱作用机制的研究热点,但是因信号通路错综复杂,苦参碱对于某一种恶性肿瘤抑制作用是否能够同时通过好几条通路来发挥抑制肿瘤的作用还不得而知,故对每个通路之间的关系需要进行更为深入的研究。
无



























