
探讨血清肿瘤标志物癌胚抗原(CEA)、糖类抗原242(CA242)及热休克蛋白60(HSP60)联合动态检测在胃癌诊疗中的临床价值。
采用电化学发光法及酶联免疫吸附法检测113例胃癌患者、50例胃良性病变患者及50名健康体检者血清CEA、CA242、HSP60水平。
胃癌患者血清CEA、CA242、HSP60水平分别为(58.23±17.89)ng/ml、(94.98±32.37)U/ml、(1 288.34± 204.15)pg/ml,高于良性对照组[(2.26±1.03)ng/ml、(14.35±4.28)U/ml、(318.19±36.27)pg/ml]和健康对照组[(2.19±1.01)ng/L、(13.06 ± 3.97)U/ml、(310.36±31.79)pg/ml],均P<0.01。胃癌患者血清CEA、CA242、HSP60水平与患者性别、年龄、肿瘤部位无相关性(均P>0.05),与肿瘤直径、侵袭胃壁深度、分化程度、临床分期、腹腔积液、转移、复发及治疗后明显相关(均P<0.05)。三项肿瘤标志物联合检测诊断胃癌的特异度虽有所降低[82.00 %(41/50)],但敏感度、准确率明显提高,分别为95.58 %(108/113)、91.41 %(149/163),与各单项及两两组合检测比较,差异均有统计学意义(均P<0.05)。
血清肿瘤标志物CEA、CA242、HSP60联合动态检测可以提高胃癌的诊断效能,对监控治疗具有指导意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是最常见的恶性肿瘤之一,目前其发病率和病死率迅速上升,发病年龄逐渐下降,已引起普遍关注。由于胃癌早期多无明显症状,或仅有一些非特异性的消化道症状,确诊时多属中晚期,延误了最佳治疗机会。早发现、早诊断、早治疗是提高胃癌患者生存率的最有效手段,根治性治疗和对治疗后的随访监控是胃癌取得良好预后的途径[1]。近年来,分子生物学技术在肿瘤研究中深入开展,合理选择多种肿瘤标志物联合检测可以提高胃癌诊断的敏感度及准确度。
选取我院2010年1月至2013年6月住院治疗的胃癌初治患者113例,均经病理证实。男性63例,女性50例,中位年龄56岁(35~ 82岁)。肿瘤分化程度:高分化23例,中分化63例,低分化20例,未分化7例;按2010年国际抗癌联盟(UICC)/美国癌症联合委员会(AJCC)TNM分期标准:Ⅰ期20例,Ⅱ期26例,Ⅲ期45例,Ⅳ期22例;治疗方法:22例Ⅳ期患者行姑息性手术,其余91例行根治性切除术。以胃良性病变(胃炎、胃溃疡等)50例为良性对照组,均经胃镜活组织病理检查排除癌变,男性28例,女性22例,中位年龄55岁(28~ 85岁)。另选取50例健康体检者为健康对照组,男性27例,女性23例,中位年龄56岁(30~ 88岁)。三组人群年龄、性别等比较差异均无统计学意义(均P>0.05),具有可比性。
空腹采集胃癌患者术前、术后3个月及健康对照组、良性对照组静脉血各4 ml,经静置自凝后相对离心力2 264×g离心15 min分离血清,-20 ℃冰箱保存待检。癌胚抗原(CEA)、糖类抗原242(CA242)采用瑞士罗氏ELecsys-2010全自动电化学发光免疫分析仪及原装试剂检测;热休克蛋白60(HSP60)采用酶联免疫吸附法(ELISA)检测,试剂由美国R& D Systems公司提供,酶标仪为美国宝特-ELX808型。正常参考值:CEA≤3.40 ng/ml,CA242≤20.00 U/ml,HSP60≤412.00 pg/ml,高于阈值判断为阳性。联合检测任意一项阳性即判断为阳性,均为阴性即判断为阴性。
利用Excel 2003建立数据库,应用SPSS 13.0统计学软件,计量资料以均数±标准差( ±s)表示,二组比较采用t检验;计数资料比较应用χ2检验,以P<0.05为差异有统计学意义。
±s)表示,二组比较采用t检验;计数资料比较应用χ2检验,以P<0.05为差异有统计学意义。
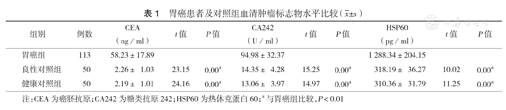
胃癌组患者血清CEA、CA242、HSP60水平与良性对照组及健康对照组比较,差异均有统计学意义(均P<0.01)(表1)。
胃癌患者及对照组血清肿瘤标志物水平比较( ±s)
±s)
胃癌患者及对照组血清肿瘤标志物水平比较( ±s)
±s)
| 组别 | 例数 | CEA(ng/ml) | t值 | P值 | CA242(U/ml) | t值 | P值 | HSP60(pg/ml) | t值 | P值 |
|---|---|---|---|---|---|---|---|---|---|---|
| 胃癌组 | 113 | 58.23±17.89 | 94.98±32.37 | 1 288.34±204.15 | ||||||
| 良性对照组 | 50 | 2.26± 1.03 | 23.15 | 0.00a | 14.35± 4.28 | 15.25 | 0.00a | 318.19± 36.27 | 10.02 | 0.00a |
| 健康对照组 | 50 | 2.19± 1.01 | 24.16 | 0.00a | 13.06± 3.97 | 14.97 | 0.00a | 310.36± 31.79 | 11.25 | 0.00a |
注:CEA为癌胚抗原;CA242为糖类抗原242;HSP60为热休克蛋白60;a与胃癌组比较,P<0.01
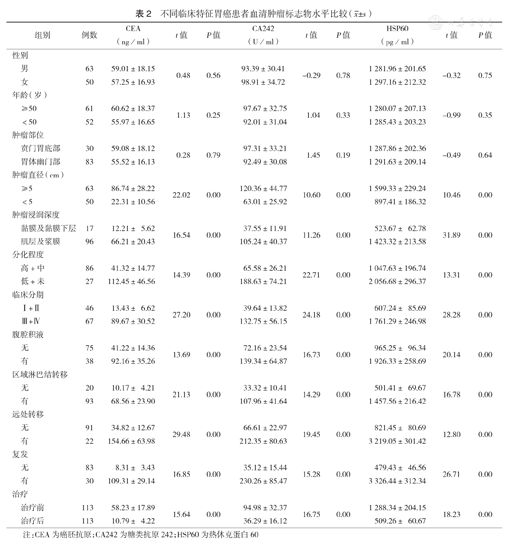
胃癌患者血清CEA、CA242、HSP60水平与性别、年龄、肿瘤部位无相关性(均P>0.05);与肿瘤直径、侵袭深度、分化程度、临床分期、腹腔积液、转移、复发及治疗后相关(均P<0.01)(表2)。
不同临床特征胃癌患者血清肿瘤标志物水平比较( ±s)
±s)
不同临床特征胃癌患者血清肿瘤标志物水平比较( ±s)
±s)
| 组别 | 例数 | CEA(ng/ml) | t值 | P值 | CA242(U/ml) | t值 | P值 | HSP60(pg/ml) | t值 | P值 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 性别 | |||||||||||
| 男 | 63 | 59.01±18.15 | 0.48 | 0.56 | 93.39±30.41 | -0.29 | 0.78 | 1 281.96±201.65 | -0.32 | 0.75 | |
| 女 | 50 | 57.25±16.93 | 98.91±34.72 | 1 297.16±212.32 | |||||||
| 年龄(岁) | |||||||||||
| ≥50 | 61 | 60.62±18.37 | 1.13 | 0.25 | 97.67±32.75 | 1.04 | 0.33 | 1 280.07±207.13 | -0.99 | 0.35 | |
| <50 | 52 | 55.97±16.65 | 92.01±31.04 | 1 285.43±203.23 | |||||||
| 肿瘤部位 | |||||||||||
| 贲门胃底部 | 30 | 59.08±18.12 | 0.28 | 0.79 | 97.31±33.21 | 1.45 | 0.19 | 1 287.86±202.36 | -0.49 | 0.64 | |
| 胃体幽门部 | 83 | 55.52±16.13 | 92.49±30.08 | 1 291.63±209.14 | |||||||
| 肿瘤直径(cm) | |||||||||||
| ≥5 | 63 | 86.74±28.22 | 22.02 | 0.00 | 120.36±44.77 | 10.60 | 0.00 | 1 599.33±229.24 | 10.46 | 0.00 | |
| <5 | 50 | 22.31±10.56 | 63.01±25.92 | 897.41±186.32 | |||||||
| 肿瘤浸润深度 | |||||||||||
| 黏膜及黏膜下层 | 17 | 12.21± 5.62 | 16.54 | 0.00 | 37.55±11.91 | 11.26 | 0.00 | 523.67± 62.78 | 31.89 | 0.00 | |
| 肌层及浆膜 | 96 | 66.21±20.43 | 105.24±40.37 | 1 423.32±213.58 | |||||||
| 分化程度 | |||||||||||
| 高+中 | 86 | 41.32±14.77 | 14.39 | 0.00 | 65.58±26.21 | 22.71 | 0.00 | 1 047.63±196.74 | 13.31 | 0.00 | |
| 低+未 | 27 | 112.45±46.56 | 188.63±74.21 | 2 056.68±296.37 | |||||||
| 临床分期 | |||||||||||
| Ⅰ+Ⅱ | 46 | 13.43± 6.62 | 27.20 | 0.00 | 39.64±13.82 | 24.18 | 0.00 | 607.24± 85.69 | 28.28 | 0.00 | |
| Ⅲ+Ⅳ | 67 | 89.67±30.52 | 132.75±56.15 | 1 761.29±246.98 | |||||||
| 腹腔积液 | |||||||||||
| 无 | 75 | 41.22±14.36 | 13.69 | 0.00 | 72.16±23.54 | 16.73 | 0.00 | 965.25± 96.34 | 20.14 | 0.00 | |
| 有 | 38 | 92.16±35.26 | 139.34±64.87 | 1 926.33±258.69 | |||||||
| 区域淋巴结转移 | |||||||||||
| 无 | 20 | 10.17± 4.21 | 21.13 | 0.00 | 33.32±10.41 | 14.29 | 0.00 | 501.41± 69.67 | 16.78 | 0.00 | |
| 有 | 93 | 68.56±23.90 | 107.96±41.64 | 1 457.56±216.42 | |||||||
| 远处转移 | |||||||||||
| 无 | 91 | 34.82±12.67 | 29.48 | 0.00 | 66.61±22.97 | 19.45 | 0.00 | 821.45± 80.69 | 12.80 | 0.00 | |
| 有 | 22 | 154.66±63.98 | 212.35±80.63 | 3 219.05±301.42 | |||||||
| 复发 | |||||||||||
| 无 | 83 | 8.31± 3.43 | 16.85 | 0.00 | 35.12±15.44 | 15.28 | 0.00 | 479.43± 46.56 | 26.71 | 0.00 | |
| 有 | 30 | 109.31±29.14 | 230.26±85.47 | 3 326.44±312.34 | |||||||
| 治疗 | |||||||||||
| 治疗前 | 113 | 58.23±17.89 | 15.64 | 0.00 | 94.98±32.37 | 16.75 | 0.00 | 1 288.34±204.15 | 18.23 | 0.00 | |
| 治疗后 | 113 | 10.79± 4.22 | 36.29±16.12 | 509.26± 60.67 | |||||||
注:CEA为癌胚抗原;CA242为糖类抗原242;HSP60为热休克蛋白60
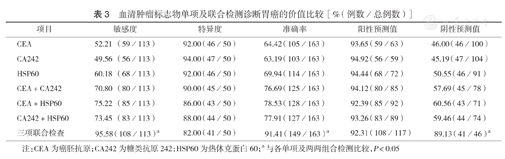
CEA、CA242、HSP60三项联合检测诊断胃癌的敏感度、准确率、阴性预测值与各单项、两两组合比较,差异均有统计学意义(均P<0.05)(表3)。
血清肿瘤标志物单项及联合检测诊断胃癌的价值比较[%(例数/总例数)]
血清肿瘤标志物单项及联合检测诊断胃癌的价值比较[%(例数/总例数)]
| 项目 | 敏感度 | 特异度 | 准确率 | 阳性预测值 | 阴性预测值 |
|---|---|---|---|---|---|
| CEA | 52.21(59/113) | 92.00(46/50) | 64.42(105/163) | 93.65(59/63) | 46.00(46/100) |
| CA242 | 49.56(56/113) | 94.00(47/50) | 63.19(103/163) | 94.92(56/59) | 45.19(47/104) |
| HSP60 | 60.18(68/113) | 92.00(46/50) | 69.94(114/163) | 94.44(68/72) | 50.55(46/91) |
| CEA+CA242 | 70.80(80/113) | 90.00(45/50) | 76.69(125/163) | 94.12(80/85) | 57.69(45/78) |
| CEA+HSP60 | 75.22(85/113) | 86.00(43/50) | 78.53(128/163) | 92.39(85/92) | 60.56(43/71) |
| CA242+HSP60 | 73.45(83/113) | 88.00(44/50) | 77.91(127/163) | 93.26(83/89) | 59.46(44/74) |
| 三项联合检查 | 95.58(108/113)a | 82.00(41/50) | 91.41(149/163)a | 92.31(108/117) | 89.13(41/46)a |
注:CEA为癌胚抗原;CA242为糖类抗原242; HSP60为热休克蛋白60; a与各单项及两两组合检测比较,P<0.05
肿瘤标志物是指在肿瘤发生和增殖过程中,由肿瘤细胞生物合成、释放或者是肿瘤与宿主相互作用而产生的一类物质,这类物质可在细胞、组织或体液中出现,反映着肿瘤的存在和生长,它们的存在或量的变化可以提示肿瘤的性质,了解肿瘤的组织发生、细胞分化、细胞功能,以帮助肿瘤的诊断、分类、预后判断以及指导治疗[2]。肿瘤标志物在血清中的出现早于临床症状,因此血清肿瘤标志物的检测为肿瘤的早期诊断提供了可能性。
CEA最初发现于结肠癌和胎儿肠组织中,通常健康人体内含量极微,多在3.4 ng/ml以下,但来自内胚层分化的组织恶变时,如结直肠癌、胃癌、食管癌、胰腺癌等几乎所有的胃肠道恶性肿瘤患者血清CEA水平显著升高,CEA是消化道肿瘤最可靠的肿瘤标志物之一[3]。本研究显示胃癌患者血清CEA水平显著高于良性对照组和健康对照组,其血清水平与肿瘤直径、临床分期、分化程度、转移密切相关,常作为胃癌治疗监测指标。但其敏感度较低,且正常吸烟人群血清CEA检测可出现假阳性。CA242是一种唾液酸化的鞘糖脂类抗原,健康人和良性病变时表达水平很低,其血液水平<20.00 U/ml,而在消化道恶性肿瘤其表达水平显著上调,胃癌患者血清CA242就有不同程度升高,升高幅度与恶性程度相关[4]。本资料显示胃癌患者血清CA242水平与肿瘤的直径大小有关,有转移及分期越晚的病例CA242表达水平越高。但CA242诊断胃癌的敏感度较低,本研究为49.56 %。
HSP60是HSP家族中的一员,是细胞受到各种刺激后产生的一种高度保守蛋白,主要通过在应激状态下生成保护细胞生命活动所必需的蛋白质以维持细胞生存,参与调解细胞的增殖、分化和细胞凋亡信号转导等重要的生物学功能[5],HSP60通过对多种蛋白质的构象(如折叠、装配及转运等)参与细胞生长、繁殖等重要生命过程,具有"分子伴侣"的作用[6]。胃癌是胃黏膜长期受到各种刺激及其他因素作用下逐渐发生癌变的,此过程HSP60合成不断增加,其原因可能为在胃癌发展过程中,癌细胞产生的HSP60释放至血液,引起外周血中含量升高,提示HSP60可能参与了胃癌的发生和发展[7]。本研究显示,HSP60诊断胃癌的敏感度为60.18%。但HSP60诊断胃癌的特异度较低,与良性病变(如胃幽门螺旋杆菌感染)存在一定的交叉现象。
综上,肿瘤标志物的检测对恶性肿瘤的诊断价值已受到临床的广泛重视,但单项检测却有敏感度不高、特异度不强、有时出现漏诊的现象[8]。本研究显示,CEA、CA242、HSP60三项指标联合检测诊断胃癌可以做到相互补充、相互印证,虽特异度略有下降,但敏感度、准确率、阴性预测值与各单项及两两组合检测比较明显提高(均P<0.05),减少了临床漏诊率,提高了准确性。术后密切随访肿瘤标志物,能早期发现复发和转移病灶,对指导治疗、预后评估有重要意义[9]。
无



























