
探讨胃癌患者血清中各细胞因子表达及其与临床特征间的关系。
运用高通量液相芯片技术对46例胃癌术前患者(胃癌组)和30名健康人(对照组)血清中ITAC、Fractalkine、白细胞介素8(IL-8)、IL-17A、IL-7、肿瘤坏死因子α(TNF-α)表达水平进行检测,以中位数(四分位数间距)表示。探讨各种细胞因子之间的相关性,并分析各个细胞因子与胃癌患者临床特征之间的关系。
胃癌组与健康对照组比较,血清中ITAC、Fractalkine、IL-8、IL-17A、IL-7、TNF-α表达水平升高,两组间各指标中位数(四分位数间距)比较差异均具有统计学意义[22.26 pg/ml (32.83 pg/ml)比11.95 pg/ml (9.99 pg/ml),P=0.001;62.21 pg/ml (82.23 pg/ml)比26.47 pg/ml (50.87 pg/ml),P=0.050;4.50 pg/ml (10.38 pg/ml)比2.06 pg/ml (3.17 pg/ml),P=0.002;0.83 pg/ml (2.01 pg/ml)比0.21 pg/ml(0.85 pg/ml),P=0.013;3.46 pg/ml (1.90 pg/ml)比2.11 pg/ml (1.48 pg/ml),P=0.001;1.21 pg/ml (1.13 pg/ml)比0.79 pg/ml (0.37 pg/ml),P<0.001]。各细胞因子表达之间具有相关性(均P<0.05)。胃癌有无淋巴结转移患者血清中各细胞因子表达水平差异无统计学意义(均P>0.05)。
ITAC、Fractalkine、IL-8、IL-17A、IL-7、TNF-α的高表达可能与胃癌的发生、发展有关。血清中高水平IL-8可能是预后不良的指标。各细胞因子之间的相互作用、相互影响与肿瘤的发生有着一定的关系。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是危害人类健康的常见恶性肿瘤之一,其发病率和病死率分别居全球第5位和第3位[1]。细胞因子在肿瘤的发病中发挥正向和负向调节作用。胃癌的发生、发展可能与细胞因子的表达水平异常有关。为探讨胃癌患者血清中细胞因子的表达水平及其临床意义,我们采用高通量液相芯片技术检测了胃癌患者血清中ITAC、Fractalkine、白细胞介素8(IL-8)、IL-17A、IL-7、肿瘤坏死因子α(TNF-α)的表达水平,探讨各种细胞因子之间的相关性,并分析了各个细胞因子与胃癌患者临床特征之间的关系。
收集2015年5月至8月就诊于我院的46例胃癌患者(胃癌组),均经病理组织学明确诊断为胃腺癌,之前未经放疗、化疗或生物免疫治疗,无糖尿病、高血压、心脏病等病史。其中男性38例,女性8例;有淋巴结转移28例,无淋巴结转移15例;年龄38~74岁,平均年龄(56.5±10.0)岁。以我院体检中心同期经体检合格的健康人30名为健康对照组,其中男性22例,女性8例;年龄30~79岁,平均年龄(53.4±14.3)岁。胃癌组与健康对照组年龄、性别构成等均具有可比性(均P>0.05)。
所有研究对象治疗前抽取清晨空腹外周静脉血4 ml,静置自凝后,离心半径17.5 cm, 2 500 r/min离心7 min,留取上层血清,然后分装冻存于-80 ℃低温冰箱中待检。血清ITAC、Fractalkine、IL-17A、IL-7、IL-8、TNF-α表达水平采用高通量液相芯片技术检测。检测仪器为标准化高通量检测技术平台Luminex 200多功能液相芯片分析仪,试剂盒为Milliplex MAP Human High Sensitivity T Cell Kit,购自美国Millipore公司。实验流程:(1)取出96孔板,每孔加入200 μl洗涤缓冲液,室温振荡10 min润洗,然后直接倒掉擦干;(2)分别加50 μl标准品及质控品至对应孔,样品孔中加25 μl实验缓冲液和25 μl样本血清;再在每孔中加入25 μl混合磁珠,4 ℃避光振荡培养过夜(16~18 h);(3)用手持式磁分离板洗涤3遍,每孔加入50 μl二抗,室温避光振荡1 h;(4)每孔加50 μl SAPE,室温避光振荡30 min;(5)用手持式磁分离板洗涤3遍,最后每孔加入150 μl鞘液,室温振荡器上振荡10 min,上机检测。
采用SPSS 17.0软件对数据进行统计学分析,采用Shapiro-Wilk检验法对各组数据进行正态性检验,经检验各细胞因子表达水平不符合正态性分布,用中位数(四分位数间距)[M(Q)]描述,两组间比较采用Mann-Whitney U检验,相关性分析采用Spearman相关分析法。检验水准α=0.05。
与健康对照组比较,胃癌组血清ITAC、Fractalkine、IL-8、IL-17A、IL-7、TNF-α表达水平升高,差异具有统计学意义(P<0.05)(表1)。
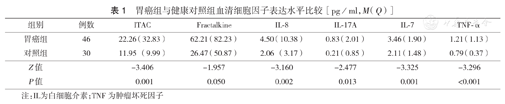
胃癌组与健康对照组血清细胞因子表达水平比较[pg/ml,M (Q)]
胃癌组与健康对照组血清细胞因子表达水平比较[pg/ml,M (Q)]
| 组别 | 例数 | ITAC | Fractalkine | IL-8 | IL-17A | IL-7 | TNF-α |
|---|---|---|---|---|---|---|---|
| 胃癌组 | 46 | 22.26(32.83) | 62.21 (82.23) | 4.50(10.38) | 0.83 (2.01) | 3.46(1.90) | 1.21(1.13) |
| 对照组 | 30 | 11.95 (9.99) | 26.47 (50.87) | 2.06 (3.17) | 0.21 (0.85) | 2.11(1.48) | 0.79(0.37) |
| Z值 | -3.406 | -1.957 | -3.160 | -2.477 | -3.325 | -3.296 | |
| P值 | 0.001 | 0.050 | 0.002 | 0.013 | 0.001 | <0.001 |
注:IL为白细胞介素;TNF为肿瘤坏死因子
有淋巴结转移胃癌患者血清中各细胞因子表达水平均高于无淋巴结转移者,但差异均无统计学意义(均P>0.05)(表2)。
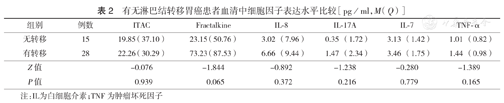
有无淋巴结转移胃癌患者血清中细胞因子表达水平比较[pg/ml,M(Q)]
有无淋巴结转移胃癌患者血清中细胞因子表达水平比较[pg/ml,M(Q)]
| 组别 | 例数 | ITAC | Fractalkine | IL-8 | IL-17A | IL-7 | TNF-α |
|---|---|---|---|---|---|---|---|
| 无转移 | 15 | 19.85(37.10) | 23.15(50.76) | 3.02 (7.96) | 0.35 (1.72) | 3.13 (1.42) | 1.01 (0.82 ) |
| 有转移 | 28 | 22.26(30.29) | 73.23 (87.53) | 6.66 (9.44) | 1.47 (2.34) | 3.46 (1.75) | 1.44 (0.98) |
| Z值 | -0.076 | -1.844 | -0.892 | -1.238 | -0.280 | -1.389 | |
| P值 | 0.939 | 0.065 | 0.372 | 0.216 | 0.779 | 0.165 |
注:IL为白细胞介素;TNF为肿瘤坏死因子
胃癌患者血清中ITAC表达与IL-7、IL-8、TNF-α表达呈正相关(均P<0.01);Fractalkine表达与IL-7表达呈正相关(P<0.01);IL-17A表达与IL-8、TNF-α表达呈正相关(均P<0.05);IL-7表达与IL-8、TNF-α表达呈正相关(均P<0.05);IL-8表达与TNF-α表达呈正相关(P<0.01)(表3)。
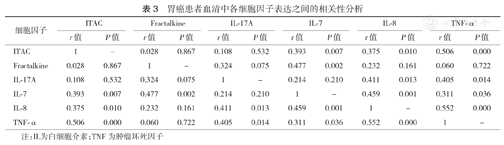
胃癌患者血清中各细胞因子表达之间的相关性分析
胃癌患者血清中各细胞因子表达之间的相关性分析
| 细胞因子 | ITAC | Fractalkine | IL-17A | IL-7 | IL-8 | TNF-α | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| ITAC | 1 | - | 0.028 | 0.867 | 0.108 | 0.532 | 0.393 | 0.007 | 0.375 | 0.010 | 0.506 | 0.000 |
| Fractalkine | 0.028 | 0.867 | 1 | - | 0.324 | 0.075 | 0.477 | 0.002 | 0.232 | 0.161 | 0.060 | 0.722 |
| IL-17A | 0.108 | 0.532 | 0.324 | 0.075 | 1 | - | 0.214 | 0.210 | 0.411 | 0.013 | 0.405 | 0.014 |
| IL-7 | 0.393 | 0.007 | 0.477 | 0.002 | 0.214 | 0.210 | 1 | - | 0.459 | 0.001 | 0.311 | 0.036 |
| IL-8 | 0.375 | 0.010 | 0.232 | 0.161 | 0.411 | 0.013 | 0.459 | 0.001 | 1 | - | 0.552 | 0.000 |
| TNF-α | 0.506 | 0.000 | 0.060 | 0.722 | 0.405 | 0.014 | 0.311 | 0.036 | 0.552 | 0.000 | 1 | - |
注:IL为白细胞介素;TNF为肿瘤坏死因子
近几年胃癌在全球的发病率虽有下降趋势,但仍是严重威胁人类健康的恶性肿瘤之一,我国每年新发病例约40万,死亡约30万[1]。细胞因子是把双刃剑,既可发挥免疫调节作用,在一定条件下也参与多种疾病的发生,如炎性疾病、自身免疫性疾病、肿瘤等。胃癌的发生、发展可能与细胞因子的异常表达有关。
本研究采用高通量液相芯片技术检测了胃癌患者血清中6种细胞因子的表达水平,该技术最大的特点为可以对同一份样品中的100种不同分子同时进行检测,利用荧光编码的微球共价交联单克隆抗体,与被测定的目标分子结合后,加入荧光素标记的检测抗体,再通过激光扫描荧光编码识别单个微球和测量"检测荧光"强度确定被测分子的浓度。液相芯片技术相较于传统的酶联免疫吸附法(ELISA法),具有高通量、样本用量少、操作简单、快速、灵敏度高、检测范围广、特异性强、准确性高、重复性好、费用低、灵活等优点[2]。
趋化因子(CK)是一类由白细胞和造血微环境中基质细胞产生的蛋白家族,与趋化因子受体(CKR)结合,使细胞发生趋化运动,诱导靶细胞发生趋化性迁移及细胞骨架重排,增强靶细胞和内皮细胞的黏附能力等,广泛参与细胞的生长、发育、分化、凋亡等多种生理过程[3]。CK不仅能趋化炎症细胞,其在肿瘤的生长和转移中也发挥着重要作用。
ITAC(CXCL11)主要表达于星形胶质细胞、支气管上皮细胞及血管内皮细胞,与受体CXCR3或CXCR7结合后发挥作用。先前的研究显示CXCL11与其受体结合后能诱导T细胞迁移,产生促炎作用,抑制血管内皮生长,调控血管生成等[4,5]。而近期研究表明CXCL11可促进肿瘤的生长和侵袭,进一步研究发现其发挥抗肿瘤或促肿瘤作用可能与其所结合的受体类型有关,如CXCR3占优势则发挥抗肿瘤作用,CXCR7占优势则发挥相反作用[6]。本研究中胃癌组CXCL11表达水平较健康对照组明显升高,可能与肿瘤引起的机体炎症和免疫反应有关;也可能是胃癌患者体内CXCL11与受体结合后促进了肿瘤细胞增殖。具体机制尚不清楚,有待深入研究。
Fractalkine(CX3CL1)是趋化因子CX3C家族的唯一成员,由激活的内皮细胞、神经细胞及成纤维细胞所表达,与其他趋化因子不同的是,它本身还是一种黏附分子,因此除了发挥趋化作用外,还能介导细胞间黏附。目前对于Fractalkine在肿瘤中的作用尚存在争议。一些研究显示,Fractalkine能够诱导CD4+ T细胞、CD8+ T细胞和NK细胞向肿瘤组织聚集而发挥抗肿瘤作用,在胃癌组织中,Fractalkine高表达组较低表达组预后好[7]。而另一些研究者则认为Fractalkine通过与肿瘤细胞表面的受体结合,在肿瘤发展及转移中发挥作用[8]。本研究中胃癌组血清中Fractalkine表达水平较健康对照组明显升高,与Lv等[9]的结果相一致,提示Fractalkine的高表达可能参与了胃癌的发生、发展过程,而其具体机制有待进一步研究。
IL-8是一种主要由单核-巨噬细胞产生的中性粒细胞趋化因子和活化因子,属于CXC趋化因子家族,能吸引和激活中性粒细胞,促进中性粒细胞的溶酶体活性和吞噬作用,趋化血管内皮细胞,促进血管的形成,并具有免疫调节作用,可影响肿瘤的微环境。现有研究表明IL-8是促进胃癌生长、转移和血管新生的关键因子之一。有研究发现胃癌患者血清中IL-8表达水平较健康对照组明显升高[10]。IL-8通过促进淋巴管内皮细胞的增生、透明质酸受体-1蛋白和mRNA的表达来促进胃癌进展和转移[11]。Kuai等[12]研究结果表明IL-8高表达能够增强胃癌细胞的黏附、迁移、侵袭和对化疗的抵抗作用,从而促进肿瘤的发展。本研究中胃癌组血清中IL-8水平较健康对照组显著升高,与以上研究结果相符,且有淋巴结转移组较无淋巴结转移组表达水平升高。IL-8可能促进胃癌进展和转移,可作为胃癌诊断的标志物及治疗的重要靶点之一。
IL-17A主要是由CD4+ Th17细胞产生的细胞因子,近年研究表明CD8+ T细胞(Tc17 )同样可以产生IL-17,发挥相似的功能。IL-17A通过诱导多种细胞产生炎性因子如TNF-α、IL-6、IL-1、趋化因子、粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)等,参与自身免疫性疾病如炎症性肠病、银屑病等以及移植排斥反应。一些研究表明胃癌组织IL-17A表达水平较正常组织明显升高,升高程度与肿瘤浸润深度、淋巴血管侵袭有关[13,14]。本研究结果显示胃癌组血清IL-17A水平较健康对照组升高,与上述研究结果相一致,提示IL-17可能促进肿瘤进展。而Iida等[15]研究显示胃癌术后患者腹腔灌洗液中IL-17 mRNA高表达者较低表达者生存时间延长,因此其可能作为肿瘤预后较好的一项指标。更有学者指出IL-17在肿瘤发生、发展过程中具有双重作用,既可通过促进血管生成和肿瘤细胞的迁移来促进肿瘤生长,又可通过促进细胞毒性T细胞免疫应答而抑制肿瘤的生长。胃癌患者血清中IL-17A表达的临床意义需进一步研究。
IL-7是由骨髓基质细胞产生的糖蛋白,是IL-2家族的重要成员之一,具有与IL-2相似的生物学活性。最初发现IL-7是B前体细胞生长因子,之后的研究表明IL-7也是一种T细胞生长因子,在T细胞发育和维持稳定方面发挥重要作用,并可增加细胞毒性T细胞及T杀伤细胞的数量,诱导促炎因子及增加单核细胞和T细胞的抗肿瘤活性[16]。研究表明IL-7基因整合至肿瘤细胞后,肿瘤细胞免疫原性增强,其机制可能与肿瘤细胞表面主要组织相容性复合体(MHC)抗原、细胞间黏附分子(ICAM)以及肿瘤相关蛋白等表达增强有关;IL-7基因修饰瘤苗能诱导机体的抗肿瘤细胞免疫,并使瘤细胞成瘤性下降,具有与IL-2一样的抗肿瘤作用。本研究结果中胃癌患者血清中IL-7表达水平较健康对照组升高,提示其在抗胃肿瘤方面发挥作用。
TNF-α主要由活化的巨噬细胞产生,具有杀伤靶细胞、促进细胞凋亡,参与局部炎症和内皮细胞活化的作用。本研究中胃癌组TNF-α表达水平较健康对照组升高,与Macrì等[17]的结果相一致,还有研究结果显示胃癌患者血清TNF-α表达水平较同年龄段健康人大大降低[18]。对于TNF-α在肿瘤发生、发展中作用的研究结果也是不一致的,有学者发现TNF-α可促进胃癌细胞的凋亡,抑制胃癌细胞的侵袭[19],也有研究者认为肿瘤微环境中TNF-α-TNFR1信号通过诱发Noxo1和Gna14来促进胃癌的发展[20]。因此TNF-α在胃癌患者血清中表达的临床意义仍存在争议,有待进一步加以探讨。
细胞因子的种类繁多,它们之间存在相互作用,构成一个复杂的细胞因子网络。
Fractalkine可上调IL-8的表达[21],TNF-α能促进IL-8的稳定表达,而IL-8是促进肿瘤生长、转移和血管新生的关键因子之一;IL-17A与TNF-α产生协同作用,促进多种细胞分泌促炎因子。本研究显示细胞因子表达之间存在相关性,其具体的相互作用机制有待进一步的探究。
总之,目前关于细胞因子的研究越来越广泛和深入,高表达的ITAC、Fractalkine、IL-8、IL-17A、IL-7、TNF-α可能为胃癌的诊断提供免疫学依据,IL-8高表达可能是胃癌预后不良的指标,并有望成为胃癌治疗的新靶点。本研究的细胞因子及病例数有限,因而细胞因子与肿瘤临床分期的关系还有待进一步研究。继续深入探讨细胞因子的作用机制,可能为肿瘤的诊断、病情监测及治疗提供免疫学依据。
无



























