
探讨鳞状细胞癌抗原(SCC-Ag)和癌胚抗原(CEA)联合检测对子宫颈癌的诊断、疗效评估、病情监测及预后分析的意义。
收集经病理确诊的子宫颈癌患者424例,妇科良性病患者400例,酶联免疫吸附法检测SCC-Ag和CEA水平,同时收集子宫颈癌患者的盆腔彩色超声检查结果并进行分析。
子宫颈癌组血清SCC-Ag、CEA及二者联合检测的阳性率[55.9 %(237/424)、26.4 %(112/424)、61.8 %(262/424)]均高于良性病组[12.0 %(48/400)、12.5 %(50/400)、14.5 %(58/400)](均P<0.05)。SCC-Ag和CEA联合检测对子宫颈癌诊断的灵敏度(61.8 %)高于CEA、SCC-Ag单项检测(55.9 %、26.4 %)(均P<0.05)。治疗前血清SCC-Ag、CEA水平在不同的临床分期、病理分型、浸润深度及淋巴结是否转移的子宫颈癌患者间的差异均有统计学意义(均P<0.05)。Ⅰ、Ⅱ期子宫颈癌患者SCC-Ag与CEA联合检测的阳性率[45.5 %(71/156)、73.2 %(139/190)]高于超声检查[33.3 %(52/156)、51.1 %(97/150)](P<0.05)。手术、同步放化疗和手术联合放化疗治疗后SCC-Ag水平(中位数为0.34、0.51、0.33 ng/ml)低于治疗前(0.48、3.44、1.29 ng/ml),CEA治疗后水平(中位数为0.75、0.81、0.71 ng/ml)低于治疗前(1.22、1.53、1.50 ng/ml)(P<0.05)。三种方式治疗后,SCC-Ag、CEA水平升高及未降至正常范围的子宫颈癌患者中分别有33.3 %(6/18)、56.5 %(13/23)和46.1 %(35/76)复发或转移。SCC-Ag阳性患者的生存率低于阴性患者(P<0.05),而CEA阳性和阴性患者的生存率差异无统计学意义(P>0.05)。
SCC-Ag和CEA联合检测可作为子宫颈癌辅助诊断的首选标志物。SCC-Ag和CEA联合检测可以作为临床分期、病理分型、浸润深度、淋巴结转移及疗效评价、预后判断的重要指标。对于Ⅰ、Ⅱ期子宫颈癌患者SCC-Ag和CEA联合检测的阳性率高于盆腔超声检查。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
子宫颈癌是女性最常见、最多发的恶性肿瘤之一,目前已高居妇女生殖系统恶性肿瘤发病率的首位,其中90 %以上的病例为鳞状细胞癌。我国每年新发病例约13.15万[1],发病率明显上升,年轻患者呈逐年增加的趋势。因此,早发现、早诊断及早治疗是延长患者生存时间、降低病死率的关键。寻找特异性的肿瘤标志物对子宫颈癌的早期诊断和合理治疗有重要意义。我们对子宫颈癌患者进行鳞状细胞癌抗原(SCC-Ag)和癌胚抗原(CEA)联合检测,并分析其对子宫颈癌诊断、疗效判断和预后评估的意义,现报道如下。
选择山西医科大学附属肿瘤医院2008年1月至2009年6月经组织病理学检测确诊为子宫颈癌的患者424例,均为女性,年龄22~81岁,平均年龄58.5岁。按国际妇产联盟(FIGO)1995年临床分期:0期24例,Ⅰ期156例,Ⅱ期190例,Ⅲ期54例。单纯手术治疗64例,同步放化疗123例,手术联合放化疗237例。收集妇科就诊子宫良性病患者400例作为对照组,其中子宫肌瘤357例,子宫息肉20例,子宫囊肿23例,患者年龄20~78岁,平均年龄53.5岁,并经检查均未伴发对SCC-Ag、CEA水平造成影响的其他疾病。所有良性病患者、子宫颈癌患者治疗前后均测定血清SCC-Ag及CEA水平,同时所有的子宫颈癌患者行盆腔彩色超声检查。对子宫颈癌患者进行病历回顾和电话随访,随访截止日期为2014年7月1日,终点事件为子宫颈癌复发或转移导致的死亡,截尾数据为失访、其他原因死亡或到随访截止日期仍生存的患者。
分别在治疗前、治疗后采集患者及对照组清晨空腹静脉血2~3 ml,分离血清后备用。采用奥地利TECAN全自动酶免工作站进行酶联免疫吸附法检测SCC-Ag和CEA水平,应用瑞典CanAg试剂进行分析,操作步骤严格按照试剂说明书进行,将SCC-Ag≥1.0 ng/ml、CEA≥3.0 ng/ml作为阳性参考值。两单项检测任一结果为阳性定义为SCC-Ag和CEA联合检测阳性。
采用SPSS 19.0统计软件进行统计学分析,因血清SCC-Ag和CEA水平总体分布为非正态分布,故采用中位数表示,采用Wilcoxon秩和检验和Kruskal-wallis检验;计数资料较采用χ2检验,采用McNemar检验比较SCC-Ag和联合检测、CEA和联合检测的灵敏度;生存分析采用Kaplan-Meier法,生存率比较采用Log-rank检验。以P<0.05为差异有统计学意义。
子宫颈癌组血清SCC-Ag、CEA及二者联合检测阳性率均高于对照组(均P<0.05)(表1)。424例子宫颈癌患者均有病理证实,SCC-Ag、CEA和联合检测的灵敏度分别为55.9 %(237/424)、26.4 %(112/424)、61.8 %(262/424),使用McNemar检验分别比较联合检测较SCC-Ag、CEA单独检测的灵敏度均高(分别为61.8 %比55.9 %、26.4 %,χ2值分别为23.04和150.00,均P<0.001)。
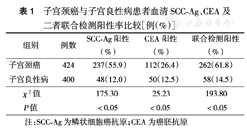
子宫颈癌与子宫良性病患者血清SCC-Ag、CEA及二者联合检测阳性率比较[例(%)]
子宫颈癌与子宫良性病患者血清SCC-Ag、CEA及二者联合检测阳性率比较[例(%)]
| 组别 | 例数 | SCC-Ag阳性(%) | CEA阳性(%) | 联合检测阳性(%) |
|---|---|---|---|---|
| 子宫颈癌 | 424 | 237(55.9) | 112(26.4) | 262(61.8) |
| 子宫良性病 | 400 | 48(12.0) | 50(12.5) | 58(14.5) |
| χ2值 | 175.30 | 25.23 | 193.80 | |
| P值 | <0.05 | <0.05 | <0.05 |
注:SCC-Ag为鳞状细胞癌抗原;CEA为癌胚抗原
子宫颈癌0期和Ⅲ期的患者SCC-Ag、CEA联合检测与超声检查的阳性率差异均无统计学意义(均P>0.05),Ⅰ、Ⅱ期子宫颈癌患者联合检测阳性率均较超声检查高(均P<0.05)(表2)。
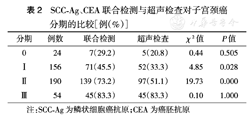
SCC-Ag、CEA联合检测与超声检查对子宫颈癌分期的比较[例(%)]
SCC-Ag、CEA联合检测与超声检查对子宫颈癌分期的比较[例(%)]
| 分期 | 例数 | 联合检测 | 超声检查 | χ2值 | P值 |
|---|---|---|---|---|---|
| 0 | 24 | 7(29.2) | 5(20.8) | 0.44 | 0.505 |
| Ⅸ | 156 | 71(45.5) | 52(33.3) | 4.85 | 0.028 |
| Ⅸ | 190 | 139(73.2) | 97(51.1) | 19.73 | 0.000 |
| Ⅸ | 54 | 45(83.3) | 45(83.3) | 0.10 | 1.000 |
注:SCC-Ag为鳞状细胞癌抗原;CEA为癌胚抗原
治疗前子宫颈癌患者血清SCC-Ag、CEA水平在不同的临床分期、病理分型、浸润深度及淋巴结是否转移间的差异有统计学意义(均P<0.05)(表3)。
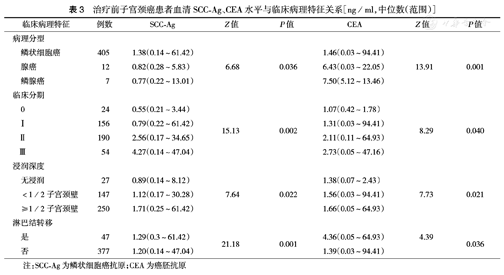
治疗前子宫颈癌患者血清SCC-Ag、CEA水平与临床病理特征关系[ng/ml,中位数(范围)]
治疗前子宫颈癌患者血清SCC-Ag、CEA水平与临床病理特征关系[ng/ml,中位数(范围)]
| 临床病理特征 | 例数 | SCC-Ag | Z值 | P值 | CEA | Z值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| 病理分型 | ||||||||
| 鳞状细胞癌 | 405 | 1.38(0.14~61.42) | 1.46(0.03~94.41) | |||||
| 腺癌 | 12 | 0.82(0.28~5.83) | 6.68 | 0.036 | 6.43(0.03~22.05) | 13.91 | 0.001 | |
| 鳞腺癌 | 7 | 0.77(0.22~13.01) | 7.50(5.12~13.46) | |||||
| 临床分期 | ||||||||
| 0 | 24 | 0.55(0.21~3.44) | 1.07(0.42~1.78) | |||||
| Ⅰ | 156 | 0.79(0.22~61.42) | 15.13 | 0.002 | 1.31(0.03~94.41) | 8.29 | 0.040 | |
| Ⅱ | 190 | 2.56(0.17~34.65) | 2.11(0.11~64.93) | |||||
| Ⅲ | 54 | 4.27(0.14~47.04) | 2.73(0.05~47.16) | |||||
| 浸润深度 | ||||||||
| 无浸润 | 27 | 0.89(0.14~8.12) | 1.38(0.07~2.43) | |||||
| <1/2子宫颈壁 | 147 | 1.12(0.17~30.28) | 7.64 | 0.022 | 1.56(0.03~94.41) | 7.73 | 0.021 | |
| ≥1/2子宫颈壁 | 250 | 1.71(0.25~61.42) | 1.66(0.05~64.93) | |||||
| 淋巴结转移 | ||||||||
| 是 | 47 | 1.29(0.3~61.42) | 21.18 | 0.001 | 4.36(0.05~64.93) | 4.39 | 0.036 | |
| 否 | 377 | 1.20(0.14~47.04) | 1.39(0.03~94.41) | |||||
注:SCC-Ag为鳞状细胞癌抗原;CEA为癌胚抗原
不同方式治疗后患者SCC-Ag、CEA水平均较治疗前下降(均P<0.05)(表4)。治疗后SCC-Ag、CEA水平升高或未降至正常范围内(SCC-Ag<1.0 ng/ml、CEA<3.0 ng/ml)的子宫颈癌患者共117例,单纯手术、同步放化疗和手术联合放化疗分别有18例(15.4 %)、23例(19.6 %)、76例(65.0 %),其中发生局部复发或转移分别有6例(33.3 %)、13例(56.5 %)和35例(46.1 %)。
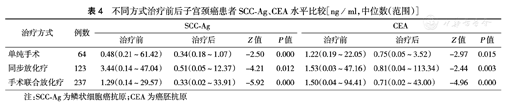
不同方式治疗前后子宫颈癌患者SCC-Ag、CEA水平比较[ng/ml,中位数(范围)]
不同方式治疗前后子宫颈癌患者SCC-Ag、CEA水平比较[ng/ml,中位数(范围)]
| 治疗方式 | 例数 | SCC-Ag | CEA | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | Z值 | P值 | 治疗前 | 治疗后 | Z值 | P值 | ||
| 单纯手术 | 64 | 0.48(0.21~61.42) | 0.34(0.18~1.07) | -2.50 | 0.000 | 1.22(0.19~22.05) | 0.75(0.05~3.52) | -2.97 | 0.015 |
| 同步放化疗 | 123 | 3.44(0.14~47.04) | 0.51(0.05~12.37) | -4.21 | 0.012 | 1.53(0.03~47.16) | 0.81(0.04~113.34) | -2.44 | 0.003 |
| 手术联合放化疗 | 237 | 1.29(0.14~29.57) | 0.33(0.02~33.91) | -5.92 | 0.000 | 1.50(0.04~94.41) | 0.71(0.02~43.00) | -4.96 | 0.000 |
注:SCC-Ag为鳞状细胞癌抗原;CEA为癌胚抗原
经随访,全部患者中失访7例,其他原因死亡4例。SCC-Ag阳性患者的生存优于阴性患者,5年生存率分别为66.2 %、79.7 %(χ2=9.52,P=0.002),而CEA阳性和阴性患者的生存率差异无统计学意义,5年生存率分别为73.2 %、71.2 %(χ2=0.03,P=0.872)(图1)。
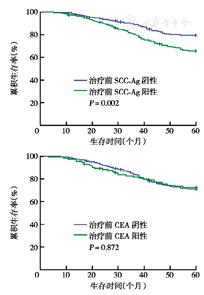

SCC-Ag是一种相对分子质量为42×103~48×103的糖蛋白,是1977年最先由Kato和Toriger用人子宫颈癌的异种血清从子宫颈癌组织中提纯而来的一种抗原TA-4,SCC-Ag是TA-4的14个亚基之一,属于丝氨酸蛋白酶抑制物家族[2],主要存在于子宫、子宫颈、肺、头颈等部位鳞状上皮细胞癌的细胞质中,在非角化的细胞中含量更加丰富,参与鳞状细胞癌的侵袭、浸润及远处转移,其在正常鳞状上皮组织中也有表达但含量极微。在某些良性疾病,如肺部感染、支气管囊肿、肝衰竭、某些皮肤病(银屑病、湿疹、天疱疮)以及反复发作的盆腔感染、膀胱炎和肾功能不全的患者中其水平也可以升高[3]。
CEA是一种相对分子质量约为180×103的糖蛋白,最初在结肠癌和胎儿肠管组织中发现。CEA是大肠癌组织产生的一类糖蛋白,可引起患者的免疫反应,广泛存在于内胚叶起源的消化系统肿瘤,也存在于正常胚胎的消化道组织中,在健康人的血清中也有微量的存在。它是一种非特异性的广谱性肿瘤标志物,能反映多种肿瘤的存在,可见于结肠癌、乳腺癌、肺癌等恶性肿瘤患者中。它多与其他肿瘤标志物联合检测,广泛用于多种肿瘤的辅助诊断及疗效评价。
邹杰等[4]报道妇科良性病组、子宫颈鳞癌组和子宫颈腺癌组的SCC-Ag阳性率分别为10.00 %、71.71 %、25.00 %。本研究中,子宫颈癌组SCC-Ag、CEA及二者联合检测的阳性率分别为55.9 %、26.4 %、61.8 %,明显高于子宫良性病组的12.0 %、12.5 %、14.5 %。提示SCC-Ag、CEA及二者联合检测结果阳性均可以作为诊断子宫颈癌的一项依据。本研究中三种检测方法对诊断子宫颈癌的灵敏度分别为55.9 %、26.4 %、61.8 %,联合检测的灵敏度高于两单独检测。因此,可认为SCC-Ag和CEA联合检测更适合作为子宫颈癌的辅助诊断。有研究表明,217例子宫颈癌患者中,CEA检测的准确度和灵敏度分别为24.4 %和46.7 %,提示CEA在子宫颈癌诊断中单一检测作用不大[5]。但是在Ⅲ期患者中,CEA阳性率为39.5 %,明显高于其他分期,提示CEA对晚期子宫颈癌的诊断有一定价值。另外,CEA对子宫颈癌的分型也有一定价值。有研究发现,子宫颈腺癌患者的血清CEA水平为(16.81±15.17)μg/L,明显高于子宫颈癌患者(10.78±9.98)μg/L[6]。因此,联合检测血清肿瘤标志物不但明显提高子宫颈癌诊断的灵敏度,还可以帮助区分肿瘤的病理类型,有助于早期诊断及治疗。
研究显示,血清SCC-Ag水平与子宫颈癌的临床分期、肿瘤最大直径呈正相关,但是SCC-Ag水平的高低与子宫颈癌的整体生存率无相关性[7]。但也有研究认为,血清SCC-Ag水平与临床分期无关。国外有研究报道,在印度南部的子宫颈癌患者中,SCC-Ag的表达与子宫颈癌的临床分期和淋巴结转移有关,而与肿瘤的大小和患者的年龄无关[8]。CEA水平高低与肿瘤分期、大小和是否发生转移明显相关,有研究表明,CEA阳性率随着子宫颈癌分期的进展而升高[9]。本研究发现,病理分型为鳞状细胞癌的患者SCC-Ag水平高于腺癌和腺鳞癌,CEA水平则低于腺癌和腺鳞癌;0~Ⅲ期子宫颈癌患者治疗前血清SCC-Ag和CEA水平随着分期变晚和浸润深度增加而逐渐升高;有淋巴结转移的子宫颈癌患者SCC-Ag、CEA水平也明显高于淋巴结未转移患者。国外有学者对116例子宫颈鳞状细胞癌患者进行多因素预后分析,发现SCC-Ag水平与临床分期、肿瘤浸润深度和淋巴结转移明显相关[10]。国内朱彦玲等[11]研究发现,SCC-Ag水平随着临床分期变晚而升高,淋巴结转移的患者SCC-Ag水平明显高于未转移的患者。而高宝荣等[12]将评估子宫颈癌患者发生淋巴结转移的术前血清SCC-Ag浓度确认至4 ng/ml。根据文献及本研究结果,我们认为SCC-Ag可用于评估子宫颈癌临床分期、病理分型、浸润深度及淋巴结转移情况。
本研究结果显示,Ⅰ、Ⅱ期子宫颈癌患者SCC-Ag和CEA检测的阳性率高于盆腔超声检查,但是0期和Ⅲ期患者两种检查没有明显差异。分析该结果可能是因为两种检查结果都与肿瘤的大小负荷相关。超声影像上0期子宫颈癌患者多表现子宫颈线光滑平整,而Ⅲ期患者大多可以观察到子宫颈结构破坏或有实性占位,这两种结果都较易观察和鉴别,所以两种检查的结果较为一致。目前,有很多效率更高的超声检查手段应用于子宫颈癌的诊断,例如经阴道彩色多普勒超声、超声造影。
目前认为,动态监测血清SCC-Ag及CEA水平在一定程度上可以反映子宫颈癌的发生发展过程及患者对治疗的反应。在本研究中,单纯手术、同步放化疗及手术联合放化疗三种方式治疗后,血清SCC-Ag和CEA水平比治疗前都出现不同程度的下降。同时,在治疗后也有117例SCC-Ag、CEA升高或未降至正常水准的患者,其中复发的54例患者占全部子宫颈癌患者的12.7 %。最近韩国学者回顾分析治疗后完全缓解的783例子宫颈鳞状细胞癌患者,发现154例复发,占全部病例的19.7 %,Cox多因素回归模型显示治疗前SCC-Ag>1.85 ng/ml、治疗后>0.9 ng/ml与低无进展生存率显著相关[13]。Hirakawa等[14]对108例ⅣA期放化疗子宫颈癌患者进行研究发现,手术或放化疗后SCC-Ag仍高的患者中62.5 %可以生存4年以上;而SCC-Ag下降至正常的患者中89.2 %可以生存4年以上。而且,46 %~92 %的子宫颈癌复发患者先于影像学出现血清SCC-Ag升高,在临床及影像学发现肿瘤复发之前2~8个月就可以检测出血清SCC-Ag水平升高[15]。可见,SCC-Ag和CEA是评价疗效、评估复发或转移的优良指标。
Olsen等[16]回顾性研究了63例经过同步放化疗的子宫颈癌患者治疗前后SCC-Ag水平,治疗前SCC-Ag<3 μg/L的患者比治疗前SCC-Ag>3 μg/L的患者对治疗的反应性更好,2年无病生存率也更高(73 %)。同步放化疗3个月后,SCC-Ag水平降至正常者2年无病生存率为62 %,未降至正常者则为0。提示,治疗前SCC-Ag升高和治疗后SCC-Ag未降至正常为影响治疗反应性和无病生存率的重要因素。本研究中,SCC-Ag阳性患者生存率明显低于阴性患者,而CEA阳性和阴性患者生存率接近。提示治疗前SCC-Ag水平可以反映子宫颈癌患者的预后。
综上所述,SCC-Ag是子宫颈癌的诸多肿瘤标志物中特异性较强的一种,在子宫颈癌的辅助诊断、监测疗效、预后评估方面发挥重要作用,可以作为子宫颈癌的首选肿瘤标志物。CEA是一种非特异性的广谱性肿瘤标志物,可见于结肠癌、子宫颈癌、肺癌等恶性肿瘤患者中,但是其对晚期子宫颈癌的诊断有一定价值。另外,CEA还可用于子宫颈鳞状细胞癌和腺癌的鉴别。因此,SCC-Ag和CEA的联合检测就成为子宫颈癌诊断、疗效评价及判断预后一个很好的选择,更大规模的临床研究有待开展。
无



























