
探讨胃神经鞘瘤的临床病理学特征、诊断及鉴别诊断。
对9例胃神经鞘瘤进行临床病理学分析。
9例患者中,男性4例,女性5例,年龄42~68岁,平均年龄57岁;主要表现为上腹部隐痛不适;肿瘤位于胃窦1例,胃体8例。肿瘤直径为1.7~ 8.0 cm,平均直径5.0 cm;未见明确包膜,切面呈淡黄色或灰白色,半透明,有光泽。显微镜下肿瘤位于黏膜肌层,呈球形或卵圆形,主要由交织条束状排列的梭形细胞组成,缺乏经典神经鞘瘤中常见的网状区和栅栏状核排列等结构。9例中8例见散在淋巴组织和4例见结节状淋巴套。免疫组织化学示S-100+,SMA、CD34、DOG-1和CD117均阴性。9例患者均获得随访,随访时间3个月~2年,均未见复发和转移(其中1例术后4个月死于胰腺癌)。
胃神经鞘瘤是神经鞘瘤的一种,其临床表现及生物学行为与经典型神经鞘瘤相同,认识这种亚型的组织学特征有助于正确诊断和鉴别诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经典型神经鞘瘤是一种缓慢生长的良性神经鞘膜肿瘤,有包膜,由排列有序、细胞丰富的束状区(Antoni A区)和疏松黏液样的网状区(Antoni B区)组成,瘤细胞在免疫表型和超微结构上有施万细胞的形态特征。神经鞘膜肿瘤(nerve sheath tumor)[1,2]是一种常见的软组织肿瘤。患者一般无症状,少数可伴有疼痛,肿瘤多分布于胃肠道,约占胃肿瘤的0.2 %[3],发生于实质脏器的神经鞘瘤比较少见,且容易误诊为其他类型的间叶性肿瘤,导致治疗不足或过度治疗。我们观察9例胃神经鞘瘤的临床病理特征,并结合文献复习探讨其病理学特点、诊断及鉴别诊断要点。
收集山西省肿瘤医院病理科2012年8月至2014年12月间存档的胃神经鞘瘤病例标本9例,9例患者中,男性4例,女性5例;年龄42~68岁,平均年龄57岁。7例患者临床表现为腹部不适或隐痛,1例表现为阴道不规则出血,1例腹痛、腹胀伴黄疸3个月。发病部位:胃窦1例,胃体8例。肿瘤直径1.5~ 8.0 cm, 8例临床诊断为胃间质瘤,其中1例合并子宫颈癌,1例合并胰腺癌,1例诊断为胃平滑肌瘤。手术方式:部分胃切除8例,腹腔镜下切除1例。随访时间3~ 28个月,1例术后4个月死于胰腺癌。
标本均经4%甲醛溶液固定,常规石蜡包埋,4 μm厚切片,光学显微镜观察。免疫组织化学采用EnVision二步法。所有一抗S-100、SMA、CD34、DOG-1、CD117和Ki-67均购自福州迈新生物技术开发有限公司。操作步骤按说明书进行。
免疫组织化学染色阳性细胞数>10%为阳性,<10%为阴性。S-100细胞质和细胞核着色为阳性,CD34、SMA以细胞质着色为阳性,CD117和DOG1以细胞质和(或)细胞膜着色为阳性。
肿瘤直径为1.7~8.0 cm,平均直径5.0 cm。肿瘤组织与胃黏膜关系密切,主要累及黏膜肌层及以下,肿瘤边界清晰,未见明确包膜,质稍韧或中等;肿瘤切面呈浅黄或灰白色,半透明,有光泽。
肿瘤主要累及黏膜下层及固有肌层(图1),表面被覆完整的黏膜,边界清晰。与经典型神经鞘瘤不同的是,细胞不呈明确地栅栏状排列,网状区不常见,瘤细胞偏丰富,核染色质粗、深染、并可显示一定的多形性(图2),部分病例中还可见到核仁及核分裂象(图3)。肿瘤中常见散在淋巴细胞和结节状淋巴套(图4、图5)。
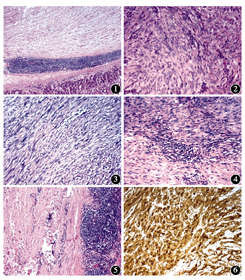

9例S-100均弥漫阳性(图6),阳性表达较强;肿瘤细胞SMA、CD34、DOG-1和CD117均阴性;瘤细胞Ki-67阳性率为1 %~3 %。
胃肠道间叶性肿瘤中胃神经鞘瘤较为罕见,最常见的是胃肠道间质瘤[4]、平滑肌瘤、神经纤维瘤、血管球瘤、平滑肌肉瘤、滑膜肉瘤等,本研究的胃神经鞘瘤病例约为同期胃间叶来源肿瘤的2%,与Hou等[5]报道的数据相近。
文献报道神经鞘瘤好发于老年女性患者[6],也可发生于中青年人,文献[7]报道发病年龄最小者为10岁。本组肿瘤主要累及胃体大弯(5例)、小弯(3例)和胃窦(1例),进一步证实胃体可能是胃神经鞘瘤的最常见发生部位。CT检查和内窥镜超声对诊断有一定的价值。临床胃神经鞘瘤因位于黏膜下形成黏膜溃疡而常被误诊为癌,即使胃镜活组织检查也常不能明确诊断[8,9]。CT检查胃神经鞘瘤表现为胃黏膜下肿块界清,常均质性增强,囊性变不多见[10]。胃神经鞘瘤均质、界清,无出血、坏死和囊性变等继发表现的特点,有助于与胃肠道间质瘤在CT等影像学诊断上鉴别,但在实际工作中,胃神经鞘瘤和良性及无继发表现的恶性胃肠道间质瘤影像学鉴别诊断仍较困难。Jung等[11]认为边缘光滑和均质性低回声有助于胃神经鞘瘤诊断,且内窥镜超声引导下的细针穿刺对明确消化道黏膜下肿块诊断有较大帮助。本组9例患者均行内窥镜超声检查,而无正确诊断者提示,超声内窥镜鉴别胃神经鞘瘤和胃肠道间质瘤仍十分困难;本组9例患者术前无一例正确诊断者也提示,由于胃神经鞘瘤罕见而术前正确诊断可能性较小。
骨神经鞘瘤生长缓慢、质实、黏膜下层及肌层的结节性肿块,切除不净,致反复复发。本组无一例复发,胃神经鞘瘤的生物学行为和经典型神经鞘瘤相同,其预后主要取决于手术是否能将肿瘤完全切除。
胃肠神经鞘瘤表面常被覆完整的黏膜,没有真正包膜,基本位于黏膜肌层,其次见于浆膜下和肌层。肿瘤直径为0.5~ 7.0 cm(平均3.0 cm),呈球形或卵圆形,偶尔为丛状多结节样。瘤细胞形态为梭形,常呈栅栏状或漩涡状排列,核端稍钝,可见小核仁,无核分裂。S-100呈弥漫强阳性,SMA、CD34、DOG-1和CD117均阴性。Nascimento和Fletcher[12]提出在神经鞘瘤中单独列出胃亚型。胃神经鞘瘤常表现为黏膜下肿物,肿瘤细胞形态和软组织神经鞘瘤相似,梭形的肿瘤细胞排列呈模糊的栅栏状或漩涡状,细胞核具有一定的异型性,核分裂象少见,但胃神经鞘瘤verocay小体少见,无Antoni A和Antoni B区分。较为突出的特点是肿瘤外周出现淋巴细胞套,并可伴有滤泡及生发中心形成[12,13]。本组患者中,有8例肿瘤周边出现淋巴组织,4例出现淋巴滤泡及生发中心。淋巴组织不仅可以出现在肿瘤外周,肌壁间、浆膜下等非肿瘤区域也可出现[14]。但文献[15]报道,某些诸如网状或微囊型等特殊类型的胃神经鞘瘤,肿瘤周边可没有淋巴组织增生。有学者认为,胃神经鞘瘤不会出现囊性变、出血坏死和透明变性的厚壁血管等现象,不会出现退行性改变,认为这是胃神经鞘瘤的一个特点[5,12,13]。但也有胃神经鞘瘤出现出血、囊性变的报道[14,16],这可能与肿瘤生长时间较长,肿瘤较大有关。
胃肠道间质瘤是胃肠道最为常见的非上皮肿瘤,切面呈灰白或棕褐色,可为实性,部分囊性,一般富于细胞,肿瘤边缘的淋巴组织增生现象罕见,CD117和DOG-1一般呈弥漫强阳性表达,CD34有一定比例的表达。S-100一般为阴性,个别病例可有灶状阳性,不会出现弥漫阳性,大多胃肠道间质瘤会出现KIT基因的激活突变。
多见于中年女性,发生在腹腔者可被误诊为胃肠道神经鞘瘤。肿瘤具有完整包膜,间质内常有泡沫细胞反应、其形态学主要特征为肿瘤内血管周围淋巴细胞浸润和伴有玻璃样变性的厚壁血管。和胃肠道神经鞘瘤一样,肿瘤周围也可见淋巴细胞套。一般无囊性变及PAS染色阳性物质出现,也无Antoni A和Antoni B区之分。胃恶性外周神经鞘膜瘤十分罕见。肿瘤细胞的异型性明显,坏死和核分裂象多见等可以帮助诊断。胃恶性外周神经鞘膜瘤周边细胞可呈神经纤维瘤的表现,该肿瘤具有化生性潜能,还有人推测,胃的恶性外周神经鞘膜瘤可能是一种胃肠道间质瘤。
多见于胃体,位于胃壁肌层。平滑肌瘤切面常呈灰白色,瘤细胞呈编织状结构,胞质红染。平滑肌肉瘤切面实性、灰红或暗褐色,常伴有出血坏死,瘤细胞密集,异型性明显,核分裂象易见,肌源性标志物SMA和desmin为阳性表达,S-100蛋白不会出现弥漫阳性表达。
神经纤维瘤可发生于胃内各部,瘤细胞排列稀疏呈长梭形,核常扭曲,不会出现Antoni A和Antoni B区域。免疫表型方面,神经纤维瘤NF一般为阳性,S-100不会出现弥漫阳性表达。而且胃单发的神经纤维瘤十分罕见。
手术切除是胃神经鞘瘤最可靠的治疗方法。目前也有内窥镜下切除的报道[17]。本组9例病例,8例行胃部分切除术,其中1例行腹腔镜切除。除1例死于胰腺癌外其余8例均未出现复发和转移。综上所述,胃神经鞘瘤是一种良性的间叶来源肿瘤,预后良好。其病理特点和软组织神经鞘瘤相比既有共性,又有自身特点。
无



























