
比较腹腔镜与传统开腹全直肠系膜切除术(TME)治疗直肠癌的效果,探讨腹腔镜下TME治疗直肠癌应注意的问题。
采用回顾性队列研究的方法,分析比较75例腹腔镜组患者与61例开腹手术组患者的围手术期相关指标及临床病理结果。
腹腔镜组与开腹手术组患者的手术切口[8.7 cm(8.0~10.0 cm)比13.6 cm(10.0~16.0 cm)]、术后镇痛药使用(8例比23例)、术后拔除引流管时间[5 d(5~6 d)比6 d(6~8 d)]、术后开始下床活动时间[3 d(3~7 d)比5 d(4~8 d)]及术后住院时间[6 d(5~18 d)比8 d(6~25 d)]方面,差异均有统计学意义(均P<0.05)。腹腔镜组的手术费用高于开腹组(平均每人多花费约7 000元)。腹腔镜组与开腹手术组的总体并发症发生率差异有统计学意义[6.7%(5/75)比13.1%(8/61),P<0.05]。
腹腔镜TME在术后镇痛药的使用、拔除引流管时间及住院时间等指标上较开腹手术具有优势,但腹腔镜手术因使用高值耗材而较开腹手术的治疗费用高。腹腔镜直肠癌切除需慎重。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是最常见的消化道恶性肿瘤之一,在美国,2016年结直肠癌预计增加8%,是癌症相关死亡的第三大原因[1,2]。在中国,结直肠癌发病率呈逐年上升的趋势[3],严重威胁人们的健康。全直肠系膜切除术(TME)能有效降低低位直肠癌术后局部复发率。本研究选择我院行手术治疗的直肠癌患者,比较腹腔镜与传统开腹TME治疗直肠癌的效果,就其围手术期相关指标及临床病理学指标进行分析,并探讨腹腔镜直肠癌切除术应注意的问题。
选择2010年1月至2015年12月间我院住院的直肠癌患者,接受直肠前切除(Dixon)术或腹会阴联合切除(Miles)术。采用回顾性队列研究进行资料收集。纳入标准:患者年龄≥18岁且<76岁;术前诊断明确肿瘤距肛门4~8 cm(齿状线上5 cm以内,腹膜反折以下);术前、术后病理检查均证实为直肠癌。排除标准:急诊手术;直肠癌累及临近器官造成手术无法切除;合并胃肠道其他严重疾病和(或)联合进行其他腹腔手术(单纯粘连松解术除外);孕妇;合并其他恶性肿瘤;有盆腔、腹腔手术史。开腹手术组75例,患者中位年龄46岁,其中男性35例,女性40例;国际抗癌联盟(UICC)分期Ⅰ期5例,Ⅱ期4例,Ⅲ期63例,Ⅳ期3例;肿瘤直径3.0 cm(2.0~6.0 cm),肿瘤距肛门的中位距离为5.0 cm。腹腔镜组61例,患者中位年龄48岁,其中男性29例,女性32例;UICC分期Ⅰ期3例,Ⅱ期6例,Ⅲ期51例,Ⅳ期1例;肿瘤直径4.0 cm(1.5~7.0 cm),肿瘤距肛门的中位距离为5.0 cm。腹腔镜组与开腹手术组患者的年龄、性别、肿瘤分期、肿瘤直径等差异均无统计学意义(均P>0.05)。
手术操作严格遵循无瘤原则及TME原则。患者采用全身麻醉,改良截石位。开腹手术组:按标准TME术式[4]实施。腹腔镜手术组:建立CO2气腹,压力维持在13~15 mmHg(1 mmHg=0.133 kPa)。置入Trocar后,探查腹腔,明确腹内脏器有无转移和腹腔种植。超声刀沿右结肠旁沟向上锐性分离至肠系膜下动脉根部,清除其周围淋巴结缔组织,分别用血管夹距肠系膜下血管根部约1~1.5 cm夹闭其远、近心端。切开乙状结肠左、右侧腹膜,上至降结肠,下至直肠前腹膜反折。注意勿损伤左侧输尿管。在骶骨岬水平,沿骶前间隙分离至骶椎前方的直肠骶骨筋膜(盆筋膜脏壁两层融合处),过尾骨尖达肛门。沿直肠前方的Denon-Villiers筋膜,向下行直肠前游离(男性通过两侧精囊腺达腺尖部,女性达阴道直肠隔下方),直至完全游离直肠系膜,避免损伤盆筋膜壁层和盆壁自主神经丛。距肿瘤下缘1~2 cm处用腔镜下线型切割闭合器切断肠管(助手经肛门指检协助定位,以确保切缘)。放气腹,于左下腹做4 cm小切口,取出切除的肠段,于肿瘤上缘10~15 cm处切断乙状结肠,保护肠管周缘动脉。将肿瘤肠段连同其系膜、腹膜后淋巴结脂肪组织整块切除。将近端结肠做一荷包缝合,置入吻合器抵钉座,收紧并打结固定,回纳肠段,关闭切口。重建气腹,助手自肛门置入吻合器头,腹腔镜下行直肠低位吻合。骶前置引流管,自右下腹壁Trocar孔引出。当肿瘤位置低无法保留括约肌时,取脐与左髂前上棘连线中外1/3交界处行人工腹壁造口术,通过会阴切口取出肿瘤及肠管,左上腹行人工腹壁造口。
临床病理学指标:肿瘤部位、肿瘤浸润深度、肿瘤TNM分期、肿瘤近端/远端切缘距离、切缘阳性率及清扫淋巴结个数、淋巴结阳性率。围手术期观察指标:手术时间、麻醉时间、是否术中输血、手术切口长度、伤口感染、其他合并疾病、二次手术率、术后住院时间及住院期间死亡率、术后镇痛药物的使用、肛门排气时间、术后开始进食时间、开始下床活动时间等。
采用SPSS 16.0软件对数据进行统计学分析。分类变量以率表示,使用χ2检验或Fisher确切概率法进行比较。定量变量满足正态分布以均数(范围)表示,使用Student t检验进行比较;不满足正态分布以中位数(范围)表示,用非参数检验进行比较:组间差异的比较用Mann-Whitney U检验,配对数据的比较用Wilcoxon秩和检验和Friedman检验,同时使用Bonferroni法校正调整事后多重比较。双尾法下获得的P值< 0.05为差异有统计学意义。
两组患者的手术可分为低位和超低位直肠癌切除吻合(低位包括距肛门4~8 cm、低于齿线上5 cm;超低位指距肛门4 cm以下)。两组手术时间、麻醉时间、术中输血等差异均无统计学意义(均P>0.05)。而腹腔镜组的手术切口小于开腹手术组,差异有统计学意义(P<0.05)(表1)。
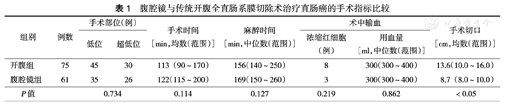
腹腔镜与传统开腹全直肠系膜切除术治疗直肠癌的手术指标比较
腹腔镜与传统开腹全直肠系膜切除术治疗直肠癌的手术指标比较
| 组别 | 例数 | 手术部位(例) | 手术时间[min,均数(范围)] | 麻醉时间[min,中位数(范围)] | 术中输血 | 手术切口[cm,均数(范围)] | |||
|---|---|---|---|---|---|---|---|---|---|
| 低位 | 超低位 | 浓缩红细胞(例) | 用血量[ml,中位数(范围)] | ||||||
| 开腹组 | 75 | 45 | 30 | 113 (90~170) | 156(140 ~ 250) | 8 | 300(300~400) | 13.6(10.0~16.0) | |
| 腹腔镜组 | 61 | 35 | 26 | 122(115~200) | 169(150~260) | 3 | 300(300~400) | 8.7 (8.0~10.0) | |
| P值 | 0.734 | 0.114 | 0.127 | 0.219 | 0.862 | <0.05 | |||
两组肿瘤组织学分型、分化程度、浸润程度及切缘距肿瘤距离等比较,差异均无统计学意义(均P>0.05)(表2)。
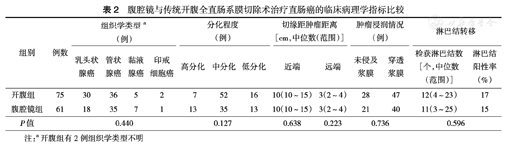
腹腔镜与传统开腹全直肠系膜切除术治疗直肠癌的临床病理学指标比较
腹腔镜与传统开腹全直肠系膜切除术治疗直肠癌的临床病理学指标比较
| 组别 | 例数 | 组织学类型a (例) | 分化程度(例) | 切缘距肿瘤距离[cm,中位数(范围)] | 肿瘤浸润情况(例) | 淋巴结转移 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 乳头状腺癌 | 管状腺癌 | 黏液腺癌 | 印戒细胞癌 | 高分化 | 中分化 | 低分化 | 近端 | 远端 | 未侵及浆膜 | 穿透浆膜 | 检获淋巴结数[个,中位数(范围)] | 淋巴结阳性率(%) | |||
| 开腹组 | 75 | 30 | 36 | 5 | 2 | 7 | 52 | 16 | 10(10~15) | 3(2~4) | 28 | 47 | 12(4~23) | 17 | |
| 腹腔镜组 | 61 | 18 | 35 | 7 | 1 | 13 | 35 | 13 | 10(10~15) | 3(2~4) | 21 | 40 | 11(3~25) | 15 | |
| P值 | 0.440 | 0.127 | 0.638 | 0.223 | 0.736 | 0.596 | |||||||||
注:a开腹组有2例组织学类型不明
与开腹手术组相比,腹腔镜组在术后引流管拔除时间、镇痛药物使用、下床活动时间及住院时间等方面均具有明显优势,两组比较差异均有统计学意义(均P<0.05)(表3)。另外,腹腔镜组和开腹手术组使用术后镇痛药物者分别为8、23例,两组差异有统计学意义(P<0.05)。
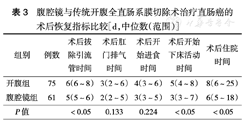
腹腔镜与传统开腹全直肠系膜切除术治疗直肠癌的术后恢复指标比较[d,中位数(范围)]
腹腔镜与传统开腹全直肠系膜切除术治疗直肠癌的术后恢复指标比较[d,中位数(范围)]
| 组别 | 例数 | 术后拔除引流管时间 | 术后肛门排气时间 | 术后开始进食时间 | 术后开始下床活动时间 | 术后住院时间 | |
|---|---|---|---|---|---|---|---|
| 开腹组 | 75 | 6(6~8) | 3(2~6) | 4(3~6) | 5(4~8) | 8(6~25) | |
| 腹腔镜组 | 61 | 5(5~6) | 2(2~5) | 3(3~5) | 3(3~7) | 6(5~18) | |
| P值 | <0.05 | 0.133 | 0.224 | <0.05 | <0.05 | ||
两组均未发现直肠穿孔、输尿管损伤、盆腔脓肿的病例。开腹手术组中有腹腔内出血(实为吻合口左侧末梢血管残端)1例,尿潴留3例,术后感染3例,肠梗阻2例,怀疑吻合口瘘1例(术后第4天肛门排气后出现高热,骶前引流出粪样物,肛诊未触及明显瘘口),总体并发症发生率为13.1%(8/61),其中腹腔内出血及吻合口瘘患者均行二次手术(吻合口瘘患者术中探查未见明显瘘口),二次手术率为2.66%。腹腔镜组中无腹腔内出血及气胸病例,尿潴留2例,术后感染1例,肠梗阻1例,怀疑吻合口瘘(术后2~3 d出现发热,血象升高,肛诊未触及明显瘘口)2例,未行二次手术,均行抗感染及经肛冲洗等对症治疗后症状缓解,总体并发症发生率为6.7%(5/75)。两组总体并发症发生率差异有统计学意义(P<0.05)。两组患者住院期间均未发现死亡病例。
腹腔镜组手术时需用超声刀;腹腔镜与开腹手术在重建消化道时均使用相同的圆形吻合器;在离断标本时,开腹手术组使用的多为线型闭合器,而腹腔镜组通过Trocar入腹完成肠管的闭合离断,需用美国强生公司生产的爱惜龙线型切割缝合器,平均每人多花费约7 000元。因此,腹腔镜组与开腹手术组相比手术费用明显增加。
有研究报道,腹腔镜下直肠癌TME低位前切除与传统的开腹TME相比在围手术期的部分指标上具有明显优势,采用腔镜手术可获得更低的术中出血量、更快的术后恢复速度、更轻微的术后疼痛、更少的镇痛药物使用量及更小的术后免疫反应[5,6,7]。
本研究中,就手术及麻醉时间而言,两组相比差异无统计学意义(P>0.05)。这可能与术者腹腔镜操作经验丰富有关。开腹手术组与腹腔镜组患者的输血率分别为10.7%及4.9%,但是就具体用血量而言均较少(中位数均为300 ml),且参考患者病历,均为术前即伴有贫血的预防性输血,这与文献[8]报道一致。就术后血常规监测而言,并未发现较明显的术中失血,表明开腹手术以盆筋膜脏层及壁层间疏松结缔组织为入路同样可以减小局部的创伤。腹腔镜组的手术切口小于开腹组,差异具有统计学意义(P<0.05)。腹腔镜组清扫淋巴结数目与开腹手术组差异无统计学意义(P>0.05),这与文献[6,7]报道一致。对可能存在环周切缘阳性的癌肿,腹腔镜在狭窄的骨盆中进行分离、离断及吻合缝合等操作,具有局限性,2016版美国国立综合癌症网络(NCCN)指南不推荐使用。
本研究发现腹腔镜组患者引流管拔除时间、术后使用镇痛药物、恢复下床活动时间及术后住院时间等指标较开腹组为好,两组差异有统计学意义(P<0.05),这与文献[6,9,10]报道相一致,可能是由于腹腔镜患者术后疼痛轻,可以耐受早期下地活动,腹腔镜组获得了更短的术后恢复时间。而在术后胃肠道功能恢复及进食时间上与开腹手术组无明显差异。由此我们推测腹腔镜在促进术后恢复方面的优势正在逐渐丧失,但需大样本量的前瞻性研究或随机对照研究(RCT)结果来支持该论断。开腹手术组的并发症发生率为13.1%,腹腔镜组仅为6.7%。Jiang等[11]的Meta分析结果也显示腹腔镜直肠癌手术的术后并发症发生率低于开腹手术,差异具有统计学意义。他们将纳入的文献分为RCT组与非RCT组,分别进行Meta分析,仍然得到相同的结果。本研究中,若将腹腔镜组怀疑肠瘘的患者考虑在内,13.1%的并发症发生率几乎接近开腹手术组,这与文献[8,12]报道一致,两组在严重并发症发生率方面差异无统计学意义,表明开腹手术能够获得和腹腔镜相近的微创治疗效果。
总之,本研究发现,由于腹腔镜技术需使用额外的手术设备,同时受术式限制需要用特殊的消化道闭合器械,带来了治疗成本的升高。我们认为,外科医生也许应更慎重地考虑哪些类型的患者可以接受腹腔镜切除术。腹腔镜直肠癌切除术尚需进一步研究。
无



























