
观察晚期食管癌患者应用奈达铂联合紫杉醇脂质体的临床疗效及安全性。
采用分层随机分组法,将80例晚期食管癌患者分为研究组和对照组,每组40例。对照组采用奈达铂+紫杉醇方案进行化疗,研究组采用奈达铂+紫杉醇脂质体方案进行化疗。均以3周为1个疗程,比较2个疗程后两组患者的临床疗效、生命质量评分及不良反应发生情况。
经过2个疗程治疗后,对照组治疗有效率为55.0%(22/40),研究组为57.5%(23/40),两组差异无统计学意义(χ2=0.704,P>0.05)。治疗前两组患者生命质量评分比较差异无统计学意义(t=0.794,P>0.05);经过1个疗程治疗后,两组患者生命质量均有所提升,但研究组提升程度优于对照组(t=5.782,P<0.05);经过2个疗程治疗后,两组患者生命质量均有所下降,差异无统计学意义(t=0.658,P>0.05)。两组患者的白细胞减少、血小板减少、脱发及心电图变化方面差异均无统计学意义(均P>0.05),但在恶心、呕吐、呼吸困难、肝损伤、肾损伤方面,研究组发生率低于对照组,差异均有统计学意义(均P<0.05)。
紫杉醇脂质体除保留紫杉醇原有药用机制、功效及适应证外,还能有效减轻后者带来的不良反应。其与奈达铂联合治疗晚期食管癌具有较好的疗效,且安全可靠,值得临床推广应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
食管癌是发生于食管鳞状上皮组织的恶性肿瘤,患者早期仅有胸骨后疼痛,进食偶有梗阻感,无明显其他症状,易被忽视。当出现明显吞咽困难及进行性消瘦时已属中晚期,往往已失去手术治疗机会,临床多采用化疗。紫杉醇长期以来一直被视为食管癌临床治疗的一线药物,发挥了重要作用。紫杉醇脂质体作为一种新剂型,在药物毒性的降低、变态和免疫反应的减轻及药物疗效的提升方面具有更多优势[1]。奈达铂作为第二代铂类制剂,有效避免了顺铂引发的严重消化道反应及细胞毒性,临床使用范围更广[2]。我们以80例晚期食管癌患者作为研究对象,观察和分析奈达铂联合紫杉醇脂质体化疗方案的疗效及安全性。
选取2012年8月至2014年8月于我院确诊并进行治疗的80例晚期食管癌患者。所有患者均经临床、影像学(CT、磁共振成像等)及组织病理学切片确诊,符合相关临床诊断及分期标准,预计生存期3个月以上,Karnofsky评分70分以上,排除严重内脏疾病(心、肝、肾功能不全)、精神疾病及紫杉醇过敏者。采用分层随机分组法,将80例患者分为对照组及研究组,各40例。对照组男性23例,女性17例,平均年龄(55.7±8.6)岁;鳞状细胞癌26例,腺癌7例,小细胞癌7例;TNM分期:Ⅲ期19例,Ⅳ期21例;采用奈达铂+紫杉醇方案进行化疗。研究组男性24例,女性16例,平均年龄(55.9±8.4)岁;鳞状细胞癌24例,腺癌9例,小细胞癌7例;TNM分期:Ⅲ期18例,Ⅳ期22例;采用奈达铂+紫杉醇脂质体方案进行化疗。两组患者的一般临床资料比较差异无统计学意义(P>0.05),具有可比性。本研究经过医院伦理委员会批准,患者及其家属知情并签署知情同意书。
为预防紫杉醇可能导致的变态反应,所有患者化疗前进行预处理,用药前30 min注射地塞米松10 mg+苯海拉明40 mg+西咪替丁300 mg。对照组给予紫杉醇(北京协和药厂,国药准字H20083786,10 ml∶60 mg)135~175 mg/m2,1次/d。奈达铂(南京先声东元制药有限公司,国药准字H20030884,10 mg/支)80 mg/m2,1次/d。研究组给予紫杉醇脂质体(南京绿叶思科药业有限公司,国药准字H20030357,30 mg/支)135~175 mg/m2,奈达铂用法及剂量同对照组。持续治疗2个疗程(3周为1个疗程)后对疗效及安全性进行评价。用药期间定期检查血象和肝功能,若出现异常则给予减少剂量及对症治疗。
(1)参照实体瘤疗效评价标准(RECIST),以肿瘤最长径为基线,分为完全缓解(CR):所有病灶消失维持4周;部分缓解(PR):病灶直径缩小30%,并维持4周;稳定(SD):非PR、进展(PD);PD:病灶直径增加20%,病灶增加前非CR、PR、SD。治疗有效率以CR+PR计算[3];(2)用Karnofsky评分对患者的生命质量进行评定,满分100分,生命质量与得分呈正比;(3)参照世界卫生组织制定的抗肿瘤药物急性与亚急性毒性反应分级标准进行药物安全性评价,分为0~Ⅳ级。
采用SPSS 17.0软件进行统计学分析,计量资料符合正态分布,用均数±标准差( ±s)表示,两组间比较采用t检验;计数资料用率表示,两组间比较采用χ2检验,以P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验;计数资料用率表示,两组间比较采用χ2检验,以P<0.05为差异有统计学意义。
经过2个疗程治疗后,对照组治疗有效率为55.0%(22/40),研究组为57.5%(23/40),两组比较差异无统计学意义(χ2=0.704,P>0.05)。治疗前两组患者生命质量评分比较差异无统计学意义(t=0.794,P>0.05);经过1个疗程治疗后,两组患者生命质量均有所提升,但研究组提升程度优于对照组(t=5.782,P<0.05);经过2个疗程治疗后,两组患者生命质量均有所下降,差异无统计学意义(t=0.658,P>0.05)(表1)。
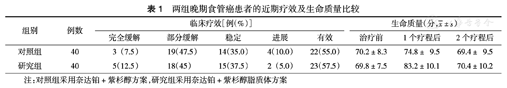
两组晚期食管癌患者的近期疗效及生命质量比较
两组晚期食管癌患者的近期疗效及生命质量比较
| 组别 | 例数 | 临床疗效[例(%)] | 生命质量(分,  ±s ) ±s ) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 完全缓解 | 部分缓解 | 稳定 | 进展 | 有效 | 治疗前 | 1个疗程后 | 2个疗程后 | ||
| 对照组 | 40 | 3(7.5) | 19(47.5) | 14(35.0) | 4(10.0) | 22(55.0) | 70.2±8.3 | 74.8± 9.5 | 69.4± 9.5 |
| 研究组 | 40 | 5(12.5) | 18(45) | 15(37.5) | 2(5.0) | 23(57.5) | 69.8±7.5 | 83.2±10.1 | 70.4±10.2 |
注:对照组采用奈达铂+紫杉醇方案,研究组采用奈达铂+紫杉醇脂质体方案
用药期间,两组患者在白细胞减少、血小板减少、脱发及心电图变化方面比较,差异均无统计学意义(均P>0.05),但在恶心、呕吐、呼吸困难、肝、肾损伤方面,研究组发生率低于对照组,差异有统计学意义(均P<0.05)(表2)。
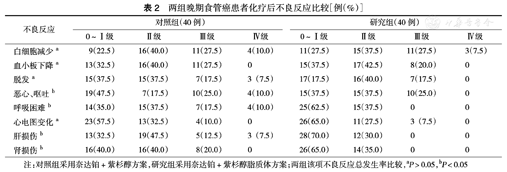
两组晚期食管癌患者化疗后不良反应比较[例(%)]
两组晚期食管癌患者化疗后不良反应比较[例(%)]
| 不良反应 | 对照组(40例) | 研究组(40例) | ||||||
|---|---|---|---|---|---|---|---|---|
| 0~Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 0~Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | |
| 白细胞减少a | 9(22.5) | 16(40.0) | 11(27.5) | 4(10.0) | 11(27.5) | 15(37.5) | 11(27.5) | 3(7.5) |
| 血小板下降a | 13(32.5) | 16(40.0) | 11(27.5) | 0 | 15(37.5) | 17(42.5) | 8(20.0) | 0 |
| 脱发a | 15(37.5) | 15(37.5) | 7(17.5) | 3(7.5) | 17(17.5) | 16(40.0) | 7(17.5) | 0 |
| 恶心、呕吐b | 19(47.5) | 7(17.5) | 10(25.0) | 4(10.0) | 15(37.5) | 15(37.5) | 10(25.0) | 0 |
| 呼吸困难b | 14(35.0) | 15(37.5) | 7(17.5) | 4(10.0) | 25(62.5) | 15(37.5) | 0 | 0 |
| 心电图变化a | 23(57.5) | 13(32.5) | 4(10.0) | 0 | 26(65.0) | 11(27.5) | 3(7.5) | 0 |
| 肝损伤b | 13(32.5) | 19(47.5) | 5(12.5) | 3(7.5) | 28(70.0) | 12(30.0) | 0 | 0 |
| 肾损伤b | 16(40.0) | 16(40.0) | 8(20.0) | 0 | 26(65.0) | 14(35.0) | 0 | 0 |
注:对照组采用奈达铂+紫杉醇方案,研究组采用奈达铂+紫杉醇脂质体方案;两组该项不良反应总发生率比较,aP>0.05,bP<0.05
我国是食管癌高发区,食管癌占所有恶性肿瘤的2%,死亡率仅次于胃癌。晚期食管癌患者由于已失去最佳手术时机,临床多通过化疗来延长患者生存期以及改善生命质量。然而目前尚无统一的化疗方案,其中奈达铂、紫杉醇为使用较为广泛的临床一线化疗药物。
奈达铂为顺铂类似物,是第二代铂类药物,通过与肿瘤细胞的DNA碱基结合,与DNA形成交叉键,阻碍DNA复制,从而发挥其抗肿瘤的功效。与第一代的顺铂相比,奈达铂由于侧链甘露醇酸酯基的改变,大大降低了肾脏以及肝脏毒性,其使用中无需水化[4]。紫杉醇是一种四环二萜化合物,是从紫杉树皮中分离得到的活性物质,可促进微管双聚体装配并组织其解聚。也可导致整个细胞周期微管的排列异常和细胞分裂期间微管星状体的产生,使肿瘤细胞分裂停止于G2和M期,从而阻碍细胞分裂,抑制肿瘤生长。但紫杉醇由于高度亲脂性导致水溶性较差,注射给药时一般需要使用聚氧乙烯蓖麻油和无水乙醇作为助溶剂进行预处理,助溶剂可促进人体释放组胺,从而引发变态反应、中毒性肾损伤、神经毒性、心脏毒性等,因此临床使用受到了一定的限制[5]。紫杉醇脂质体将紫杉醇的药物包裹于磷脂、胆固醇等组成的微米至纳米级脂质微粒中。由于不含助溶剂,其预处理更方便,用量小于紫杉醇注射液,可显著降低外周循环毒性,明显提高机体对紫杉醇的耐受性,具有被动靶向效应。动物实验表明,紫杉醇脂质体较游离紫杉醇的分布高2~23倍。不仅药物维持时间长,而且其消除半衰期也明显延长。此外紫杉醇脂质体可减少血浆蛋白与脂质体的相互作用,降低被巨噬细胞吞噬的可能,从而延长在循环系统的滞留时间,这种长循环的缓释作用,有利于对肝、脾以外组织或器官的靶向作用,增强了治疗效果[6,7]。
国外有研究指出,对于既往已接受过顺铂治疗的晚期食管癌患者,使用奈达铂可显著提高疗效及改善患者的生命质量[8]。李启英等[9]采用紫杉醇脂质体联合奈达铂治疗23例晚期食管癌患者,其中11例初治者的治疗有效率为54.5%,12例复发者的治疗有效率为25%,不良反应主要为白细胞及血小板下降,且多为Ⅰ~Ⅱ级,未出现明显心脏及外周神经毒性。
本研究中,经过2个疗程治疗后,两组患者治疗有效率差异无统计学意义(P>0.05)。1个疗程治疗后,两组患者Karnofsky评分均有所提升,且研究组提升程度优于对照组(P<0.05),但随着时间延长,2个疗程治疗后,两组患者Karnofsky评分均有所下降,差异无统计学意义(P<0.05)。此外,对用药期间不良反应观察发现,两组患者在白细胞减少、血小板减少、脱发及心电图变化方面比较,差异无统计学意义(P>0.05),但在恶心、呕吐、呼吸困难、肝损伤、肾损伤方面,研究组优于对照组,差异具有统计学意义(P<0.05)。表明紫杉醇脂质体在减少患者不良反应、提升用药安全性方面要优于紫杉醇,上述结论与崔红利等[10]的研究结果相似。
综上所述,紫杉醇脂质体除保留紫杉醇原有药用机制、功效及适应证外,还能有效减轻后者带来的不良反应,与奈达铂联合治疗晚期食管癌具有较好的疗效,且安全可靠,值得临床推广应用。
无



























