
采用基因芯片分析miR-497高表达对结肠癌细胞HCT116基因表达谱的影响。
利用慢病毒感染人结肠癌细胞株HCT116,建立miR-497稳定高表达的结肠癌细胞模型HCT116-497细胞及阴性对照HCT116-CON细胞,用全基因组表达谱芯片筛选差异表达基因,利用MAS 3.0生物信息注释系统进行基因本体(gene ontology,GO)和信号通路富集分析(pathway analysis),筛选炎症相关基因。应用实时定量反转录聚合酶链反应(qRT-PCR)对候选基因进行验证。
筛选出绝对倍数变化(absolute fold change)3.0倍以上的下调基因582个,发现其主要富集于炎症相关细胞因子网络等信号通路。选取下调基因中参与细胞因子网络和MAPK信号通路的15个炎症相关基因进行PCR验证后显示,与HCT116-CON细胞相比,HCT116-497细胞中10个基因(CACNB1、FOS、IL-29、RPS6KA2、TNFSF15、IL-11、INHBC、CSF1R、JAK3和IL-2Rβ)表达水平降低,差异均有统计学意义(均P<0.05),与芯片结果一致。
miR-497抑制结肠癌细胞HCT116中炎症相关基因mRNA的表达。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌(colorectal cancer,CRC)是人类主要恶性肿瘤之一,大多数CRC的发生与环境和非遗传因素有关,其中慢性炎症是CRC发生发展的重要危险因素之一。越来越多的证据表明,许多微RNA(miRNA)可以调控炎症相关因子的表达,促进或抑制炎症相关肿瘤的发生[1]。miR-497位于17号染色体短臂13.1(17p13.1),属于miR-15/16/195/424/497家族成员。miR-497参与调节细胞周期、缺氧应激、血管通透性、DNA损伤修复、细胞凋亡等一系列过程[2,3,4,5]。近年来研究发现,miR-497表达下调与CRC、乳腺癌、黑色素瘤、肾上腺皮质癌、头颈部鳞状细胞癌等多种肿瘤发生关系密切,因此被视作一个肿瘤抑制基因[2,3]。我们的前期工作也证实在结肠癌组织和结肠癌细胞系中miR-497低表达,并且发现miR-497能够抑制结肠癌细胞的增殖和侵袭能力,促进凋亡发生[6]。研究表明,结肠癌引发的炎症反应可以促进肿瘤的发展和转移[7]。为了确定miR-497高表达对结肠癌细胞基因表达谱的影响,探索miR-497是否参与结肠癌相关炎症反应,我们建立了miR-497稳定高表达的结肠癌细胞株,利用人基因组表达谱芯片筛选差异表达基因,结合生物信息学方法对差异基因进行基因本体(gene ontology,GO)和信号通路富集分析(pathway analysis),筛选可能受miR-497调控的炎症相关基因,为下一步研究miR-497调控结肠癌炎症反应的机制及其效应奠定基础。
人结肠癌细胞株HCT116购自美国菌种保藏中心(ATCC)细胞库,DMEM培养液购自美国Corning公司,胎牛血清购自美国Gibco公司,过表达LV-hsa-miR-497及阴性对照慢病毒购自上海吉凯基因化学技术有限公司,筛选剂嘌呤霉素(puromycin)购自美国Sigma公司。RNA提取试剂TRIzol购自日本TaKaRa公司,NucleoSpin RNA clean-up试剂盒购自德国Macherey-Nagel公司,全基因组表达谱芯片采用美国Agilent公司Human(V2)Gene Expression Microarray 8×60K芯片,实时定量反转录聚合酶链反应(qRT-PCR)试剂盒High Capacity cDNA Reverse Transcription Kit和SYBR Select Master Mix购自美国ABI公司,引物由美国国立生物技术信息中心(NCBI)的Primer-BLAST在线设计,由上海生工生物工程有限公司合成,荧光定量PCR仪ViiA 7 Real-Time PCR System购自美国Applied Biosystems公司。
将处于对数生长期的HCT116细胞分别接种于6孔板的3个孔中,4×105/孔,加入含10%胎牛血清的DMEM培养液2 ml/孔,在37 ℃、5% CO2、湿度适宜的培养箱中培养,待细胞贴壁生长融合度达60%~70%后,按感染复数(multiplicity of infection,MOI)为10分别加入LV-hsa-miR-497慢病毒及阴性对照病毒液,12 h后更换为新鲜培养液,48~72 h后于荧光倒置显微镜下观察绿色荧光,确定感染效率。用嘌呤霉素(终浓度为5 μg/ml)筛选细胞克隆,稳定转染miR-497的HCT116细胞(HCT116-497细胞)作为实验组,阴性对照病毒感染的HCT116细胞(HCT116-CON细胞)作为阴性对照组,未经感染的HCT116细胞为空白对照组。
TRIzol法提取miR-497高表达的HCT116-497细胞、阴性对照HCT116-CON细胞及空白对照HCT116细胞总RNA,对其纯化。将总RNA反转录合成cRNA并纯化,以cRNA为模板,Random Primer为引物,反转录得到DNA并定量。以反转录的DNA产物为模板,Random Primer为引物,用Klenow Fragment酶合成DNA互补链,并掺入带有荧光基团的dNTP(Cy3-dCTP)。纯化并定量标记产物。标记的DNA再与表达谱芯片上探针杂交,清洗后用Agilent芯片扫描仪(G2565CA)对芯片扫描,得到杂交图片,使用Agilent Feature Extraction(v10.7)软件提取数据及预处理分析,然后采用GeneSpring GX软件计算基因表达差异。差异基因筛选标准为绝对倍数变化(absolute fold change)在2.0倍以上。采用Cluster 3.0软件对基因进行聚类分析。
TRIzol法提取细胞总RNA,按照美国ABI公司反转录试剂盒说明反转录2 μg RNA,合成cDNA单链,然后以cDNA为模板进行PCR扩增。miR-497、U6反转录引物序列分别为5'-GTCGTATCCAGTGCAGGGT CCGAGGTATTCGCACTGGATAC-3'和5'-AACGCTTC ACGAATTTGCGT-3',其他PCR引物序列见表1。扩增体系为10 μl:SYBR Select Master Mix(2×)5 μl,10 μmol/L上、下游混合引物1 μl,cDNA模板2 μl,无核酶水2 μl。反应条件为:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。以GAPDH作为差异表达基因的内参,以U6为miR-497内参,qRT-PCR数据采用2-ΔΔCt相对定量法计算。
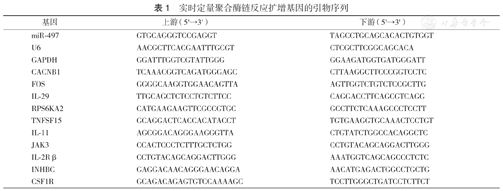
实时定量聚合酶链反应扩增基因的引物序列
实时定量聚合酶链反应扩增基因的引物序列
| 基因 | 上游(5'→3') | 下游(5'→3') |
|---|---|---|
| miR-497 | GTGCAGGGTCCGAGGT | TAGCCTGCAGCACACTGTGGT |
| U6 | AACGCTTCACGAATTTGCGT | CTCGCTTCGGCAGCACA |
| GAPDH | GGATTTGGTCGTATTGGG | GGAAGATGGTGATGGGATT |
| CACNB1 | TCAAACGGTCAGATGGGAGC | CTTAAGGCTTCCCGGTCCTC |
| FOS | GGGGCAAGGTGGAACAGTTA | AGTTGGTCTGTCTCCGCTTG |
| IL-29 | TTGCAGCTCTCCTGTCTTCC | CAGGACCTTCAGCGTCAGG |
| RPS6KA2 | CATGAAGAAGTTCGCCGTGC | GCCTTCTCAAAGCCCTCCTT |
| TNFSF15 | GCAGGACTCACCACATACCT | TGTGAAGGTGCAAACTCCTGT |
| IL-11 | AGCGGACAGGGAAGGGTTA | CTGTATCTGGCCACAGGCTC |
| JAK3 | CCACTCCCTCTTTGCTCTGG | CCTGTACAGCAGGACTTGGG |
| IL-2Rβ | CCTGTACAGCAGGACTTGGG | AAATGGTCAGCAGCCCTCTC |
| INHBC | GAGGACAACAGGGAACAGGA | AACATGAGACTGGCCTGCTG |
| CSF1R | GCAGACAGAGTGTCCAAAAGC | TCCTTGGGCTGATCCTCTTCT |
采用MAS 3.0(Molecule Annotation System 3.0)生物信息注释系统对差异表达基因进行GO分析,采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)公共数据库进行信号通路分析。
采用SPSS 13.0软件进行统计学分析,计量资料符合正态分布,以均数±标准差( ±s)表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
qRT-PCR检测显示,与HCT116-CON细胞相比,HCT116-497细胞的miR-497成熟体表达量明显增高,差异有统计学意义(1.00±0.18比77.49±5.73,样本数为3,P=0.003)。表明筛选出的HCT116-497细胞能稳定高表达成熟的miR-497序列。
按绝对倍数变化在2.0倍以上的标准筛选差异表达基因并进行聚类分析结果(图1)。在绝对倍数变化3.0倍以上的差异表达基因中,有功能注释的基因共1 053个,其中471个基因表达上调,582个基因表达下调。
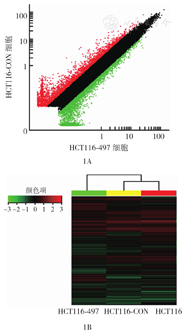

HCT116-497细胞为miR-497过表达细胞,HCT116-CON细胞为阴性对照细胞;1A:比较分析散点图,红色和绿色标记的数据点分别表示HCT116-497细胞与HCT116-CON细胞倍数变化(fold change)≥2.0和≤-2.0的基因,黑色标记表示倍数变化-1.9~1.9的基因,为表达基本无差异的基因;1B:聚类分析图,红色为表达上调,绿色为表达下调
将绝对倍数变化3.0倍以上的差异表达基因上传至MAS 3.0系统(http://bioinfo.capitalbio.com/mas3/)进行GO分析,按生物学过程(biological process)、细胞组分(cellular component)、分子功能(molecular function)进行功能注释。在生物学过程分类中,HCT116细胞过表达miR-497后下调基因富集于免疫和炎症反应的基因共45个,占前十位GO分类的17%(图2)。对绝对倍数变化3.0倍以上差异基因行KEGG通路分析显示,HCT116细胞过表达miR-497后下调基因主要与细胞因子受体作用网络、细胞黏附分子、JAK-STAT、MAPK、钙等信号通路有关(P<0.05,Q<0.05)(表2),其中细胞因子受体作用网络、JAK-STAT、MAPK等通路与炎症反应相关。
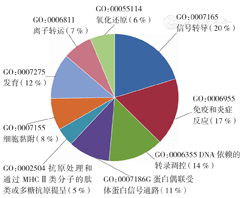


人结肠癌HCT116细胞过表达miR-497后下调基因的京都基因与基因组百科全书(KEGG)通路富集结果
人结肠癌HCT116细胞过表达miR-497后下调基因的京都基因与基因组百科全书(KEGG)通路富集结果
| 通路 | 基因数(个) | P值 | Q值 | 基因 |
|---|---|---|---|---|
| 细胞因子-细胞因子受体相互作用 | 17 | 6.54×10-11 | 2.4×10-9 | TNFSF15、 IL-20Rα、 CD27、 IL-29、 INHBC、 CXCL11、 IL-2Rβ、 CSF1R、 TNFRSF6B、 EGF、LTB、CCL26、NGFR、IL-11、CSF2、INHBB、CCL3 |
| 细胞黏附分子 | 8 | 1.45×10-5 | 5.4×10-5 | MPZ、PTPRC、HLA-DQA1、HLA-DOB、CLDN6、NCAM1、HLA-DQB1、HLA-DRB3 |
| JAK-STAT信号通路 | 8 | 4.12×10-5 | 1.0×10-4 | IL-20Rα、IL-29、IL-2Rβ、SPRY4、JAK3、IL-11、CSF2、CBLB |
| 钙信号通路 | 8 | 1.37×10-4 | 3.3×10-4 | CACNA1C、PTGER3、BDKRB2、BDKRB1、CACNA1B、ADRB1、ADRB2、SPHK1 |
| MAPK信号转导通路 | 9 | 4.41×10-4 | 8.5×10-4 | FGF5、CACNA1C、NTRK2、NTRK1、CACNA1B、EGF、RPS6KA2、CACNB1、PLA2G2F |
| 肌动蛋白细胞骨架的调节 | 7 | 2.00×10-3 | 3.0×10-3 | FGF5、BDKRB2、BDKRB1、ITGB6、EGF、ITGAX、VAV2 |
| mTOR 信号通路 | 3 | 8.60×10-3 | 9.3×10-3 | PGF、RPS6KA2、ULK2 |
| Hedgehog信号通路 | 3 | 1.10×10-2 | 1.1×10-2 | WNT7A、WNT4、BMP6 |
| TGF-β信号通路 | 3 | 3.36×10-2 | 2.8×10-2 | INHBC、BMP6、INHBB |
注:TGF-β为转化生长因子β;P值为相关基因富集于特定信号通路的超几何分布概率,Q值为FDR校正后的P值,一般认为P<0.05、Q<0.05为差异有统计学意义
选取下调基因中参与细胞因子网络和MAPK信号通路的15个炎症相关基因进行PCR验证。结果显示,与HCT116-CON细胞相比,HCT116-497细胞中10个基因(CACNB1、FOS、IL-29、RPS6KA2、TNFSF15、IL-11、INHBC、CSF1R、JAK3和IL-2Rβ)表达水平降低(均P<0.05)(表3),与芯片结果一致。
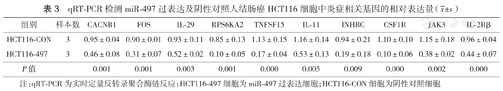
qRT-PCR检测miR-497过表达及阴性对照人结肠癌HCT116细胞中炎症相关基因的相对表达量( ±s)
±s)
qRT-PCR检测miR-497过表达及阴性对照人结肠癌HCT116细胞中炎症相关基因的相对表达量( ±s)
±s)
| 组别 | 样本数 | CACNB1 | FOS | IL-29 | RPS6KA2 | TNFSF15 | IL-11 | INHBC | CSF1R | JAK3 | IL-2Rβ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| HCT116-CON | 3 | 0.95±0.04 | 0.90±0.01 | 0.93±0.11 | 0.85±0.13 | 1.13±0.15 | 1.16±0.14 | 0.94±0.21 | 1.10±0.10 | 1.15±0.18 | 0.96±0.04 |
| HCT116-497 | 3 | 0.46±0.08 | 0.31±0.07 | 0.52±0.02 | 0.10±0.05 | 0.17±0.04 | 0.53±0.13 | 0.19±0.18 | 0.10±0.06 | 0.38±0.02 | 0.44±0.07 |
| P值 | 0.001 | 0.001 | 0.003 | 0.001 | 0.000 | 0.005 | 0.009 | 0.000 | 0.002 | 0.000 |
注:qRT-PCR为实时定量反转录聚合酶链反应;HCT116-497细胞为miR-497过表达细胞;HCT116-CON细胞为阴性对照细胞
miRNA是一类小的内源性非编码RNA,长度在22个核苷酸左右,在转录后水平调控基因表达。miRNA前体经加工成熟后,参与形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC),通过碱基互补配对的方式识别靶基因mRNA 3'端非翻译区(3' UTR),根据互补程度的不同指导沉默复合体降解靶mRNA或者抑制靶mRNA的翻译,从而抑制基因的表达[8]。考虑到miRNA的作用方式是与靶基因互补结合而抑制其表达的,所以本研究着重关注miR-497过表达后下调的基因。
慢性肠道炎症是CRC发生的重要危险因素,炎症性肠病(inflammatory bowel diseases,IBD)患者发展为炎症相关性CRC的风险很高。另外,研究发现,虽然只有2%的CRC在发病前存在慢性炎症,但是在大多数CRC中炎症相关基因表达也上调[7]。由此可见,炎症反应不仅可以引起CRC的发生,而且由CRC引发的炎症反应能够促进肿瘤的发展和转移。阿司匹林等抗感染药可以减轻CRC引发的炎症,抑制肿瘤生长,也表明肿瘤引发的炎症在肿瘤进展中有促进作用[7]。细胞因子网络介导的炎症和抗肿瘤免疫在肿瘤的发生发展尤其是CRC中起着关键作用[9]。miR-497过表达后,富集于炎症因子网络的下调基因大多属于肿瘤坏死因子(TNF)家族、转化生长因子β(TGF-β)、趋化因子家族,其中IL-29、TNFSF15、IL-11、INHBC、CSF1R、JAK3和IL-2Rβ的mRNA表达下调在miR-497稳定高表达的结肠癌细胞株中得到了验证。TNF与肠道肿瘤发生关系密切,可促进结肠上皮细胞的上皮-间质转化(EMT)[10]。下调的TNF家族基因包括TNFSF15、TNFRSF7(CD27)、TNFRSF6B、LTB(TNFSF3)、NGFR(TNFRSF16)。TNFSF15是溃疡性结肠炎(ulcerative colitis,UC)的易感基因,其蛋白产物TNF样配体1A(TNF-like molecule 1A,TL1A)的受体包括死亡受体3(death receptor 3,DR3)和诱骗受体3(decoy receptor 3,DcR3),DR3和DcR3竞争性结合TL1A,从而影响肠黏膜T细胞的活化、增殖、凋亡以及炎症反应,在肠道炎症反应、免疫应答中发挥重要作用。此外,TNFSF15基因的多态性与IBD疾病发展的严重程度有关[11]。
许多研究报道IL-11可能参与胃癌、CRC、前列腺癌、胰腺癌等恶性肿瘤的发生,IL-11Rα表达水平与胃肠道肿瘤的转移程度相关。IL-11与其受体IL-11Rα结合可激活JAK-STAT3、RAS-RAF-ERK和PI3K-AKT-mTORC1信号通路,它们在维持肠黏膜稳态、调节促炎细胞因子表达及细胞增殖与凋亡中均具有重要作用[12]。IL-11是IL-6家族成员,在CRC中高表达,与磷酸化STAT3的相关性比IL-6还要高[13]。此外,高表达TGF-β与CRC尤其是晚期患者预后差负相关[14],TGF-β还可促进肿瘤相关成纤维细胞(CAF)分泌IL-11,导致STAT3信号介导的CRC多器官转移[15]。研究表明趋化因子及其受体所组成的网络在CRC的增殖、侵袭和转移中发挥重要作用[16]。另外,集落刺激因子(CSF)及其受体也可以介导肿瘤细胞的趋化作用,从而影响肿瘤的转移。
JAK-STAT通路在炎症和肿瘤中均具有重要作用。有研究表明JAK3在肺癌细胞系和结肠癌细胞系中均有表达[17]。细胞因子介导的JAK-STAT信号通路在维持肠道稳态和肠黏膜上皮损伤与修复中发挥重要作用,JAK3和STAT3活化是炎症和肿瘤之间的重要桥梁[18]。IL-2Rβ和IL-2Rα、IL-2Rγ异源三聚体组成IL-2R,主要在淋巴细胞里表达。研究发现在CAF、内皮细胞、肠上皮细胞和肾上皮细胞中也有IL-2R表达[19]。IL-2Rβ可激活JAK-STAT、RAS-RAF-ERK MAPK和PI3K信号通路,促进细胞增殖[20]。IL-2可以通过调节肠上皮细胞的增殖和凋亡维持肠上皮细胞的稳态,IL-2与其受体结合后可活化JAK3,引起肠上皮细胞增殖[21]。本研究PCR结果证实,在miR-497高表达的结肠癌细胞株HCT116中IL-2Rβ、JAK3 mRNA表达水平下调,其蛋白表达水平有待后续实验验证。
综上所述,我们的研究结果初步表明,在结肠癌HCT116细胞中miR-497可以下调细胞因子等炎症相关基因的表达,其具体机制和miR-497是否通过下调炎症因子进而调控结肠癌细胞的增殖、分化和转移有关还有待进一步研究。
无



























