
探讨PAX-2和PTEN在子宫内膜病变中的表达情况及其与子宫内膜上皮内瘤变(EIN)的相关性。
收集子宫内膜增生性病变60例和子宫内膜样癌70例,应用EIN形态学标准将单纯性增生、复杂性增生和非典型增生的病例重新分类,同时行免疫组织化学PAX-2和PTEN染色,观察其表达情况并进行比较。
良性增生、EIN、子宫内膜样癌中PAX-2的表达缺失率分别为39.5%(15/38)、72.7%(16/22)及78.6%(55/70),差异有统计学意义(χ2=21.664,P=0.000),PETN的表达缺失率分别为47.4%(18/38)、54.5%(12/22)及75.7%(53/70),差异无统计学意义(χ2=2.878,P=0.411)。
在EIN诊断标准中PAX-2有可能成为一个可靠的辅助诊断手段,PTEN的缺失有提示作用,但不能作为确诊的依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
子宫内膜癌是女性生殖系统最常见的恶性肿瘤,包括形态学和生物学行为截然不同的两型:Ⅰ型与雌激素过度刺激有关,或存在肥胖等危险因素,这类患者通常伴有子宫内膜增生;Ⅱ型以高级别的浆液性癌为代表,与雌激素刺激无关,不伴有内膜增生。子宫内膜增生症是一组异质性病变,包括轻微可逆的腺体增生至Ⅰ型子宫内膜癌癌前病变谱系上不同程度或不同阶段的内膜增生性改变,主要病因是雌激素过度刺激而无孕激素拮抗保护。长期以来,为了治疗和判定预后,对子宫内膜增生提出了多种分类方法。当前应用的世界卫生组织(WHO)2014分类框架源于1985年Kurman等[1]提出的分类体系。在2014年上半年问世的WHO女性生殖器官肿瘤分类第4版中取消了单纯性增生与复杂性增生之分,这是为了将分类简单化,以便提高病理诊断的一致性[2]。此外,在临床处理及预后上,单纯性增生与复杂性增生间的差别不大,因此,在新版分类中,将子宫内膜非典型增生与子宫内膜上皮内瘤变(EIN)归为同类,进一步明确此类病变为子宫内膜样腺癌的前驱病变。那么,EIN的标准是否可以用于病理诊断?是否能取代经典的子宫内膜单纯性增生-复杂性增生-非典型增生-癌的诊断术语?有无特异的辅助方法帮助诊断?这些问题还需要在实践中解答。我们按WHO 2003版子宫内膜增生性病变诊断标准收集病例,再按EIN诊断标准重新分类并行免疫组织化学PTEN和PAX-2染色,以评估辅助染色在EIN诊断中的作用。
收集北京大学第一医院2010年9月至2012年6月子宫内膜增生性病变60例以及子宫内膜样癌(Ⅰ型)70例,患者年龄29~76岁,平均44.9岁。以增殖期子宫内膜8例及分泌期子宫内膜8例作为正常对照。对子宫内膜增生性病变应用传统分类法进行诊断,包括单纯性增生20例,复杂性增生20例,非典型增生20例。全部标本经4%中性甲醛溶液固定,常规脱水,石蜡包埋,切片,HE染色后光学显微镜下观察组织学形态,并且均行免疫组织化学PAX-2及PTEN染色。
子宫内膜增生传统分类标准参考WHO 2003版分类。EIN形态学诊断标准为:诊断时,首先在低倍镜下浏览所有的组织碎片,寻找结构拥挤、外观较一致的区域。EIN必须符合下列标准[3,4],(1)结构异常:腺体面积超过间质(腺体/间质>1),病变由单个腺体组成,可有轻度分支和形状不同。腺体密集是EIN病变的一个主要结构特征,即间质容积(VPS)<55%,VPS可以简单地表述为腺体表面积(表皮加上腺腔)超过间质面积。但一些非EIN病变腺体有时也可达到这样的密度,包括分泌期子宫内膜、子宫内膜基底层和囊性改变的子宫内膜。另外在评估腺体与间质的比例时,应该避开大而明显的囊腔。(2)细胞学改变:病变区腺体与正常背景腺体对比,其上皮细胞核和(或)胞质形态特征与周围背景中相对正常的腺体不同,可能包括核极性的变化、核的多形性或细胞分化的差异,即胞质的形态特点不同;如果缺乏可以作为背景的对照腺体,则细胞应具有显著异常。(3)病变范围:准确诊断EIN需要有一个足够大的腺体连续区域,用以评估结构特点及估计腺体间质比例,病灶最大径应超过1 mm。(4)排除类似病变:即排除伴有重叠标准的良性病变、不规则增殖、基底层内膜、分泌期内膜、息肉等。(5)排除癌:如果出现迷路样腺体、实性区域或显著的筛状结构则不应诊断为EIN,而直接诊断为癌。
抗PTEN抗体购自北京中杉金桥生物技术公司,采用EnVision二步法检测。判定标准:胞核或胞质着色为阳性,全部腺管呈阳性表达判定为PTEN阳性,出现至少一个表达缺失的腺体判定为PTEN缺失[5]。
抗PAX-2抗体购自丹麦Dako公司,采用EnVision二步法检测。判定标准[6,7]:胞核着色为阳性;一个腺体没有一个细胞着色判读为缺失性表达(无腺体染色为完全缺失,1%~60%腺体染色为部分缺失,61%~100%腺体染色为少许缺失)。
采用SPSS 17.0统计软件进行统计学分析,阳性率的比较应用χ2检验,PAX-2与PTEN表达关系的分析采用Spearman相关分析法。以P<0.05为差异具有统计学意义
应用WHO传统分类的20例非典型增生、20例复杂性增生及20例单纯性增生患者中分别有16、6、0例诊断为EIN(图1)。
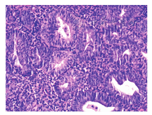

PAX-2呈胞核阳性(图2)。PAX-2在正常子宫内膜组织、子宫内膜良性增生、EIN及子宫内膜样癌中的表达缺失率分别为37.5%(6/16)、39.5%(15/38)、72.7%(16/22)、78.6%(55/70),各组缺失率差异有统计学意义(χ2=21.664,P=0.000)。在良性增生、EIN及子宫内膜样癌中,随着病变程度增加,PAX-2的完全缺失率也增高(表1)。

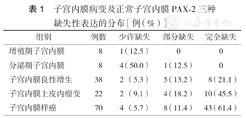
子宫内膜病变及正常子宫内膜PAX-2三种缺失性表达的分布[例(%)]
子宫内膜病变及正常子宫内膜PAX-2三种缺失性表达的分布[例(%)]
| 组别 | 例数 | 少许缺失 | 部分缺失 | 完全缺失 |
|---|---|---|---|---|
| 增殖期子宫内膜 | 8 | 1(12.5) | 0 | 0 |
| 分泌期子宫内膜 | 8 | 4(50.0) | 1(12.5) | 0 |
| 子宫内膜良性增生 | 38 | 2(5.3) | 5(13.2) | 8(21.1) |
| 子宫内膜上皮内瘤变 | 22 | 2(9.1) | 4(18.2) | 10(45.5) |
| 子宫内膜样癌 | 70 | 4(5.7) | 8(11.4) | 43(61.4) |
PTEN呈胞核或胞质阳性(图3)。PTEN在正常子宫内膜组织、子宫内膜良性增生、EIN及子宫内膜样癌中的表达缺失率分别为43.8%(7/16)、47.4%(18/38)、54.5%(12/22)、75.7%(53/70),各组缺失率差异无统计学意义(χ2=2.878,P=0.411)。
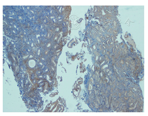

22例EIN中PAX-2表达缺失16例(72.7%),PTEN表达缺失12例(54.5%),PAX-2与PTEN同时表达缺失10例(45.5%)。EIN中PAX-2与PTEN的表达无相关性(r=0.261,P=0.241)
EIN是一种非侵袭性的、在组织学上表现为局部内膜腺体单克隆性增生的病变,是子宫内膜样癌(Ⅰ型癌)的癌前病变,如果不治疗,发展为内膜样癌的可能性很大。这种癌前病变最初为局灶性单克隆性增生病变,其后病变由中心向外呈膨胀性增长。随着时间推移,这种克隆性增生的发展镜下可见,它们无论从结构还是细胞上都与背景内膜不同,这种与周围背景内膜腺体比较的镜下诊断方式也是EIN诊断的基本模式。EIN的概念提出后,尚未得到广泛采用,WHO新分类认为EIN等同于不典型增生,二者的形态学诊断标准、重复性及进展为子宫内膜样腺癌的风险均相似,从而把两种命名系统统一起来。目前病理诊断难点在于判断是否具有不典型性即为EIN,其判断仍然受病理医师个人主观性的较大影响,重复性差,因此期待有可靠的分子指标辅助诊断。本研究分析PAX-2和PTEN在子宫内膜增生性病变中的表达情况,希望其成为辅助诊断EIN的较客观的分子生物学指标。
PTEN是子宫内膜样腺癌最易突变的基因[8],其编码一种磷酸酶,通过下调蛋白激酶Akt的作用而抑制细胞分裂。PTEN的功能缺失导致相应腺体有更大的增生优势,容易形成克隆性增生。PTEN在正常增殖期子宫内膜的腺体和间质中均呈阳性表达,到分泌早期时腺体表达有所减少,分泌中期开始腺体不表达PTEN,间质一直阳性表达,提示PTEN主要作用于雌激素刺激高度增生的内膜,而孕激素可能通过其他途径抑制增生[9]。因此PTEN在高雌激素水平环境下抑制子宫内膜增生的作用尤为重要,其失活与子宫内膜样癌的发生有密切关系。EIN作为癌前病变,也有相似的PTEN缺失。有报道提出PTEN在EIN中的突变率为55%~63%,而表达缺失率为67%~75%。因此,有学者提出,免疫组织化学法检测PTEN的表达可以作为诊断EIN的标志[10,11]。但是,研究还发现一些增殖期子宫内膜也有PTEN的表达缺失。本研究结果显示,PTEN在正常子宫内膜、良性增生、EIN及子宫内膜样腺癌中的表达缺失率差异无统计学意义(P>0.05)。因此,PTEN缺失不能作为确诊的依据。但是,从良性到恶性病变中,确实出现PTEN缺失率逐渐增高的情况,提示PTEN的功能丧失在子宫内膜样癌发展中有一定的作用。Baak等[12]发现有PTEN缺失的EIN病例中50%进展为癌,而无PTEN缺失的EIN病例并没有出现病情进展。所以,PTEN的缺失可能提示进展为癌的可能性更大,在诊断中检测PTEN的状态还是非常必要的。
PAX-2是一种重要的发育调控基因,参与细胞凋亡的调控[13,14,15]。Tong等[16]报道在起源于苗勒管的子宫内膜、子宫颈、输卵管和阴道上部均检测到PAX-2的表达,并认为PAX-2能作为起源于苗勒管肿瘤的特异性上皮标志。Strissel等[17]的研究显示,PAX-2 mRNA在良性增生中高表达,是他莫昔芬治疗后内膜中PAX-2表达量的2倍,是子宫内膜样腺癌中表达量的5倍。该研究结果提示,PAX-2在子宫内膜上皮细胞增殖和自我更新中是一个肿瘤抑制基因。Monte等[7]观察到PAX-2在EIN中的缺失率为71%,在子宫内膜癌中为77%,Joiner等[18]的研究显示,PAX-2在EIN中的缺失率为92%,其中完全缺失率为86.1%。在子宫内膜良性增生性病变中的缺失率为15%,均为部分缺失。Allison等[6]报道了PAX-2在传统分类中的应用,结果显示在单纯性增生、复杂性增生、非典型增生及子宫内膜样腺癌中PAX-2完全缺失率分别为17.4%、59.0%、74.1%及73.3%,PAX-2表达丢失和增生程度有关,有助于区分是否伴有非典型增生。本研究中PAX-2在正常子宫内膜组织、子宫内膜良性病变、EIN及子宫内膜样腺癌中的表达缺失率差异有统计学意义(P<0.05),与Joiner等[18]报道一致。PAX-2的缺失性变化使良性增生与EIN的区别更显而易见,但EIN与子宫内膜癌之间的区别不显著。值得注意的是,各研究对PAX-2的判定标准不尽相同。Monte等[7]的判读阈值为1%的腺体缺失。Joiner等[18]根据PAX-2在病变腺体及正常背景腺体中的染色分布规律及核染色强度,分为正常(核染色强度与无病变的背景腺体一致)和改变[完全缺失、明显减少、染色增加(与背景腺体相比)]。Allison等[6]评估PAX-2染色方法为完全丢失(无细胞染色)、部分丢失(1%~75%细胞染色)、最小限度/没有丢失(76%~100%细胞染色)。本研究染色判定方法参考Allison等[6]的方法。到目前为止,虽然PAX-2的判读还没有规范化的标准,但其染色评估模式无论在EIN分类系统还是传统分类系统中都有实用性,且EIN分类系统中PAX-2缺失改变优于传统分类。Quick等[19]认为在EIN分类系统中PAX-2是非常实用的标志物,EIN病变腺体核染色丢失,周围背景腺体核强着色。
本研究显示PAX-2与PTEN的表达无相关性(r=0.261,P=0.241),与Monte等[7]报道一致,他们认为PAX-2在子宫内膜中的作用机制不依赖于PTEN,推测PAX-2作为抑癌基因控制细胞增殖。致癌途径可能是基因失活,也可能与其他因子协同作用。
本研究16例正常子宫内膜组织中,6例PAX-2缺失,其中5例为分泌期子宫内膜,1例为增殖期子宫内膜。Allison等[6]的报道显示在28例子宫内膜组织中,5例PAX-2部分缺失,其中1例为分泌期子宫内膜,4例为增殖期子宫内膜,他们解释此现象可能是独立和多重基因作用所致。PAX-2和PTEN在同一例患者中的缺失性表达提示大多数女性在绝经前已经有小亚种群的缺失。正常组织已经失去了它们的基因同质性,通过突变和其他稳定的基因灭活而使组织再生,这些正常组织零星发生的基因独特性缺失被称为"潜在癌前" ,可反映低频率的癌变可能,并需要额外的基因损伤积累。
尽管研究者试图通过使用EIN的概念来区分内膜增生的癌变风险,但实践中面临诸多挑战。本研究显示,良性增生性病变和EIN之间的缺失率变化不大,所以PTEN的缺失可能提示进展为癌的可能性更大。PAX-2的缺失性变化使良性增生与EIN的区别更显而易见。因此在子宫内膜增生性病变的诊断中联合检测PTEN和PAX-2更有助于提高EIN的诊断率。但如何将这些分子标志物推广到病理实践中以发现那些更具风险的癌前病变,PAX-2染色能否有更客观规范的判读标准,PAX-2在子宫内膜癌中的致癌机制能否更明确,还有待进一步研究。
无



























