
探讨热疗对人肺癌细胞株H1299生物学功能的影响及其可能的分子机制。
体外培养H1299细胞,实验分为两组,热疗组细胞采用水浴箱恒温43 ℃加热1 h,对照组细胞置于37 ℃培养箱培养。采用CCK-8法检测细胞增殖,流式细胞术测定细胞周期及细胞凋亡率,Transwell法检测细胞迁移及侵袭,Western blot法检测LLGL1蛋白表达。
热疗对细胞周期分布无明显影响,但热疗组细胞凋亡率为(24.81±2.80)%,较对照组的(11.73±1.55)%升高,差异有统计学意义(t=7.709,P=0.002 1)。热疗组迁移细胞数为(25.67±4.81)个,对照组为(85.00±10.31)个,两组差异有统计学意义(t=5.182,P=0.006 6);热疗组侵袭细胞数为(22.00±2.08)个,对照组为(108.30±10.14)个,两组差异有统计学意义(t=8.342,P=0.001 1)。热疗组细胞LLGL1蛋白表达水平显著上调,为对照组的4.2倍,差异有统计学意义(t=3.028,P=0.038 9)。
热疗可诱导人肺癌H1299细胞凋亡,并可抑制其迁移和侵袭,其作用可能是通过促进LLGL1的表达实现的。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2012年全球大约有180万新发肺癌患者,占所有新发肿瘤的13%,患者总体5年生存率为17.1%,Ⅳ期患者仅占3.6%[1,2]。2014年中国肿瘤年鉴显示肺癌在我国的发病率和死亡率均居首位[3]。大部分肺癌患者在就诊时已为晚期,丧失了根治性手术或放疗的最佳时机,许多患者不能耐受细胞毒药物化疗的不良反应,而靶向治疗适用人群有限。近年来热疗技术不断发展,其在肿瘤治疗方面的价值及原理日益清晰,也在临床应用方面显示出其独特的价值。有报道显示热疗可以抑制肺癌裸鼠移植瘤的生长[4],并有热疗联合贝伐珠单抗治愈肺癌骨转移的病例报告[5]。我们的前期研究显示热疗联合胸腔灌注白细胞介素2(IL-2)对恶性胸腔积液有明显控制作用[6]。但目前对于热疗抑制肺癌细胞生长及侵袭转移的机制尚不明确。LLGL1为果蝇同源性抑癌基因,其缺失将导致细胞极性破坏、细胞无限制扩增和肿瘤发生[7]。本研究观察热疗对人肺癌细胞株H1299生物学功能的影响及其与LLGL1蛋白表达的关系,探讨其可能的抑癌机制,为热疗的临床应用提供实验依据。
人非小细胞肺癌(NSCLC)细胞株H1299由中国医学科学院肿瘤医院胸外科实验室惠赠,RPMI 1640培养液、胎牛血清购自美国Gibco公司,胰蛋白酶购自美国HyClone公司,兔抗人LLGL1单克隆抗体购自美国Cell Signaling Technology公司;兔抗人β-actin单克隆抗体购自美国Santa Cruz公司,山羊抗兔二抗购自美国Abgent公司。细胞增殖实验试剂选用日本同仁化学研究所Dojindo公司的CCK-8试剂盒,细胞周期检测使用南京凯基公司细胞周期检测试剂盒,细胞凋亡检测使用美国BD Pharmingen公司的FITC AnnexinⅤ Apoptosis Detection KitⅠ试剂盒。Transwell小室购自美国Corning及BD Biosciences公司。
使用RPMI 1640培养液培养细胞,添加10%胎牛血清和1%的青霉素和链霉素。置于37 ℃、5% CO2、98%相对湿度条件下进行培养。当细胞融合率为70%~80%时,用0.25%胰蛋白酶消化并传代,收集处于对数生长期的细胞用于实验。
对照组:不做任何处理,置于培养箱内培养,实验前1~2 d传代。热疗组:随机取3瓶细胞,将瓶口拧紧并用封口膜封口,置于43 ℃水浴箱内加热1.5 h后换液,放回37 ℃、5% CO2培养箱内继续培养24 h[8]。
将两组细胞分别以1.5×103/孔接种于96孔板中过夜,每组设6个复孔,分别于热疗后24、48、72 h进行CCK-8增殖检测,将CCK-8原液按1∶9稀释到RPMI 1640完全培养液中,充分混匀。将待测细胞的培养液吸去,加入100 μl稀释好的CCK-8溶液,并在6个空孔中加入稀释好的CCK-8溶液作为空白对照,培养2.5 h后进行检测,用酶标仪检测吸光度(A)值并绘制细胞增殖曲线。
热疗组和对照组各取3个平行样本,收集细胞,PBS洗涤,进行细胞计数,使细胞悬液的最终密度达到1×106/ml。70%乙醇4 ℃条件下固定至少12 h,预冷PBS洗涤后,RNA酶作用30 min,避光加入碘化丙啶(PI)50 μg/ml,30 min后流式细胞术检测,分析各组细胞周期分布。
应用Annexin V-PI双染法流式细胞仪检测肺癌细胞凋亡率,取两组H1299细胞,用胰酶消化,离心半径15 cm,1 000 r/min离心10 min,弃上清。加入1 ml预冷的PBS洗涤,轻轻吹打使细胞悬浮,重复上述步骤。将细胞重悬于250 μl上样缓冲液中,加入5 μl FITC-AnnexinⅤ,避光静置15 min,再加入5 μl PI,轻轻混匀,室温避光反应5 min,向每个EP管内加入400 μl的AnnexinⅤ结合缓冲液,在10 min之内上机检测。
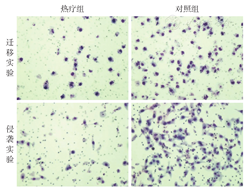
实验前将两组细胞去血清饥饿培养12 h,将Transwell小室或已包被Matrigel的侵袭小室置于37 ℃培养箱中水化60 min,在上室加入含有3×104个或8×104个细胞的无血清RPMI 1640培养液100 μl,下室加入含20% FBS的培养液600 μl,在37 ℃、5% CO2条件下培养12 h。然后取出小室,小心吸去多余培养液,用棉签轻轻擦掉上室细胞,甲醇室温固定2 min,进行吉姆萨染色,7 min后洗去染液。最后将小室底膜切下封固,在光学显微镜(×100)下拍照并计数细胞。
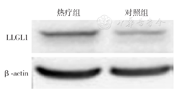
将两组细胞消化后用预冷的PBS漂洗2次,移入2 ml EP管中,向其中加入新鲜配制的细胞裂解液RIPA 500 μl,冰上裂解15 min,12 000×g、4 ℃离心15 min,取上清液,再加入5倍的蛋白上样缓冲液,吹打混匀后置于水浴中,99 ℃煮30 min。采用二喹啉甲酸(BCA)蛋白浓度测定试剂盒测定蛋白浓度。各组细胞取20 μg蛋白行10% SDS-PAGE电泳,并将分离后的蛋白转移至聚偏二氟乙烯(PVDF)膜上。用含5%脱脂奶粉的TBS封闭液室温封闭1 h后,加入一抗(1∶1 000稀释),4 ℃反应过夜,TBST洗膜3次(5 min/次),加入HRP标记的二抗(1∶10 000稀释),室温培养1 h,TBST洗膜3次(5 min/次),最后电化学发光显影。应用图像分析软件Image J测定条带的灰度值,以目的蛋白和内参照蛋白灰度值的比值表示目的蛋白相对表达量。
采用Graphpad prism 6统计软件对实验结果进行统计学分析。实验至少重复3次。计量资料符合正态分布,以均数±标准差( ±s)表示,两组间比较采用Student t检验,两组间A450值的比较采用两因素方差分析。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用Student t检验,两组间A450值的比较采用两因素方差分析。P<0.05为差异有统计学意义。
CCK-8结果显示,热疗组细胞的增殖速度低于对照组,热疗24 h后,H1299细胞增殖能力明显减弱。两组24、48、72 h的A450值差异均有统计学意义(t值分别为3.311、4.089、7.108,均P<0.01)(图1)。
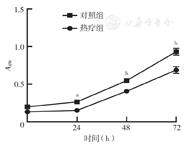

与热疗组同时间点比较,aP<0.01,bP<0.001
热疗对H1299细胞周期无明显影响,但可明显促进肺癌细胞凋亡,与对照组细胞凋亡率(11.73±1.55)%相比,热疗组肺癌为(24.81±2.80)%,两组差异有统计学意义(t=7.709,P=0.002 1)。
Transwell实验显示,热疗组肺癌细胞迁移能力明显受到抑制,热疗组迁移细胞数为(25.67±4.81)个,对照组为(85.00±10.31)个,两组差异有统计学意义(t=5.182,P=0.006 6)。此外,细胞的侵袭能力也明显受到抑制,热疗组侵袭细胞数为(22.00±2.08)个,对照组为(108.30±10.14)个,两组差异有统计学意义(t=8.342,P=0.001 1)(图2)。

Western blot结果显示,热疗组LLGL1蛋白表达水平较对照组增高(t=3.028,P=0.038 9),热疗组LLGL1蛋白表达水平为对照组的4.2倍(图3)。

肺癌的发病率和死亡率在我国均居首位,大部分病例发现时均属晚期,手术效果差,放化疗不敏感且毒副作用较大,因此探寻新的有效治疗方法以提高肺癌患者生存率迫在眉睫。热疗作为一种"绿色"肿瘤辅助疗法已被用于临床治疗,多项随机临床试验证实热疗可促进放化疗疗效,控制肿瘤局部进展,有益于患者生存[9]。但大部分研究局限于热疗可以促进肿瘤血液灌注、改善药物递送、同时可增加肿瘤氧合进而改善放疗敏感性方面。我们前期试验证实热化疗可增强胃癌患者B淋巴细胞、T淋巴细胞及NK细胞表达,增强机体免疫系统功能,包括体液免疫、细胞免疫与非特异性免疫[10]。Mikucki等[11]研究发现热疗可促使炎症因子IL-6发挥抗肿瘤活性,亦有关于热疗可诱导食管癌细胞凋亡的报告[12]。Cai等[13]研究显示热疗联合模拟CO2气腹可抑制bcl-2、基质金属蛋白酶2、ICAM-1和CD44的表达,并促进Bax和E-cadherin表达,进而抑制结肠癌细胞增殖、侵袭和转移。提示热疗可通过多种途径参与肿瘤转归与治疗。
LLGL1最早在果蝇中被发现,它的缺失将抑制果蝇幼虫神经母细胞的分化并促进其侵袭。人类同源性LLGL1基因编码细胞骨架蛋白,参与维持细胞极性及上皮细胞完整性,目前已证实其在多种肿瘤中表达,发挥抑癌基因作用,过表达LLGL1的结直肠癌、食管癌细胞系可增加细胞黏附,减弱细胞侵袭、转移能力,并可诱导肿瘤细胞凋亡,其机制可能是LLGL1参与肿瘤上皮-细胞间质转化(EMT)及激活线粒体途径的凋亡[14,15,16],但鲜见关于热疗对其表达影响的报道。
综上所述,热疗可明显抑制肺癌细胞的迁移、侵袭,促进肺癌细胞凋亡,并且其作用的发挥可能是通过促进LLGL1的表达来实现的,这为肺癌热疗的临床应用提供了重要的分子理论依据。
无



























