
研究缺氧诱导因子1α(HIF-1α)、葡萄糖转运蛋白1(GLUT1)在肺腺癌中的表达及其与肿瘤转移的相关性。
应用免疫组织化学方法检测125例肺腺癌患者(未转移肺腺癌41例、淋巴结转移38例、脑转移46例)的GLUT1及HIF-1α的蛋白表达情况。采用χ2检验和Pearson相关分析GLUT1及HIF-1α的表达及其相关性。
组织学上肺腺癌肿瘤组织异质性较大,多数肿瘤中均包含两种及以上不同的腺癌结构。未转移肺腺癌中以腺泡为主型腺癌多见(73.2 %,30/41);淋巴结转移肺腺癌中以腺泡为主型腺癌(53.6 %,15/38)和实性为主型腺癌(26.3 %,10/38)多见;脑转移肺腺癌中以乳头为主型腺癌(47.8 %,22/46)和实性为主型腺癌(34.8 %,16/46)多见。GLUT1及HIF-1α表达在淋巴结转移和脑转移肺腺癌组比未转移肺腺癌组明显增高(均P<0.05);GLUT1与HIF-1α的表达呈正相关(r=0.407,P=0.000)。
肺腺癌脑转移患者组织学上多为乳头型腺癌,提示乳头状腺癌更容易出现脑转移。HIF-1α及GLUT1的表达在肺腺癌淋巴结转移和脑转移中发挥重要作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
缺氧诱导因子1α(HIF-1α)是介导细胞对缺氧微环境进行适应性反应的关键性转录调控基因,能激活许多缺氧反应性基因的表达,使组织产生一系列适应反应而得以在缺氧状态下生存[1]。HIF-1α可促进肿瘤细胞葡萄糖转运蛋白1(GLUT1)基因的表达,以满足肿瘤生长的能量需求。近年研究表明,在胃癌、鼻咽癌及乳腺癌中均发现HIF-1α和GLUT1表达水平高度相关,且在肿瘤的淋巴结转移中起重要作用[2,3,4]。肺癌目前发病率及死亡率均居首位,对于晚期肺癌患者而言,远处转移是导致死亡的主要原因之一,其中脑转移患者的死亡率为23 %~65 %,中位生存期为3~12个月[5,6]。但是在肺腺癌中,HIF-1α和GLUT1的表达是否与肿瘤的转移,尤其是脑转移的相关性目前尚鲜见明确的报道。本研究分析41例未转移肺腺癌、38例淋巴结转移肺腺癌及46例脑转移肺腺癌组织中HIF-1α及GLUT1蛋白表达及其相关性,探讨HIF-1α及GLUT1表达与肺腺癌转移程度的相关性。
选择首都医科大学宣武医院2014年9月至2017年2月肺腺癌患者手术切除标本125例。其中男性61例,女性64例;年龄27~77岁,中位年龄60.3岁。根据国际肺癌协会(IASLC)2016年版肺部恶性肿瘤TNM分期标准[7]:Ⅰ期40例,Ⅱ期18例,Ⅲ期21例,Ⅳ期46例。组织学分类依据2015版肺癌世界卫生组织(WHO)分类标准[8]。
GLUT1兔抗人多克隆抗体(ZA-0471)、HIF-1α兔抗人单克隆抗体(ZA-0552),二步法免疫组织化学检测试剂盒(PV-9000)、二氨基联苯胺(DAB)显色试剂盒、APES防脱片胶工作液均购于北京中杉金桥生物技术有限公司。石蜡切片机、Olympus光学显微镜、医用微波炉。
采用SP二步法进行免疫组织化学染色。步骤如下:石蜡切片二甲苯脱蜡,梯度乙醇脱水,3 % H2O2中常温培养10 min,PBS冲洗3次,每次5 min。将切片置0.01 mol/L枸橼酸缓冲液(pH值6.0)中煮沸(95 ℃,15~20 min),进行抗原修复,冷却至室温。一抗4 ℃培养过夜,PBS冲洗3次,每次5 min;二抗培养30 min,PBS冲洗,DAB染色,苏木精对比染色1 min,乙醇梯度脱水,二甲苯中性胶封固。PBS代替一抗作为阴性对照。
HIF-1α蛋白染色阳性细胞标准为胞质或胞核内可见棕黄色颗粒。GLUT1蛋白染色阳性细胞标准为胞膜或胞质内出现棕黄色颗粒。参考文献[3]方法进行半定量评定,根据阳性细胞的数量和染色强度进行计分。染色强度:不着色为0分,轻度着色为1分,中度着色为2分,重度着色为3分;阳性细胞数量:<10 %为1分,10 %~50 %为2分,>50 %为3分。上述两项积分之和为免疫组织化学总积分,总积分≤2分为阴性,3~6分为阳性。
采用SPSS 13.0统计学软件对数据进行统计学分析,计数资料采用χ2检验进行比较;相关性分析采用Pearson相关分析法。以P<0.05为差异有统计学意义。
41例未转移肺腺癌病例中,男性19例,女性22例,中位年龄61岁(47~77岁)。Ⅰ期40例,Ⅱ期1例。组织学观察,肿瘤组织异质性较大,多数肿瘤中均包含2种及以上不同的腺癌结构,其中腺泡为主型30例(73.2%),实性为主型5例(12.2 %),贴壁为主型5例(12.2 %),肠型1例(2.4 %)(图1)。
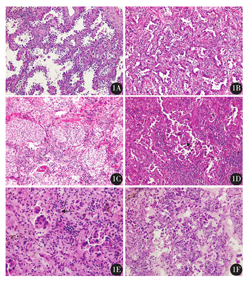

1A:贴壁为主型,癌细胞呈贴壁生长,无间质、脉管或胸膜浸润,无乳头或微乳头结构,肺泡腔内无癌细胞聚集;1B:腺泡为主型,主要成分为具有中心管腔的圆形或卵圆形腺体;1C:实性为主型,主要由片状多角型细胞组成,缺乏可辨认的腺癌结构,肿瘤呈100 %实性生长;1D:乳头为主型,主要由具有纤维血管轴心的分支乳头(箭头所示)构成;1E:微乳头为主型,肿瘤细胞形成无纤维血管轴心的乳头状细胞簇;1F:微乳头播散,视野内可见多个微乳头
38例淋巴结转移肺腺癌病例中,男性20例,女性18例,中位年龄62岁(47~77岁)。Ⅱ期17例,Ⅲ期21例。组织学观察,腺泡为主型15例(53.6 %),实性为主型10例(26.3 %),乳头为主型7例(18.4 %),微乳头为主型5例(13.2 %),贴壁为主型并伴有微乳头型1例(2.6 %)。
46例脑转移肺腺癌病例中,男性22例,女性24例,中位年龄57岁(27~77岁)。30例转移部位于大脑幕以上,其中额叶14例,顶叶5例,枕叶5例,颞叶3例,多发转移病灶3例。16例病例转移部位于小脑。1例为囊性病变,破碎脑组织呈囊壁样结构,囊壁内腺癌浸润,部分为管状型,部分为筛状型,伴片状出血、坏死。组织学观察,乳头为主型22例(47.8 %),实性为主型16例(34.8 %),腺泡为主型8例(17.4 %)。
125例肺腺癌患者中,HIF-1α蛋白阳性表达率为29.6 %(37/125)(图2)。不同性别之间HIF-1α的表达差异无统计学意义(P>0.05)。HIF-1α蛋白表达与患者年龄相关(χ2=4.123,P=0.042),年龄较大的患者表达率更高。淋巴结转移阳性组、脑转移阳性组HIF-1α的阳性表达率均明显高于肿瘤未转移组,差异均有统计学意义(均P<0.05)。HIF-1α阳性表达与患者的临床分期密切相关(P<0.05)。HIF-1α在实性为主型肺腺癌中的阳性表达率为38.7 %(12/31)(表1)。
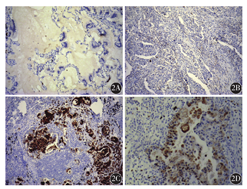

2A:腺癌细胞HIF-1α蛋白表达阴性;2B:实性分布肺腺癌细胞散在表达HIF-1α;2C:HIF-1α在肺腺癌淋巴结转移中的阳性表达,腺癌细胞胞质和胞核可见棕黄色颗粒;2D:HIF-1α在肺腺癌脑转移中的阳性表达

缺氧诱导因子1α(HIF-1α)与葡萄糖转运蛋白1 (GLUT1)的表达与肺腺癌患者临床病理特征的关系[例(%)]
缺氧诱导因子1α(HIF-1α)与葡萄糖转运蛋白1 (GLUT1)的表达与肺腺癌患者临床病理特征的关系[例(%)]
| 临床病理特征 | 例数 | HIF-1α | GLUT1 | |||||
|---|---|---|---|---|---|---|---|---|
| 阳性 | χ2值 | P值 | 阳性 | χ2值 | P值 | |||
| 性别 | ||||||||
| 男 | 61 | 15(24.6) | 1.435 | 0.231 | 38(62.3) | 0.150 | 0.698 | |
| 女 | 64 | 22(34.4) | 42(65.6) | |||||
| 年龄(岁) | ||||||||
| ≥60 | 67 | 25(37.3) | 4.123 | 0.042 | 46(68.7) | 1.359 | 0.244 | |
| <60 | 58 | 12(20.7) | 34(58.6) | |||||
| 淋巴结转移 | ||||||||
| 否 | 41 | 6(14.6) | 7.407 | 0.006 | 18(43.9) | 8.598 | 0.003 | |
| 是 | 38 | 16(42.1) | 29(76.3) | |||||
| 脑转移 | ||||||||
| 否 | 41 | 6(14.6) | 4.658 | 0.031 | 18(43.9) | 9.432 | 0.002 | |
| 是 | 46 | 15(32.6) | 33(71.7) | |||||
| 肿瘤分期 | ||||||||
| Ⅰ | 40 | 4(10.0) | 17(42.5) | |||||
| Ⅱ | 18 | 9(50.0) | 19.208 | 0.000 | 14(77.8) | 9.800 | 0.002 | |
| Ⅲ | 21 | 8(39.1) | 14(66.7) | |||||
| Ⅳ | 46 | 16(34.8) | 35(76.1) | |||||
| 组织学类型 | ||||||||
| 腺泡为主型 | 53 | 12(22.7) | 31(58.5) | |||||
| 实性为主型 | 31 | 12(38.7) | 24(77.4) | |||||
| 乳头为主型 | 29 | 9(31.0) | - | - | 20(68.9) | - | - | |
| 微乳头为主型 | 5 | 2(60.0) | 3(60.0) | |||||
| 贴壁为主型 | 6 | 1(16.7) | 1(16.7) | |||||
| 肠型腺癌 | 1 | 1(100.0) | 1(100.0) | |||||
注:"-"为因组间样本量相差太大,无法统计
125例肺腺癌中,GLUT1蛋白阳性表达率为64.0 %(80/125)(图3)。不同性别、年龄之间GLUT1的表达差异无统计学意义(均P>0.05)。淋巴结转移组、脑转移组GLUT1的阳性表达率均明显高于肿瘤未转移组,差异均有统计学意义(均P<0.05)。GLUT1阳性表达与肺癌的临床分期密切相关(P<0.05)。GLUT1在实性为主型肺腺癌中的阳性表达率为77.4 %(24/31)(表1)。
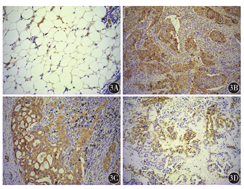

3A:正常支气管肺泡上皮细胞GLUT1蛋白表达阴性;3B:肺腺癌细胞GLUT1阳性表达;3C:GLUT1在肺腺癌淋巴结转移中的阳性表达,腺癌细胞胞膜和胞质可见棕黄色染色;3D:GLUT1在肺腺癌脑转移中的阳性表达
125例肺腺癌中,GLUT1与HIF-1α的表达相关(χ2=21.274,P<0.05)。进一步分析可知,在未转移肺癌组、淋巴结转移组及脑转移肺腺癌组中,GLUT1的表达与HIF-1α的表达均相关(均P<0.05)(表2)。Pearson相关分析显示,GLUT1与HIF-1α的表达呈正相关(r=0.407,P=0.000)。
缺氧诱导因子1α(HIF-1α)与葡萄糖转运蛋白1 (GLUT1)蛋白表达的关系(例)
缺氧诱导因子1α(HIF-1α)与葡萄糖转运蛋白1 (GLUT1)蛋白表达的关系(例)
| 项目 | HIF-1α | χ2值 | P值 | ||
|---|---|---|---|---|---|
| 阳性 | 阴性 | ||||
| GLUT1 | |||||
| 阳性 | 34 | 46 | 17.746 | 0.000 | |
| 阴性 | 3 | 42 | |||
| 未转移肺腺癌 | |||||
| GLUT1阳性 | 5 | 13 | 4.437 | 0.035 | |
| GLUT1阴性 | 1 | 22 | |||
| 淋巴结转移 | |||||
| GLUT1阳性 | 15 | 14 | 4.647 | 0.031 | |
| GLUT1阴性 | 1 | 8 | |||
| 脑转移 | |||||
| GLUT1阳性 | 14 | 19 | 5.119 | 0.024 | |
| GLUT1阴性 | 1 | 12 | |||
低氧是实体瘤发展过程中的普遍现象,HIF-1α是一种核转录因子,调控着下游众多基因如血管内皮生长因子、胰岛素样生长因子、内皮素-1、促红细胞生成素等的转录和表达,是低氧诱导基因转录信息传递的最主要途径[9]。在缺氧的情况下,HIF-1α表达急剧升高,激活GLUT1 5'端的增强子序列,从而引起GLUT1 mRNA的表达及其蛋白的合成[10]。在肿瘤缺氧过程中,HIF-1α参与调节肿瘤细胞糖代谢的基因,从而改变肿瘤微环境,进一步促进肿瘤的生长与转移[11]。研究证实,通过抑制糖酵解,可以有效清除在缺氧微环境中对化疗药物耐药的肿瘤细胞[12]。随着研究的深入,以HIF-1α/GLUT1为靶点的研究为肿瘤的预防及治疗开辟了新的途径。
肺腺癌脑转移部位多位于大脑半球,绝大部分患者的脑转移部位与脑实质的血管分布及血流量有关,转移灶通常处于大脑中动脉分布区、灰白质交界处。本组病例中47.8 %(22/46)的肺腺癌脑转移患者组织学上表现为乳头为主型腺癌。有研究指出,腺癌是影响脑转移患者预后的独立因素之一,此类患者治疗后的生存期通常较短,这可能与患者对治疗的耐受性较差有关[13]。本研究结果未发现肺腺癌脑转移与性别之间的关系,这与多数研究的结果基本一致[6]。
本研究发现,HIF-1α在正常组织中无表达,而在肺腺癌组织中表达率较高,肺腺癌转移组HIF-1α的阳性表达率高于肺腺癌未转移组,提示细胞持续缺氧可促进肿瘤的发生与转移。有体外实验显示,在5 %的氧含量时HIF-1α被激活,当氧浓度降低到0.1 %~0.2 %,其活性逐渐增加,在无氧时消失。肿瘤细胞通过高表达HIF-1α对其下游基因进行调控,以适应低氧环境,促进肿瘤生长转移[14]。Berghoff等[15]也发现HIF-1α的表达与非小细胞肺癌脑转移密切相关,与我们的结论基本一致。同时,本研究表明HIF-1α的蛋白表达与患者年龄相关,≥60岁组HIF-1α的阳性表达率明显高于<60岁组,提示HIF-1α的蛋白表达可能与衰老相关。Gomes等[16]以不同模型进行研究发现,HIF-1α可以切断细胞内线粒体和细胞核之间的通讯,会加速衰老,并且促进肿瘤的发生,提示年龄可能是癌症最大的风险因子。有Meta分析显示,在非小细胞肺癌中HIF-1α高表达提示预后不良[17]。因此,HIF-1α在肺腺癌的发生、发展中起着重要作用。
在缺氧状态下,组织主要通过无氧糖酵解来满足肿瘤生长需要的大量能量,其中GLUT1表达异常升高可能是癌细胞摄取葡萄糖增多的机制之一。GLUT1是体内分布最广泛、对机体内环境变化反应最敏感、分布最广的葡萄糖转运体,负责组织细胞的糖需求。GLUT1不仅能反映机体肿瘤良恶性、增殖程度及侵袭转移等特征,还可对肿瘤的分期、分级及预期治疗结果等进行客观评价。有研究表明,恶性肿瘤如脑肿瘤、胃癌、肺癌、妇科肿瘤等组织中GLUT1均呈高表达[2,4,18]。GLUT1在人肺癌组织中高表达,并且与预后密切相关[19]。国内王昆等[20]的研究也发现GLUT1蛋白在肺肿瘤组织中广泛表达,腺癌表达率为58 %。本研究发现GLUT1在肿瘤周围的正常肺泡上皮细胞中不表达,在未转移肺腺癌组织的表达阳性率为43.9 %,在淋巴结转移组和脑转移组的阳性表达率高达76.3 %,GLUT1蛋白阳性率与肿瘤淋巴结转移及脑转移密切相关。因此,GLUT1在肺腺癌淋巴结转移、脑转移中发挥重要作用。
总之,本研究结果表明HIF-1α与GLUT1蛋白表达与肺腺癌的转移密切相关。随着研究的深入,二者有望成为肺腺癌诊治的新靶点。
无































