
探讨小分子干扰RNA(siRNA)干扰CXCR4基因对人子宫颈癌HeLa细胞增殖、侵袭及上皮间质转化因子Twist、Slug及E钙黏蛋白(E-cad)表达的影响。
体外培养HeLa细胞,设计合成CXCR4基因siRNA(CXCR4-siRNA)转染至HeLa细胞,采用四甲基偶氮唑盐(MTT)法检测细胞增殖能力的变化,Transwell实验观察细胞侵袭能力的变化,蛋白印迹法检测CXCR4、Twist、Slug、E-cad蛋白表达的变化。
与空白组及阴性对照组相比,CXCR4-siRNA转染至HeLa细胞后能抑制CXCR4蛋白的表达(0.959±0.197、0.932±0.141和0.379±0.022,F=16.286,P=0.004)。MTT结果显示:48及72 h时,CXCR4-siRNA组HeLa细胞的增殖活性受到抑制(48 h:0.846±0.034、0.823±0.025和0.744±0.039,F=7.379,P=0.024;72 h:0.996±0.026、0.964±0.059和0.829±0.051,F=10.425,P=0.011)。Transwell结果显示:48及72 h时,CXCR4-siRNA组HeLa细胞的侵袭力受到抑制(细胞穿膜数量为48 h:37.4±8.1、33.6±6.2和25.4±3.2,F=4.830,P=0.029;72 h:48.4±7.6、43.0±5.4和33.4±6.7,F=6.579,P=0.012)。转染后48 h,CXCR4-siRNA组HeLa细胞Twist及Slug蛋白的表达降低(Twist:0.93±0.11、1.00±0.17和0.53±0.07,F=10.962,P=0.010;Slug:0.52±0.08、0.47±0.06和0.19±0.03,F=25.579,P=0.001),E-cad的表达增高(0.53±0.04、0.55±0.24和1.11±0.14,F=12.494,P=0.007)。
沉默CXCR4基因的表达可以抑制HeLa细胞增殖,降低其侵袭力,通过下调Twist、Slug蛋白的表达,上调E-cad表达,抑制HeLa细胞上皮间质转化。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
子宫颈癌是女性常见的恶性肿瘤,其发病率呈逐年上升的趋势,仅次于乳腺癌和肺癌,居于第3位[1]。子宫颈癌常见的组织学类型为鳞状细胞癌,肿瘤的侵袭转移是影响患者生命质量、预后并最终导致死亡的主要原因[2]。CXCR4属趋化因子家族成员[3],是趋化因子基质衍生因子(SDF-1)的特异性受体[4],CXCR4/SDF-1相互作用可激活细胞内及细胞间信号转导通路,在细胞的增殖、趋化、黏附等方面发挥重要作用[5,6]。上皮间质转化(EMT)是上皮细胞向间质细胞转化并获得迁移能力的过程,是恶性肿瘤发生转移的重要机制[7]。CXCR4/SDF-1轴可通过上调核转录因子、降解细胞外基质等方式,在EMT介导的肿瘤侵袭转移过程中发挥重要的作用[8,9]。本研究设计合成针对CXCR4的小分子干扰RNA(siRNA),观察沉默CXCR4基因对子宫颈癌HeLa细胞增殖、侵袭及EMT相关因子Twist、Slug、E钙黏蛋白(E-cad)表达的影响,旨在为子宫颈癌侵袭转移方面的研究提供新的思路和实验依据。
人子宫颈癌HeLa细胞株购自中国医学科学院上海细胞所;高糖达氏修正依氏培养液(DMEM)、胎牛血清购自美国Hyclone公司;胰酶、Hanks平衡盐溶液购自美国Gibco公司;四甲基偶氮唑盐(MTT)干粉购自美国Sigma公司;细胞培养瓶、6孔板及Transwell孔板购自美国Corning公司;蛋白印迹法所用主要试剂购自上海生工生物工程有限公司;蛋白提取试剂盒购自北京普利莱基因工程公司;CXCR4、Twist、Slug及E-cad一抗购自美国Santa Cruz公司;其余试剂均为国产分析纯。
HeLa细胞常规复苏后培养于含10%胎牛血清的高糖DMEM,置于37 ℃、5% CO2、饱和湿度培养箱中。实验分为3组:空白组(正常培养,不做任何处理),阴性对照组(转染随机质粒)及CXCR4-siRNA组。CXCR4特异性siRNA表达质粒及随机对照质粒由美国InvivoGen公司设计合成,CXCR4引物序列:5'-CCGACCUCCUCUUUGUCAUTT-3';随机对照引物序列:5'-AATTCTCCGAACGTGTCACGT-3'。调整细胞密度至1.0×106/孔,接种至6孔板中,待细胞生长至指数增长期时(贴壁80%),按照Lipofectamine 2000试剂盒操作步骤进行转染。
消化、离心收集转染后48 h的各组细胞,提取细胞总蛋白,用BCA试剂盒检测蛋白浓度。制备8%十二烷基硫酸钠聚丙烯酰胺凝胶,电压60 V预电泳30 min,100 V电泳50 min。湿转膜法转膜,电压100 V转膜50 min至硝酸纤维素膜。蛋白封闭、洗膜。滴加一抗(CXCR4、Twist浓度1∶500,Slug浓度1∶600,E-cad及GAPDH浓度1∶800)及二抗(浓度1∶3 000)。电化学发光法(ECL)显色,Bandscan软件分析灰度值。目的蛋白的浓度以目的蛋白灰度值/内参灰度值计算。
消化、离心收集转染后48 h的各组细胞,接种至96孔板中,放入培养箱中继续培养,至24、48及72 h时进行MTT检测:弃去培养液,加入MTT溶液(0.5%)10 μl及二甲基亚砜(DMSO)150 μl,分光光度计检测490 nm波长处的吸光度(A)值。每组设5个复孔,实验重复3次。
消化、离心收集转染后48 h的各组细胞,接种于Transwell小室的上层,上层培养条件为含10%胎牛血清的DMEM,下层加入含20%胎牛血清的DMEM。放入培养箱中继续培养,至24、48及72 h时取出小室,棉签拭去基质胶膜上层细胞,甲醇固定,苏木精染色,100倍光镜下计数着色细胞,计数5个视野,取平均值。
实验数据采用SPSS 18.0软件进行分析,计量资料符合正态分布,用均数±标准差( ±s)表示,多组间比较采用重复测量的方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
±s)表示,多组间比较采用重复测量的方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
蛋白印迹法检测各组CXCR4蛋白表达,结果显示,CXCR4-siRNA组、阴性对照组及空白组CXCR4蛋白的相对表达量分别为0.379±0.022、0.932±0.141及0.959±0.197,CXCR4-siRNA组CXCR4蛋白的表达较其他两组下降,差异有统计学意义(F=16.286,P=0.004)(图1),提示CXCR4-siRNA可抑制HeLa细胞中CXCR4基因转录。
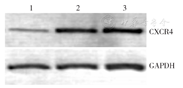

注:1为CXCR4-siRNA组(转染CXCR4特异性siRNA表达质粒);2为阴性对照组(转染随机对照质粒);3为空白组(正常培养,不做任何处理)
MTT法检测结果显示,与空白组及阴性对照组相比,CXCR4-siRNA组自实验48 h开始,细胞增殖活性下降,组间差异均有统计学意义(P<0.05)(表1)。
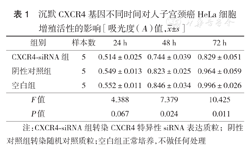
沉默CXCR4基因不同时间对人子宫颈癌HeLa细胞增殖活性的影响[吸光度(A)值, ±s]
±s]
沉默CXCR4基因不同时间对人子宫颈癌HeLa细胞增殖活性的影响[吸光度(A)值, ±s]
±s]
| 组别 | 样本数 | 24 h | 48 h | 72 h |
|---|---|---|---|---|
| CXCR4⁃siRNA组 | 5 | 0.514±0.025 | 0.744±0.039 | 0.829±0.051 |
| 阴性对照组 | 5 | 0.549±0.013 | 0.823±0.025 | 0.964±0.059 |
| 空白组 | 5 | 0.552±0.011 | 0.846±0.034 | 0.996±0.026 |
| F值 | 4.388 | 7.379 | 10.425 | |
| P值 | 0.067 | 0.024 | 0.011 |
注:CXCR4-siRNA组转染CXCR4特异性siRNA表达质粒;阴性对照组转染随机对照质粒;空白组正常培养,不做任何处理
Transwall实验检测CXCR4-siRNA组、阴性对照组及空白组HeLa细胞的穿膜数量(表2),与空白组及阴性对照组相比,CXCR4-siRNA组自实验48 h开始,穿膜数量下降,组间差异均有统计学意义(均P<0.05)(图2)。
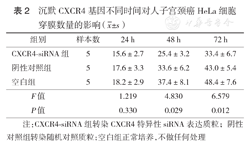
沉默CXCR4基因不同时间对人子宫颈癌HeLa细胞穿膜数量的影响( ±s)
±s)
沉默CXCR4基因不同时间对人子宫颈癌HeLa细胞穿膜数量的影响( ±s)
±s)
| 组别 | 样本数 | 24 h | 48 h | 72 h |
|---|---|---|---|---|
| CXCR4⁃siRNA组 | 5 | 15.6±2.7 | 25.4±3.2 | 33.4±6.7 |
| 阴性对照组 | 5 | 17.6±3.3 | 33.6±6.2 | 43.0±5.4 |
| 空白组 | 5 | 18.2±2.9 | 37.4±8.1 | 48.4±7.6 |
| F值 | 1.219 | 4.830 | 6.579 | |
| P值 | 0.330 | 0.029 | 0.012 |
注:CXCR4-siRNA组转染CXCR4特异性siRNA表达质粒;阴性对照组转染随机对照质粒;空白组正常培养,不做任何处理
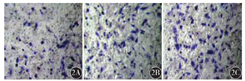

蛋白印迹法检测结果显示,与空白组及阴性对照组相比,CXCR4-siRNA组细胞Twist及Slug蛋白的表达量下调,E-cad表达量上调,差异有统计学意义(P<0.05)(图3,表3)。

小分子干扰RNA(siRNA)对人子宫颈癌HeLa细胞上皮间质转化相关分子表达的影响( ±s)
±s)
小分子干扰RNA(siRNA)对人子宫颈癌HeLa细胞上皮间质转化相关分子表达的影响( ±s)
±s)
| 组别 | 样本数 | Twist | Slug | E⁃cad |
|---|---|---|---|---|
| CXCR4⁃siRNA组 | 5 | 0.53±0.07 | 0.19±0.03 | 1.11±0.14 |
| 阴性对照组 | 5 | 1.00±0.17 | 0.47±0.06 | 0.55±0.24 |
| 空白组 | 5 | 0.93±0.11 | 0.52±0.08 | 0.53±0.04 |
| F值 | 10.962 | 25.579 | 12.494 | |
| P值 | 0.010 | 0.001 | 0.007 |
注:CXCR4-siRNA组转染CXCR4特异性siRNA表达质粒;阴性对照组转染随机对照质粒;空白组正常培养,不做任何处理;E-cad为E钙黏蛋白;目的蛋白的相对表达量为目的蛋白灰度值/内参灰度值


注:1为CXCR4-siRNA组(转染CXCR4特异性siRNA表达质粒);2为阴性对照组(转染随机对照质粒);3为空白组(正常培养,不做任何处理)
子宫颈癌的侵袭和转移是多基因、多信号通路参与的复杂过程。趋化因子的主要作用是趋化细胞的迁移,使细胞沿趋化因子浓度梯度迁徙[9]。人类CXCR4基因定位于2q21,是一种7次跨膜受体蛋白[10],CXCR4与其配体SDF-1的相互作用在人类多种疾病,尤其是肿瘤中发挥重要功能[11]。肿瘤性EMT是一个多因素主导的复杂过程,即上皮肿瘤细胞恶性间质表型转化[12],在此过程中,上皮细胞逐渐丧失其相对稳定的黏附性,稳定性下降,运动能力增加,侵袭能力增强,导致上皮细胞更容易从原位脱落,向间叶组织浸润性生长,甚至发生远处转移[13]。CXCR4/SDF-1轴可通过对下游信号通路的调控影响MAPK系统和钙黏蛋白系统,抑制钙黏蛋白转录及表达,激活间质细胞相关基因的转录及表达,在EMT介导的肿瘤侵袭转移过程中发挥重要作用[14,15]。此外,CXCR4还可通过与核因子(NF)-κB、血管内皮生长因子(VEGF)等相互作用,增强肿瘤细胞的侵袭力,促进肿瘤细胞淋巴结转移及远处转移[16,17]。
本研究采用siRNA方式,沉默子宫颈癌HeLa细胞株中CXCR4的表达,转染后CXCR4蛋白的表达显著下降,提示HeLa细胞中CXCR4基因的转录受到抑制。侵袭和转移是恶性肿瘤主要的生物学特征,沉默CXCR4基因48 h后细胞的增殖活性受到显著抑制,细胞穿膜数量显著下降,提示沉默CXCR4基因的表达可有效降低HeLa细胞的侵袭力,逆转其恶性表型。
从分子标志上来看,肿瘤性EMT主要表现为Twist、Slug、Snail、波形蛋白(vimentin)等蛋白的表达上调,同时E-cad、actin、ZO-1等蛋白的表达下调[18]。E-cad是一种跨膜糖蛋白,在维持细胞间黏附稳定等方面发挥重要的作用,在多种上皮恶性肿瘤中E-cad蛋白表达缺失[19,20]。Twist是碱性螺旋蛋白家族中高度保守的转录因子,可与E-cad的启动子区域结合并抑制E-cad的表达,介导EMT的发生[21]。Slug又称为Snail2,其蛋白氨基酸末端具有两种特殊类型的结构域,即N端Slug结构域和C端锌指结构域,这些结构域可与E-cad的E-box结合,抑制E-cad蛋白表达[22]。本研究结果显示,与空白组及阴性对照组相比,CXCR4-siRNA组细胞Twist及Slug蛋白的表达下调,E-cad表达上调,提示沉默CXCR4基因的表达可有效逆转肿瘤性EMT表型,降低肿瘤细胞的恶性转化能力。
综上,本研究结果表明沉默CXCR4基因的表达可抑制HeLa细胞增殖,降低其侵袭力,下调EMT相关因子Twist、Slug蛋白的表达,上调E-cad的表达,可为子宫颈癌侵袭和转移方面的研究提供新的思路和实验依据。
无



























