
比较FOLFOXIRI与SOX化疗方案治疗晚期结直肠癌患者的近期效果。
对2013年1月至2015年1月湖北省荆门市第二人民医院收治的晚期结直肠癌患者71例的临床资料进行回顾性分析。根据不同化疗方案分为两组:SOX组(34例)给予SOX(奥沙利铂+替吉奥)方案治疗,FOLFOXIRI组(37例)给予FOLFOXIRI(奥沙利铂+伊立替康+5-氟尿嘧啶)方案治疗。治疗4个疗程后比较两组患者的临床疗效及不良反应。随访6~24个月,采用Kaplan-Meier法比较两组患者的生存情况。
治疗4个疗程后,FOLFOXIRI组患者部分缓解16例,稳定11例,进展10例;SOX组部分缓解15例,稳定10例,进展9例,两组患者临床疗效比较差异无统计学意义(Z=0.069,P>0.05)。FOLFOXIRI组客观缓解率为43.24%(16/37),临床控制率为72.97%(27/37);SOX组客观缓解率为44.12%(15/34),临床控制率为73.53%(25/34),两组比较差异均无统计学意义(χ2值分别为0.005、0.003,均P>0.05)。FOLFOXIRI组1、2年生存率分别为83.78%(31/37)和29.73%(11/37),SOX组1、2年生存率分别为85.29%(29/34)和38.24%(13/34),两组比较差异均无统计学意义(χ2值分别为0.031、0.573,均P>0.05)。FOLFOXIRI组中位无进展生存时间为9.4个月,中位总生存时间为19.2个月;SOX组中位无进展生存时间为11.6个月,中位总生存时间为20.3个月,两组比较差异均无统计学意义(χ2值分别为0.850、0.573,均P>0.05)。FOLFOXIRI组白细胞减少、腹泻程度高于SOX组(Z值分别为2.252、2.214,均P<0.05)。
FOLFOXIRI与SOX方案治疗晚期结直肠癌的效果相当,但SOX方案耐受性优于FOLFOXIRI方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
大多数结直肠癌患者确诊时处于中晚期,往往失去了手术根治的机会,生存率较低[1]。对于晚期结直肠癌患者而言,治愈难度极大,治疗的主要目的为控制疾病发展,延长生存期,并改善生命质量。奥沙利铂为一种光谱铂类化疗药物,对大多数恶性实体肿瘤均有一定临床效果;替吉奥属于氟化嘧啶类化疗药物,能够抑制肿瘤细胞增殖、分化[2,3]。奥沙利铂+伊立替康+5-氟尿嘧啶组成的FOLFOXIRI方案为近年来临床治疗晚期结直肠癌或转移性结直肠癌的常用方案,具有一定疗效,但部分患者难以耐受,其应用受到一定限制[4]。本研究回顾性分析了采用FOLFOXIRI方案与SOX方案(奥沙利铂+替吉奥)治疗晚期结直肠癌患者的临床疗效和不良反应,现报道如下。
收集2013年1月至2015年1月湖北省荆门市第二人民医院收治的71例晚期结直肠癌患者的临床资料。入选标准:(1)TNM分期为Ⅲ期或Ⅴ期;(2)因无法手术或家属放弃手术等原因未行手术治疗者;(3)资料齐全;(4)初次治疗;(5)预计生存时间>6个月;(6)Karnofsky评分≥60分;(7)美国东部肿瘤协作组(ECOG)评分[5]0~2分;(8)经病理学或细胞学检测具有可评估病灶。排除标准:(1)对本研究用药过敏者;(2)有明显骨髓储备功能或凝血功能障碍者;(3)有语言、精神、智力障碍或容易失访者;(4)有化疗禁忌证者。共入选患者71例,根据不同治疗方案分为SOX组34例,FOLFOXIRI组37例。SOX组年龄(59.5±11.7)岁,男性24例,女性10例;TNM分期:Ⅲ期18例,Ⅳ期16例;有吸烟史8例;肿瘤部位:右结肠16例,左结肠或直肠18例;ECOG评分:0~1分20例,2分14例;转移部位:肺11例,肝11例;有淋巴结转移7例,无淋巴结转移5例;分化程度:高分化3例,中分化21例,低分化10例;清蛋白(31.8±8.6)g/L。FOLFOXIRI组年龄(60.3±10.4)岁,男性28例,女性9例;TNM分期:Ⅲ期22例,Ⅳ期15例;有吸烟史11例;肿瘤部位:右结肠14例,左结肠或直肠23例;ECOG评分:0~1分24例,2分13例;转移部位:肺12例,肝11例;有淋巴结转移8例,无淋巴结转移6例;分化程度:高分化4例,中分化24例,低分化9例;清蛋白(32.1±8.4)g/L。两组患者一般资料比较差异均无统计学意义(均P>0.05)。所有患者均签署化疗知情同意书。
化疗前做好详细检查,给予营养支持、提升白细胞等对症治疗,并给予地塞米松和5-HT3受体阻断剂预防呕吐。FOLFOXIRI组给予FOLFOXIRI方案治疗:伊立替康180 mg/m2静脉滴注,第1天;奥沙利铂85 mg/m2,加入5%氯化钠溶液500 ml,静脉滴注<3 h,第1天;5-氟尿嘧啶400 mg/m2静脉滴注,第1、2天;亚叶酸钙200 mg/m2静脉滴注,第1、2天;21 d为1个疗程。SOX组给予SOX方案治疗:奥沙利铂85 mg/m2,加入5%氯化钠溶液500 ml,静脉滴注<3 h,第1天至第14天;替吉奥胶囊40 mg/m2口服,2次/d;21 d为1个疗程。两组治疗4个疗程后评价治疗效果。
治疗效果按实体瘤疗效评价标准[6]评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD),客观缓解率以CR+PR计算,疾病控制率以CR+PR+SD计算。药物不良反应按照美国国家癌症研究所通用常见不良事件评价标准(CTCAE)[7]评价,分为0~Ⅳ级。
采用SPSS 19.0软件对数据进行统计分析,计量资料符合正态分布,用均数±标准差( ±s)表示,比较采用t检验;计数资料以百分率表示,临床疗效比较采用χ2检验,不良反应比较采用等级资料秩和检验;生存分析采用Kaplan-Meier法,行Log-rank检验。以P<0.05为差异有统计学意义。
±s)表示,比较采用t检验;计数资料以百分率表示,临床疗效比较采用χ2检验,不良反应比较采用等级资料秩和检验;生存分析采用Kaplan-Meier法,行Log-rank检验。以P<0.05为差异有统计学意义。
治疗4个疗程后,71例患者中CR 0例,PR 31例(43.66%),SD 21例(29.58%),PD 19例(26.76%)。FOLFOXIRI组PR 16例,SD 11例,PD 10例;SOX组PR 15例,SD 10例,PD 9例,两组比较差异无统计学意义(Z=0.069,P>0.05)。FOLFOXIRI组客观缓解率为43.24%(16/37),SOX组为44.12%(15/34),两组比较差异无统计学意义(χ2=0.005,P>0.05)。FOLFOXIRI组临床控制率为72.97%(27/37),SOX组为73.53%(25/34),两组比较差异无统计学意义(χ2=0.003,P>0.05)。
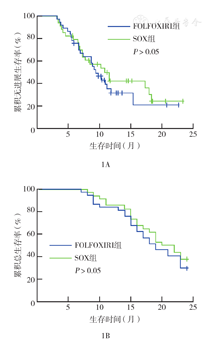
随访6~24个月,平均随访(13.9±4.2)个月,无一例患者失访。FOLFOXIRI组1、2年生存率分别为83.78%(31/37)和29.73%(11/37),SOX组分别为85.29%(29/34)和38.24%(13/34),两组比较差异均无统计学意义(χ2值分别为0.031、0.573,均P>0.05)。FOLFOXIRI组中位无进展生存(PFS)时间为9.4个月,SOX组为11.6个月,两组比较差异无统计学意义(χ2=0.850,P>0.05)(图1A)。FOLFOXIRI组中位总生存(OS)时间为19.2个月,SOX组为20.3个月,两组比较差异无统计学意义(χ2=0.573,P>0.05)(图1B)。

治疗期间,两组患者不良反应主要有神经毒性、脱发、恶心呕吐、贫血、白细胞减少、腹泻以及血小板减少等,个别患者出现心律失常,无变态反应发生。FOLFOXIRI组白细胞减少30例、血小板减少14例、贫血12例、恶心呕吐18例、腹泻19例、脱发31例、神经毒性9例;SOX组白细胞减少15例、血小板减少10例、贫血7例、恶心呕吐14例、腹泻8例、脱发26例、神经毒性7例。两组患者不良反应均以Ⅰ、Ⅱ级为主,经治疗后可明显缓解。其中FOLFOXIRI组白细胞减少、腹泻程度高于SOX组(Z=2.252,P=0.024;Z=2.214,P=0.029)。其余不良反应两组比较,差异均无统计学意义(Z值分别为0.666、1.003、0.765、0.374、0.238,均P>0.05)。
由于结直肠癌起病隐匿,早期并无典型临床症状,就诊时大部分患者已属中晚期,失去了最佳治疗时机。目前,对于晚期结直肠癌主要是以化疗为主,5-氟尿嘧啶类是治疗消化道肿瘤的主要化疗药物,但易发生耐药,且不良反应发生率较高,影响了患者治疗效果和生命质量[5]。同时,5-氟尿嘧啶单药治疗时,患者OS时间仅为10~12个月,联合伊立替康或奥沙利铂后,患者生存时间能够增加4~6个月,当应用FOLFOXIRI方案治疗时,患者生存时间可达到20个月以上[6]。Falcone等[7]研究显示,在Ⅲ期转移性大肠癌患者治疗中,FOLFOXIRI方案与奥沙利铂联合5-氟尿嘧啶的联合方案比较,患者有效率达到了66%,PFS时间以及OS时间显著增加,而且患者均可耐受治疗。有相关临床研究指出[8,9],在奥沙利铂联合5-氟尿嘧啶治疗的基础上加用西妥昔单抗或贝伐珠单抗等分子靶向药物,能够使得晚期结直肠癌患者生存时间进一步延长到30个月。但部分患者由于无法耐受药物不良反应或经济原因而无法接受分子靶向药物治疗,临床应用受到一定限制。奥沙利铂为一种光谱铂类化疗药物,对多种恶性肿瘤均有疗效,目前已经广泛用于头颈部恶性肿瘤、乳腺癌、卵巢癌、消化系统恶性肿瘤、肺癌等的治疗,其中对于胃肠道恶性肿瘤效果最佳[10]。既往研究显示,奥沙利铂能够有效抑制各种恶性肿瘤的细胞株,而且对其他铂类药物均具有耐药性的肿瘤细胞株几乎不会出现交叉耐药[11]。因此,临床多选择奥沙利铂联合替吉奥等其他化疗药物治疗消化道恶性肿瘤。奥沙利铂抗肿瘤的作用机制为形成恶性肿瘤细胞内DNA链和链内交联,使得恶性肿瘤细胞DNA合成被阻断,从而起到治疗作用[12]。替吉奥属于氟化嘧啶类化疗周期性药物,通过代谢物进入DNA后杀伤处于S期的肿瘤细胞,而且抑制了肿瘤细胞增殖、分化,对卵巢癌、乳腺癌、胃癌等多种恶性实体肿瘤具有较好的临床效果[13]。
本研究结果显示,两组患者4个疗程治疗后客观缓解率以及临床控制率比较差异无统计学意义。随访6~24个月后结果表明,两组患者1、2年生存率以及中位PFS时间、中位OS时间比较,差异均无统计学意义。刘捷等[14]的研究显示,47例晚期结直肠癌患者经过改良FOLFOXIRI方案治疗后,患者中位PFS时间为8.4个月,中位OS时间为20.7个月,与本研究结果相近。孔天东等[15]的研究亦指出,与奥沙利铂、5-氟尿嘧啶方案相比较,SOX化疗方案能够更好地提高晚期大肠癌患者的生命质量,提示FOLFOXIRI与SOX方案治疗晚期结直肠癌的效果相当,二者均可作为晚期结直肠癌治疗的有效方案。
对于晚期结直肠癌患者而言,治愈难度极大[16],本研究中经过4个疗程治疗后,两组患者无一例CR。表明对于无法行手术治疗的晚期结直肠患者,可考虑以姑息性治疗为主,其治疗的主要目的就是延长患者生存时间,减少化疗引起的不良反应,以改善患者的生命质量。因此,在缓解晚期结直肠患者相关临床症状的同时,减少抗癌药物所引起不良反应也是临床工作者需要考虑的一个重要问题。本研究中,两组患者不良反应均以Ⅰ、Ⅱ级为主,FOLFOXIRI组白细胞减少、腹泻程度高于SOX组,提示SOX方案耐受性优于FOLFOXIRI方案。
综上所述,FOLFOXIRI与SOX方案治疗晚期结直肠癌的效果相当,SOX方案耐受性优于FOLFOXIRI方案。本组为回顾性研究,结论尚需要开展前瞻性、多中心的随机对照研究以进一步证实。
无



























