
分析点状钙化和片状钙化甲状腺乳头状癌(PTC)的微血管密度(MVD)及淋巴结转移情况。
选择2015年5月至2017年10月扬州大学附属医院住院手术治疗的50例PTC患者,根据术后镜下病理性钙化的不同特点分为点状钙化组(38例)和片状钙化组(12例),比较两组病例病灶中央区MVD、外周区MVD、淋巴结转移情况之间的差异。
点状钙化组中央区、外周区平均MVD分别为(51±7)和(64±8)个/高倍视野,片状钙化组中央区、外周区平均MVD分别为(35±4)和(49±6)个/高倍视野,点状钙化组中央区、外周区MVD均高于片状钙化组,差异均有统计学意义(t=10.183、12.406,均P<0.05);点状钙化组颈Ⅵ区淋巴结转移率为42.1%(16/38),高于片状钙化组的8.3%(1/12),差异有统计学意义(χ2=4.635,P<0.05)。
不同病理性钙化类型PTC侵袭转移存在差异,伴有点状钙化的PTC较伴有片状钙化的PTC更易发生局部转移。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺癌是最常见且增长速度最快的内分泌系统恶性肿瘤,其中约80%为甲状腺乳头状癌(PTC)。PTC恶性度低、预后较好,但仍有约50% PTC可发生颈部淋巴结或远处转移,严重影响患者预后[1,2]。近年来,随着影像学检查技术的发展,特别是超声检查设备的改进,甲状腺结节钙化类型与甲状腺肿瘤的关系日益受到重视[3]。然而在日常病理诊断中,病理医师通常将PTC中出现的钙化视为肿瘤的继发性改变或诊断的提示指征,对于PTC中出现的不同类型病理性钙化与肿瘤预后的相关性研究不多。本研究拟通过比较不同病理性钙化类型PTC的微血管密度(MVD)及淋巴结转移率之间的差异,探讨PTC不同病理性钙化类型与患者预后的相关性。
选择2015年5月至2017年10月扬州大学附属医院50例甲状腺癌患者术后肿瘤标本。所有患者均经术中冷冻快速诊断与术后常规病理诊断为单发PTC,均为甲状腺首次手术并行颈Ⅵ区淋巴结清扫,具备完善的临床资料,排除其他类型甲状腺癌、甲状腺癌复发及肿瘤中混合性钙化患者。本研究符合2013年修订的《赫尔辛基宣言》的相关要求,所有患者均知情同意。根据常规病理切片中病理性钙化特点,分为点状钙化组(38例)和片状钙化组(12例),点状钙化组中男性9例,女性29例,年龄(41±6)岁,年龄范围23~63岁,肿瘤直径1.2~2.6 cm,平均(1.7±0.3)cm;片状钙化组中男性3例,女性9例,年龄(48±8)岁,年龄范围29~78岁,肿瘤直径1.8~3.4 cm,平均(2.4±0.5)cm。两组PTC患者的性别构成、年龄、肿瘤直径比较,差异均无统计学意义(均P>0.05),具有可比性。
均排除混合性钙化病例。(1)点状钙化:钙化灶呈圆形、卵圆形,点状分布于肿瘤内与肿瘤周边;(2)片状钙化:钙化灶呈带状、粗梁状,片状分布于肿瘤周边与肿瘤内。
采用抗CD34单克隆抗体(购自福州迈新生物技术开发有限公司,克隆号QBEnd/10)标记观察MVD,阳性部位为胞膜或胞质。记录两组患者病灶中央区与外周区MVD,选择病灶中央区与外周区血管最丰富的区域,每个区域选取5个热点,由同一名病理医师在高倍(×400)视野下计数微血管数目,取平均值后得出该区域的MVD。中央区指肿瘤组织中近中央的区域,外周区指肿瘤组织与正常甲状腺组织交界处的肿瘤组织侧。
采用SPSS 22.0统计学软件进行数据分析,计量资料符合正态分布,采用均数±标准差( ±s)表示,组间比较采用独立样本t检验;计数资料以百分率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
±s)表示,组间比较采用独立样本t检验;计数资料以百分率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
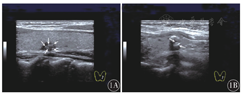
超声声像图显示,点状钙化组钙化灶呈低回声结节内点状强回声,散在分布,不伴声影和"彗星尾征"(图1A);片状钙化组钙化灶呈斑片状分布,位于结节边缘或中央,位于边缘可呈弧形,中央可呈簇状,常伴声影(图1B)。

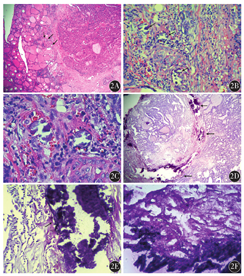
点状钙化:钙化灶通常位于肿瘤周边与肿瘤内,呈散在的点状分布,钙化灶之间有肿瘤组织或间质分隔(图2A);钙化灶呈圆形或卵圆形,边界清楚,直径约100 μm(图2B);高倍镜下钙化物嗜蓝染,颗粒较细,呈同心圆状的钙化小体(图2C)。片状钙化:钙化灶通常位于肿瘤周边与肿瘤内,呈片状分布,常伴有周围间质胶原化变性,通常肉眼可见(图2D);钙化灶呈带状、粗梁状。因周边通常伴有继发性改变,边界较清楚,分布宽度与长度不等(图2E);高倍镜下钙化物嗜蓝染,颗粒较粗,于钙化物断裂处可见层状结构的晶状体(图2F)。

点状钙化组外周区MVD为(64±8)个/HP,片状钙化组外周区MVD为(49±6)个/HP,点状钙化组高于片状钙化组(t=12.406,P<0.05);点状钙化组中央区MVD为(51±7)个/HP,片状钙化组中央区MVD为(35±4)个/HP,点状钙化组高于片状钙化组(t=10.183,P<0.05);点状钙化组颈Ⅵ区淋巴结转移率为42.1%(16/38),片状钙化组颈Ⅵ区淋巴结转移率为8.3%(1/12),点状钙化组淋巴结转移率高于片状钙化组(χ2=4.635,P<0.05)(图3)。


病理性钙化较少见于良性甲状腺病变,良性甲状腺病变中发生的钙化通常是由于炎性刺激、局部出血机化或病变周围纤维变性后出现的钙盐沉积。而在甲状腺恶性肿瘤,特别是PTC中常会出现钙化,可能与下列因素有关:肿瘤细胞迅速生长,导致周围血管及纤维组织过度增生而伴发钙盐沉积;肿瘤细胞分泌的多种物质,如糖蛋白、黏多糖等促进了钙盐在局部的沉积;肿瘤细胞发生凋亡后,钙盐在其周围沉积[4,5]。超声检查已成为评价甲状腺疾病良恶性的首选检查方法,而在诸多判定甲状腺结节性质的超声指标中,甲状腺结节内的钙化灶受到超声医师的广泛重视。依据高频超声下清晰显示的甲状腺结节内钙化灶的不同影像学特征,超声医师认为微小钙化现象是甲状腺癌的高度特异性表现,对于甲状腺结节良恶性的判定具有重要临床意义[6,7]。然而病理医师在日常病理诊断中,通常将PTC中出现的钙化视为肿瘤的继发性改变与诊断的提示指征(如砂粒体),并未将钙化作为一项病理诊断指标与PTC的预后联系起来。
目前有相关研究认为,PTC中的微小钙化(如砂粒体)是由完好的肿瘤细胞释放到肿瘤局部的代谢产物因继发营养不良而产生的,并不是通常所认为的由肿瘤细胞坏死所导致,其形成过程与发生坏死的细胞并无直接关联[8,9]。Bai等[10]研究认为PTC发生的病理性钙化与骨形态发生蛋白(BMP)的大量表达密切相关。BMP是转化生长因子β(TGF-β)家族中的重要成员,具有调节器官发育成熟、促进软骨与骨的成熟、调控细胞增殖与分化的作用。在众多的BMP中,BMP-2因具有较强的诱导成骨能力及在多种肿瘤中高表达而被重视[11,12]。BMP-2参与了上皮间质转化(EMT)的诱导调控过程,EMT是指上皮细胞经特定生化作用后转变为具有间质表型细胞的生物学过程,EMT与肿瘤细胞的侵袭转移能力密切相关[13]。BMP-2可诱导调控EMT,因而可以推断BMP-2不仅与PTC发生的病理性钙化密切相关,同时也与肿瘤细胞的侵袭转移密切相关[14]。研究发现,BMP-2通过与细胞表面TGF-β受体相结合后再激活其受体的方式发挥生物学作用,目前认为是通过PI3K-Akt信号通路、Smad通路、Rho-kinase多信号通路及Ras-MAPK信号通路传递信号,其中PI3K-Akt信号通路是已知的可直接调控EMT、促进肿瘤细胞侵袭转移的信号通路[15,16]。另一方面,肿瘤的生长、浸润、转移能力与肿瘤内的血管密度有关,肿瘤组织内MVD可作为新的肿瘤生物学指征,反映了肿瘤内微血管形成的强度与肿瘤细胞的侵袭能力,可作为肿瘤细胞发生侵袭转移的预测指标[17]。Ma等[18]通过研究发现成骨样细胞经BMP-2刺激后可产生血管内皮生长因子(VEGF),而VEGF又可促进局部微血管的生成。Zuo等[19]通过研究过表达BMP-2的肝癌细胞发现,BMP-2能够促进肝癌组织内血管的生成,提高肿瘤组织内MVD。目前,BMP-2促进肿瘤组织内血管生成的机制仍未明确。由此可见,BMP-2在诱导肿瘤组织内出现病理性钙化的同时,也促进了肿瘤组织内微血管的生成与肿瘤细胞的侵袭转移。
因此,病理医师应将PTC中出现的钙化作为与PTC肿瘤细胞侵袭转移相关的病理指征。应将钙化与肿瘤细胞分化程度、肿瘤直径、有无周围侵犯等重要病理指征相同对待。同时本研究显示,PTC中可出现点状钙化,也可出现片状钙化;点状钙化患者肿瘤外周区与中央区MVD均高于片状钙化患者;点状钙化患者发生淋巴结转移概率高于片状钙化患者;PTC点状钙化患者的肿瘤细胞较片状钙化患者的肿瘤细胞更具侵袭转移能力,应将不同病理性钙化类型作为诊断指标在病理报告中体现。至于在PTC肿瘤组织中为何出现不同类型的病理性钙化,有待进一步研究。
无



























