
研究经放射诱导的乳腺癌细胞株MDA-MB-231和MCF-7细胞周期和细胞凋亡的变化特点,探讨其与放射敏感性间的联系。
使用6 MV X线对MCF-7和MDA-MB-231细胞进行照射,采用克隆形成实验拟合细胞存活曲线,计算放射生物学参数:平均致死剂量(D0)、准域剂量(Dq)和2 Gy照射的存活分数(SF2),比较肿瘤细胞放射敏感性;Hoechst 33342染色法检测肿瘤细胞的凋亡率,PI染色检测细胞周期。
经6 MV X线照射后,MDA-MB-231细胞的存活曲线较MCF-7细胞右移;MDA-MB-231细胞D0、Dq和SF2值均大于MCF-7细胞(1.603±0.023比1.233±0.027、1.76±0.04比1.03±0.10、0.639 3±0.008 2比0.398 1±0.018 5,t值分别为-17.981、-11.745、-20.596,P值分别为0.000、0.003、0.000)。MCF-7细胞在2、4、8 Gy照射后24 h及同一剂量6 Gy照射后12 h和48 h的凋亡率均高于MDA-MB-231细胞(t值分别为4.441、7.299、10.499、6.375、7.743,P值分别为0.011、0.002、0.000、0.003、0.001)。和未照射相比,这两种细胞照射后均出现了不同程度的G2期阻滞,MDA-MB-231细胞组中G2/M期细胞比例随照射后时间及剂量的增加而逐渐增高,直至照射后48 h也未见细胞周期的明显恢复;而MCF-7细胞在受到8 Gy照射后24 h及6 Gy照射后48 h,这种阻滞就开始逐渐解除,随之出现G0/G1期细胞比例增高[(65.80±0.56)%、(62.53±0.67)%]。
2~8 Gy 6 MV X线照射可诱导MCF-7细胞发生G1和G2期阻滞,MDA-MB-231细胞发生G2期阻滞,从而导致MCF-7细胞出现更多的凋亡,这也可能是造成两者放射敏感性差异的原因之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,乳腺癌的发病率一直居高不下,虽然放射治疗能够降低肿瘤局部复发率,并转化成一定的生存获益[1,2],但仍有部分患者会出现放疗后肿瘤复发、转移,尤其是难治性三阴性乳腺癌可能存在放射抵抗的情况。一般认为肿瘤细胞固有的放射敏感性或放射抗性是制约放疗效果的根源之一[3]。有研究发现细胞的放射反应与照射后细胞凋亡水平和细胞周期分布密切相关,即同一种肿瘤的不同细胞株,放射后的细胞凋亡或周期进程却不相同,最终表现为对射线的差异性反应。本研究旨在探讨不同乳腺癌细胞对X线敏感性的差异与细胞凋亡、细胞周期进程的关系。
人乳腺癌细胞株MCF-7(野生型p53)和MDA-MB-231(突变型p53)购自中国科学院上海细胞库;胎牛血清购于杭州四季青生物工程有限公司;RPMI 1640培养液购于美国Gibco公司。两种细胞常规培养于RPMI 1640培养液,用前加10%胎牛血清及100 U/ml青霉素、100 mg/ml链霉素;细胞均置于37 ℃含5% CO2恒温培养箱。选取处于对数生长期细胞用于实验。
采用Varian ClinicⅨ直线加速器(美国Varian公司)照射。照射条件:6 MV X线,机架角度180°,剂量率为300 cGy/min,源皮距(SSD)100 cm,照射野大小15 cm×15 cm,细胞面朝上。
取对数生长期MCF-7和MDA-MB-231细胞,待细胞贴壁后培养24 h,分别给予0、2、4、6、8 Gy X线照射。照射后根据不同照射剂量(由低到高)分别接种200~5×104个细胞于6 cm培养皿,每个剂量点设3个平行样本。随后将细胞静置于培养箱中进行克隆培养10~14 d,出现肉眼可见的克隆时终止培养,无水乙醇固定,吉姆萨染色。计数各孔细胞数>50个的细胞克隆数,计算细胞存活分数(SF),并绘制剂量效应曲线。实验重复3次。数据分析使用GraphPade Prism 5.0软件,以多靶单击数学模型拟合细胞存活曲线(D为照射剂量,N为外推数),计算出两种乳腺癌细胞的准域剂量(Dq)、平均致死剂量(D0)和SF。
SF=1-(1-e-D/D0)N
取对数生长期MCF-7和MDA-MB-231细胞,以每孔5×103个细胞接种于96孔板,100 μl/孔,培养24 h细胞贴壁后,分别给予0、2、4、6、8 Gy X线照射。24 h后收集细胞(根据预实验结果得出进行后续实验的最佳剂量为6 Gy,其中6 Gy组收集照射后12、24、48 h细胞)。每孔加入100 μl染色液(Hoechst 10 μg/ml,PI 20 μmol/L),轻轻混匀后室温避光培养15 min,使用Acumen激光扫描荧光微孔板细胞分析仪,检测各组细胞凋亡率。上述实验重复3次。
待MCF-7和MDA-MB-231细胞贴壁后,分别给予0、2、4、6、8 Gy X线照射,24 h后收集细胞(其中6 Gy组收集照射后12、24、48 h细胞)。弃上清,每孔加入75%冰乙醇100 μl,4 ℃下固定过夜,过滤,磷酸盐缓冲液(PBS)清洗2次,所有步骤按细胞周期检测试剂盒说明书操作,每孔加入100 μl染色液(RNase 0.2 mg/ml,PI 20 μmol/L),37 ℃培养1 h,使用Acumen激光扫描荧光微孔板细胞分析仪周期分析模板扫描,检测488 nm处激发荧光信号,根据扫描结果对细胞周期进行分析,计算细胞周期时相比例。上述实验重复3次。
数据采用SPSS 19.0统计软件进行分析。计量资料符合正态分布,以均数±标准差( ±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
根据多靶单击模型绘制的MCF-7和MDA-MB-231细胞剂量效应曲线见图1。两种乳腺癌细胞的Dq、D0、SF2值见表1。MCF-7和MDA-MB-231细胞经过6 MV X线照射后的SF均随剂量的增加而逐渐降低,且在相同照射剂量下,MCF-7细胞的SF均低于MDA-MB-231细胞(表2)。上述结果表明MCF-7细胞的放射敏感性高于MDA-MB-231细胞。
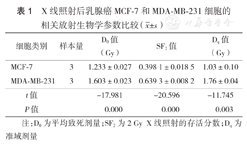
X线照射后乳腺癌MCF-7和MDA-MB-231细胞的相关放射生物学参数比较( ±s)
±s)
X线照射后乳腺癌MCF-7和MDA-MB-231细胞的相关放射生物学参数比较( ±s)
±s)
| 细胞类别 | 样本量 | D0值(Gy) | SF2值 | Dq值(Gy) |
|---|---|---|---|---|
| MCF-7 | 3 | 1.233±0.027 | 0.398 1±0.018 5 | 1.03±0.10 |
| MDA-MB-231 | 3 | 1.603±0.023 | 0.639 3±0.008 2 | 1.76±0.04 |
| t值 | -17.981 | -20.596 | -11.745 | |
| P值 | 0.000 | 0.000 | 0.003 |
注:D0为平均致死剂量;SF2为2 Gy X线照射的存活分数;Dq为准域剂量
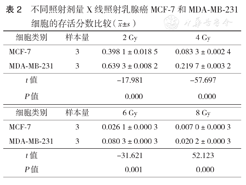
不同照射剂量X线照射乳腺癌MCF-7和MDA-MB-231细胞的存活分数比较( ±s)
±s)
不同照射剂量X线照射乳腺癌MCF-7和MDA-MB-231细胞的存活分数比较( ±s)
±s)
| 细胞类别 | 样本量 | 2 Gy | 4 Gy |
|---|---|---|---|
| MCF-7 | 3 | 0.398 1±0.018 5 | 0.083 3±0.002 4 |
| MDA-MB-231 | 3 | 0.639 3±0.008 2 | 0.219 7±0.003 2 |
| t值 | -17.981 | -57.697 | |
| P值 | 0.000 | 0.000 |
| 细胞类别 | 样本量 | 6 Gy | 8 Gy |
|---|---|---|---|
| MCF-7 | 3 | 0.026 1±0.000 3 | 0.007 0±0.000 3 |
| MDA-MB-231 | 3 | 0.080 3±0.000 3 | 0.020 2±0.000 3 |
| t值 | -31.621 | 52.123 | |
| P值 | 0.001 | 0.000 |
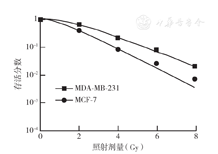

在6 Gy X线照射前,MCF-7和MDA-MB-231细胞凋亡率比较差异无统计学意义(P>0.05)。随照射后时间延长,MCF-7细胞凋亡率增加,且在照射后12、48 h的凋亡率均高于MDA-MB-231细胞(P<0.05);MDA-MB-231细胞照射后12 h与照射前相比凋亡率差异无统计学意义(P>0.05)(表3)。而经不同剂量X线照射后24 h,两种乳腺癌细胞的凋亡率均随着剂量的升高而增加,且2、4、8 Gy X线照射后24h组MCF-7细胞较MDA-MB-231细胞凋亡率更高(均P<0.05)(表4)。
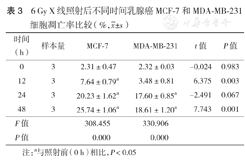
6 Gy X线照射后不同时间乳腺癌MCF-7和MDA-MB-231细胞凋亡率比较(%, ±s)
±s)
6 Gy X线照射后不同时间乳腺癌MCF-7和MDA-MB-231细胞凋亡率比较(%, ±s)
±s)
| 时间(h) | 样本量 | MCF-7 | MDA-MB-231 | t值 | P值 |
|---|---|---|---|---|---|
| 0 | 3 | 2.31±0.47 | 2.32±0.03 | -0.024 | 0.983 |
| 12 | 3 | 7.64±0.79a | 3.48±0.81 | 6.375 | 0.003 |
| 24 | 3 | 20.23±1.62a | 17.60±0.85a | -2.491 | 0.067 |
| 48 | 3 | 25.74±1.06a | 18.61±1.20a | 7.743 | 0.001 |
| F值 | 308.455 | 330.906 | |||
| P值 | 0.000 | 0.000 |
注:a与照射前(0 h)相比,P<0.05
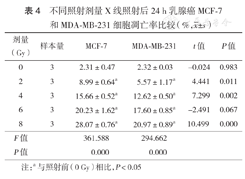
不同照射剂量X线照射后24 h乳腺癌MCF-7和MDA-MB-231细胞凋亡率比较(%, ±s)
±s)
不同照射剂量X线照射后24 h乳腺癌MCF-7和MDA-MB-231细胞凋亡率比较(%, ±s)
±s)
| 剂量(Gy) | 样本量 | MCF-7 | MDA-MB-231 | t值 | P值 |
|---|---|---|---|---|---|
| 0 | 3 | 2.31±0.47 | 2.32±0.03 | -0.024 | 0.983 |
| 2 | 3 | 8.99±0.64a | 5.57±1.17a | 4.441 | 0.011 |
| 4 | 3 | 15.66±0.52a | 12.62±0.50a | 7.299 | 0.002 |
| 6 | 3 | 20.23±1.62a | 17.60±0.85a | -2.491 | 0.067 |
| 8 | 3 | 28.07±0.76a | 20.97±0.89a | 10.499 | 0.000 |
| F值 | 361.588 | 294.662 | |||
| P值 | 0.000 | 0.000 |
注:a与照射前(0 Gy)相比,P<0.05
MCF-7细胞经6 Gy X线照射后12 h和24 h,G2/M期细胞比例增多,S期细胞比例减少(P<0.05),但照射后48 h时G2/M期细胞开始显著减少,G0/G1期细胞比例上升,不同时间段细胞比例与对照组(0 Gy)相比差异均有统计学意义(均P<0.05);MDA-MB-231细胞G2/M期细胞比例随照射后时间延长逐渐增高,S期细胞比例逐渐减少(表5);这两种乳腺癌细胞在接受不同剂量照射后24 h,与对照组(0 Gy)相比,均出现了G2/M期阻滞,MCF-7细胞在8 Gy X线照射后24 h G2/M期比例降至(14.37±1.16)%,同时G0/G1期比例明显上升;在MDA-MB-231细胞中未观察到这种现象(表6)。
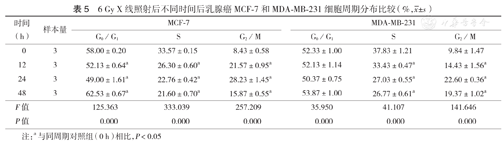
6 Gy X线照射后不同时间后乳腺癌MCF-7和MDA-MB-231细胞周期分布比较(%, ±s)
±s)
6 Gy X线照射后不同时间后乳腺癌MCF-7和MDA-MB-231细胞周期分布比较(%, ±s)
±s)
| 时间(h) | 样本量 | MCF-7 | MDA-MB-231 | ||||
|---|---|---|---|---|---|---|---|
| G0/G1 | S | G2/M | G0/G1 | S | G2/M | ||
| 0 | 3 | 58.00±0.20 | 33.57±0.15 | 8.43±0.58 | 52.33±1.00 | 37.83±1.21 | 9.84±1.47 |
| 12 | 3 | 52.13±0.64a | 26.30±0.60a | 21.57±0.95a | 52.13±1.14 | 33.43±0.47a | 14.43±1.56a |
| 24 | 3 | 49.00±1.61a | 22.76±0.42a | 28.23±1.45a | 50.37±0.75 | 27.03±0.55a | 22.60±0.36a |
| 48 | 3 | 62.53±0.67a | 21.60±0.70a | 15.87±0.55a | 53.87±1.00 | 26.77±0.61a | 19.37±1.02a |
| F值 | 125.363 | 333.039 | 257.209 | 35.950 | 41.107 | 141.646 | |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | |
注:a与同周期对照组(0 h)相比,P<0.05
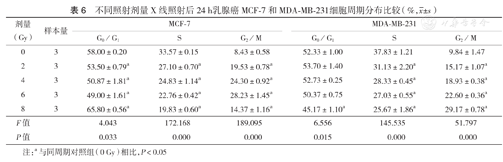
不同照射剂量X线照射后24 h乳腺癌MCF-7和MDA-MB-231细胞周期分布比较(%, ±s)
±s)
不同照射剂量X线照射后24 h乳腺癌MCF-7和MDA-MB-231细胞周期分布比较(%, ±s)
±s)
| 剂量(Gy) | 样本量 | MCF-7 | MDA-MB-231 | ||||
|---|---|---|---|---|---|---|---|
| G0/G1 | S | G2/M | G0/G1 | S | G2/M | ||
| 0 | 3 | 58.00±0.20 | 33.57±0.15 | 8.43±0.58 | 52.33±1.00 | 37.83±1.21 | 9.84±1.47 |
| 2 | 3 | 53.50±0.79a | 27.10±0.70a | 19.53±0.78a | 53.70±1.40 | 31.13±2.20a | 15.17±1.07a |
| 4 | 3 | 50.87±1.81a | 24.83±1.14a | 24.30±0.92a | 52.73±0.25 | 28.33±0.45a | 18.93±0.38a |
| 6 | 3 | 49.00±1.61a | 22.76±0.42a | 28.23±1.45a | 50.37±0.75 | 27.03±0.55a | 22.60±0.36a |
| 8 | 3 | 65.80±0.56a | 19.83±0.60a | 14.37±1.16a | 45.17±1.10a | 25.67±1.86a | 29.17±0.78a |
| F值 | 4.043 | 172.168 | 189.095 | 6.556 | 145.535 | 51.797 | |
| P值 | 0.033 | 0.000 | 0.000 | 0.015 | 0.000 | 0.000 | |
注:a与同周期对照组(0 Gy)相比,P<0.05
放疗对于乳腺癌的有效性已明确,但临床工作中发现不同分子表型乳腺癌对放射反应不一致,这种差异可能与乳腺癌细胞内在的放射生物学特质有关,但其具体机制目前尚不清楚。
放射生物学研究表明,X线作用于细胞,可引起多种类型的DNA损伤,继而影响细胞增殖状态,改变细胞周期,最终决定细胞的生死存亡;在此基础上形成了使用多靶单击模型来拟合细胞存活曲线,其中D0、Dq和SF2作为存活曲线上重要的放射生物学参数,与细胞的放射敏感性呈负相关[4,5]。MCF-7细胞为雌激素受体(ER)阳性、孕激素受体(PR)阳性、人表皮生长因子受体(HER-2)阴性的典型的Luminal型乳腺癌细胞株[6],MDA-MB-231细胞为ER、PR、HER-2均阴性的三阴性乳腺癌细胞株。本研究结果显示经X线照射后MDA-MB-231细胞的存活曲线较MCF-7细胞右移。MDA-MB-231细胞在各个照射剂量点SF均大于MCF-7细胞(P<0.05),反映肩区大小、说明细胞亚致死损伤修复能力的Dq值以及代表SF下降63%所需照射剂量的D0值也均大于MCF-7细胞,进一步提示MDA-MB-231较MCF-7细胞放射抗拒,与文献[7,8]报道一致。
辐射杀伤肿瘤细胞的重要机制是诱导细胞凋亡,是由多基因、多阶段调控的复杂程序,不同细胞受照后的凋亡水平会有很大差别[9,10]。本研究结果显示接受2~8 Gy X线照射后MDA-MB-231细胞凋亡率随剂量的增加而增高,但并未出现时间效应;MCF-7细胞凋亡率则同时呈现剂量和时间依赖性增高,MCF-7细胞在2、4、8 Gy X线照射时的凋亡较MDA-MB-231细胞更明显(P<0.05),在同一剂量6 Gy X线照射后的12 h和48 h的凋亡率也高于MDA-MB-231细胞。以上结果一定程度上反映了MCF-7细胞较MDA-MB-231细胞对辐射更为敏感,而这类同种组织、不同性质或来源的细胞出现各自依赖的凋亡模式,可能有不同的分子机制参与[11,12],还有待进一步的研究。
本实验中MCF-7细胞的凋亡速率较MDA-MB-231细胞快,提示两种细胞辐射敏感性不同,可能也与凋亡速率有关。既往研究表明,肿瘤细胞固有的放射敏感性与细胞凋亡、细胞周期进程及周期关键点的信号转导通路之间都是相互偶联的[13]。细胞受到照射后可出现细胞周期阻滞,这种阻滞现象和阻滞时间的长短有关,其实质为DNA损伤后细胞启动的一种保护机制,即允许足够的时间修复DNA损伤,若修复完成,细胞进入下一周期运行;若无法修复或不能修复,细胞则走向凋亡。
本研究结果显示,在未接受X线照射时,细胞周期在两种乳腺癌细胞之间的分布无明显差异;照射后,两种细胞均出现了不同程度的G2/M期阻滞。在MDA-MB-231细胞组中G2/M期细胞比例随照射后时间及剂量的增加而逐渐增高,直至照射后48 h也未见细胞周期的明显恢复。而MCF-7细胞在受到8 Gy X线照射后24 h及6 Gy X线照射后48 h,出现G2/M期细胞减少,G0/G1期细胞增多,而其凋亡率仍随时间延长而增加,提示此阶段为加速MCF-7细胞由G2期进入M期,随之减少了细胞DNA损伤修复时间,使细胞损伤还未完全修复就过早进入分裂期,导致细胞有丝分裂灾难性死亡增加;而MDA-MB-231细胞组观察结果显示,其在G2/M期的阻滞时间较MCF-7细胞延长,而导致肿瘤细胞DNA损伤修复时间延长,最终延迟细胞凋亡。可见不同细胞对于放射线敏感程度不同,细胞周期阻滞程度也不相同。结合近年研究[14,15]报道,如G2期阻滞时间缩短可通过灭活DNA检查基因或上调Wnt-β-catenin信号通路等方式导致细胞放射敏感性的增强,相信可以为使用药物让肿瘤细胞进入同步化并在敏感时相进行照射达到放射增敏效应提供一定的理论基础。
射线引起的DNA损伤修复是受细胞周期调控的,而p53基因状态是影响细胞周期再分布的因素之一。野生型p53蛋白作为DNA修复的主要效应分子,可通过启动p21基因转录、抑制CDK激活等方式,引起G1期阻滞,并参与细胞凋亡的调控过程[16]。而大多数肿瘤细胞p53为突变型,在DNA受损时因不能启动G1期检查点功能,表现为G2期阻滞。在本研究中,MCF-7细胞在受到8 Gy X线照射后24 h及6 Gy X线照射后48 h,G0/G1期的细胞比例明显上升,并诱导大量细胞凋亡;而MDA-MB-231细胞在照射后的各个时间点、各个剂量点均表现出了G2期阻滞,而未出现G1期阻滞,相应的细胞凋亡率也显著低于MCF-7细胞。可见调节细胞p53功能可有望改变细胞的放射敏感性。最近有研究报道[17],X线可通过诱导野生型p53蛋白正反馈基因环路,上调野生型p53蛋白的表达,从而调控肺腺癌细胞发生显著的G0/G1期阻滞,进而诱导细胞凋亡,提高放射敏感性。
综上,不同的乳腺癌细胞在接受X线照射后可发生不同的细胞周期变化,而导致不尽相同的细胞凋亡,这也可能是造成临床放疗效果差异的因素之一。对不同细胞放射生物学效应的深入研究,可为不同分子类型乳腺癌患者提供更为切实有效的治疗方案。
无



























