
近年来研究发现肠道微生态与肿瘤的发生、发展及治疗密切相关,文章就二甲双胍通过调节肠道菌群抗肿瘤机制的研究进展进行总结,并对研究过程中出现的问题进行综述和展望。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
癌症早已成为各国亟待解决的重要健康问题,随着抗肿瘤药物的研发,一些非传统抗癌药物再次进入人们视野,显示出良好的抗癌效果。一项调查结果显示服用二甲双胍的糖尿病患者比服用磺脲类或胰岛素治疗的糖尿病患者发生癌症的可能性更低[1]。现就二甲双胍抗肿瘤的研究进展作一综述。
AMPK能增强葡萄糖摄取,促进肝脏脂肪酸的氧化与生酮作用,并抑制下游蛋白雷帕素靶蛋白(mTOR)的活性,平衡细胞能量代谢(图1)[2]。mTOR通过整合多种输入信号,控制葡萄糖的输入和蛋白质的合成,调节细胞周期和肿瘤血管生成,促进肿瘤细胞增殖、分化和转移,使恶性肿瘤病程逐步进展,而二甲双胍则可激活AMPK通路,抑制肿瘤生长[3,4,5]。
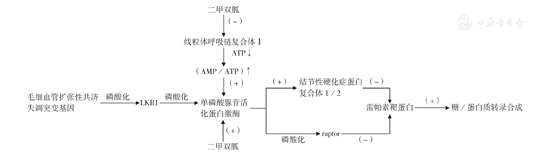

注:ATP为腺嘌呤核苷三磷酸;AMP腺嘌呤核糖核苷酸
已有证据表明,免疫系统与代谢系统相互交流、相互影响[17]。二甲双胍作为代谢调节性药物,对抗肿瘤免疫具有良好的调节作用[6,7]。肿瘤的本质是代谢性疾病[18],作为调节代谢的药物二甲双胍,其介导的抗肿瘤免疫过程正是免疫与代谢交流碰撞的结果,而二甲双胍则是免疫应答、代谢调节、抗肿瘤三者之间的交通枢纽,通过提高肿瘤免疫微环境下糖酵解生成ATP的效能并降低氧耗,改善肿瘤免疫微环境,解救耗竭T细胞[8,19],进而增强抗肿瘤免疫。
Pearce等[7]指出二甲双胍可通过激活免疫系统产生对肿瘤的杀伤效果,注入EL4-Ova肿瘤细胞的小鼠,33 d后的存活率在二甲双胍组为66.7%(6/9),磷酸盐缓冲液(PBS)对照组为12.5%(1/8),且此差别与记忆T细胞数量相关。肿瘤特异性CD8+ T细胞在肿瘤免疫过程中发挥关键作用,而mTOR是记忆性CD8+ T细胞分化的主要调节蛋白。Shi等[20]在淋巴瘤模型中发现,二甲双胍可诱导AMPK激活而抑制mTOR信号途径活性,并在高剂量与低剂量下均可抑制B/T细胞淋巴瘤的生长且增强自噬效应。此外,多柔比星与二甲双胍联合用药时,淋巴细胞对化疗药物的敏感性显著提高。Zhao等[21]通过小鼠肝癌模型发现口服二甲双胍的肝癌小鼠肿瘤生长速度明显低于对照组,二甲双胍抑制CD4+ T细胞分化为Th1细胞和Th17细胞,从而下调两者分泌IL-22的数量。由上可知,通过对CD8+ T细胞及CD4+ T细胞的调控,二甲双胍有效增强了抗肿瘤免疫反应。
免疫检查点在免疫逃逸反应中起到重要作用,免疫检查点抑制剂逐渐成为免疫治疗肿瘤的重要手段。目前,免疫检查点抑制剂对多种肿瘤有明显的临床疗效,如黑色素瘤、肾癌、非小细胞癌、淋巴瘤等恶性肿瘤。然而,很多患者对免疫检查点抑制剂不敏感。Scharping等[8]认为这与瘤内低氧有关,采用二甲双胍与抗程序性死亡受体1(PD-1)抗体联合用药,试图改善免疫检查点抑制剂的抗肿瘤效能。结果提示抗PD-1抗体与二甲双胍联合能够降低氧耗,改善肿瘤微环境,增强瘤内T细胞功能,二甲双胍有除瘤效能。亦有研究发现二甲双胍能增进CD8+ TIL细胞的增殖,抑制其凋亡并促使CD8+ TIL细胞向效应型记忆T细胞转换,刺激IL-2、TNF-α、IFN-γ表达增加,降低PD-1、Tim-3的表达,增强抗癌疫苗的作用[9]。除此以外,大量证据[22,23,24]表明二甲双胍可抑制肿瘤相关炎症反应,在此过程中,NK-κB活性下调,部分炎症因子的分泌有所降低,但这一抑制作用具体机制尚不明确。
尽管二甲双胍调节抗肿瘤免疫机制有待进一步明确,但目前研究已充分证明二甲双胍可增强抗肿瘤免疫反应,有效提高抗肿瘤免疫细胞的表达与激活,促进抗瘤相关主要细胞因子的分泌,有效抑制肿瘤的发生、发展。
正常肠道菌群参与构成肠道微环境,与宿主形成互利共生关系,直接或间接参与能量代谢、免疫调节等过程[25],其相对稳定状态维护机体的正常运转,而这种动态平衡一旦打破,菌群将从多种途径影响宿主健康状态[26]。大量回顾性调查及临床前试验证明,肠道菌群失调与多种疾病,如炎症性肠病、糖尿病甚至肿瘤的发生、发展有关,且影响肿瘤治疗效果,很多利用益生菌防癌抗癌的研究应运而生。
有研究[27]发现,当接受化疗的荷瘤小鼠小肠中的革兰阳性细菌受到抑制后,环磷酰胺对其的化疗疗效反而下降。为明确原因,进一步研究发现,这些肠道菌群可以激发新的免疫防御机制,增强pTh17细胞及记忆性Th1细胞的抗肿瘤效应,抑制肿瘤的生长。Song等[28]发现IL-17C在人类结直肠癌患者及肠道肿瘤小鼠模型中高表达,后续实验证实失调的肠道菌群(主要为肠杆菌)促进肠上皮细胞中IL-17C的表达,而IL-17C可通过激活TLR-MyD88通路诱导抗凋亡因子bcl-2与bcl-xl的表达从而促进肿瘤生长。同样,抗PD-1抗体的抗肿瘤效能高低亦被证实与肠道菌群差异性相关,抗PD-1抗体联合双歧杆菌可促进树突状细胞活化进而激活更多的CD8+ T细胞,增强前者对小鼠黑色素瘤的肿瘤抑制效能[29]。另一项研究[30]佐证了以上观点,伊匹单抗对无菌荷瘤小鼠及用抗生素(联合青霉素、链霉素及黏菌素或单独使用亚胺培南)处理过的荷瘤小鼠,表现出明显弱于无特定病原体(SPF)小鼠的抗肿瘤免疫应答反应,CD4+ Foxp3-T细胞及TIL细胞数显著低于SPF组。而后,给予抗生素组小鼠脆弱类杆菌、伯氏杆菌、多形拟杆菌,抗CTL-A抗体的抗肿瘤效能得到恢复,抗肿瘤免疫再次增强。此外,近期发现肠道菌群可通过CD8α树突状细胞及IL-12对细胞过继治疗恶性肿瘤进行免疫调节[31]。由此证实,抗肿瘤免疫反应与肠道菌群密切相关,肠道菌群对抗肿瘤免疫有重要的调节作用。
最近文献[32,33,34]报道,二甲双胍可调节肠道菌群的种类及数量,且前者具有抗肿瘤作用。Forslund等[32]对大量样本(包括糖尿病患者与健康人)进行回顾性统计分析,并采取进一步试验,认为二甲双胍通过肠道菌群调节短链脂肪酸产物(丁酸盐)的代谢以达到降糖效果。Karlsson等[35]亦认为肠道菌群是二甲双胍降糖介质,在抑制肝糖原异生过程此到重要作用。在另一项临床试验[34]中,初步诊断未经治疗的T2D患者被随机分为安慰剂组和二甲双胍组,严格控制饮食,4个月后,二甲双胍组与安慰剂组分别有86个与1个肠道细菌数量的变化,差异具有统计学意义,且发生变化的细菌多属于γ-变形菌门与厚壁菌门。为明确这些发生量变的细菌在试验过程中起到的作用,研究者将这些细菌移植到无菌小鼠身上,发现这些小鼠的糖代谢有所改善。关于二甲双胍对肠道菌群具体影响则是利用肠道模拟器,将排泄物与二甲双胍置于其中,结果显示二甲双胍对肠道菌群有直接作用,前者调节肠道菌群金属蛋白的基因表达,但其具体机制尚未可知。除小鼠实验外,亦可见二甲双胍调节线虫肠道菌群的报道。有报道[36]指出,二甲双胍可以抑制大肠埃希菌叶酸与蛋氨酸的代谢,且此抑制效应与杆状线虫的存活期延长具有显著相关性。由此得出,二甲双胍通过对调节肠道菌群中的糖、蛋白质、脂肪酸等物质的代谢,间接参与肠道菌群的表达与调控,显示出肠道菌群的差异性表达。
肠道菌群调节抗肿瘤免疫,而新兴的抗肿瘤药物二甲双胍可对肠道菌群进行调节,我们不妨设想,二甲双胍是否可通过调节肠道菌群调节免疫功能抑制肿瘤生长,形成二甲双胍-肠道菌群-抗肿瘤免疫调节轴,这一疑问有待我们进一步探究。
在二甲双胍抗肿瘤研究中有一些问题值得注意。首先,目前针对二甲双胍抗肿瘤特性的研究,多是回顾性统计分析或临床前研究,多仅涉及细胞和小鼠,临床效果有待证实;其次,二甲双胍抗癌实验中药物的使用剂量超过了糖尿病治疗的剂量标准,药物剂量及给药方式亦未统一;再次,实验中多采用免疫缺陷小鼠,其是否可形象模拟肿瘤患者免疫状况有待查证;除此以外,绝大多数的研究与糖尿病患者密不可分,而二甲双胍对非糖尿病人群的抗肿瘤效应亦待进一步明确;最后,二甲双胍通过平衡肠道菌群以达到抗肿瘤效应及其机制尚不明确,这些问题均有待解决。
尽管如此,大量的回顾性调查、队列研究、临床前试验认为二甲双胍可增强抗肿瘤免疫、改善肿瘤预后,这使得其抗肿瘤的研究具有重大的临床意义,可能为抗肿瘤药物研制另辟蹊径,其研究结果值得期待。
所有作者均声明不存在利益冲突



























