
探讨叶酸受体(FR)阳性循环肿瘤细胞(CTC)检测在肺部亚厘米结节(结节最大径≤10mm)良恶性诊断中的价值。
选择2018年7月至12月首都医科大学宣武医院收治的胸部CT检查显示有最大径≤10 mm的肺小结节患者37例,包括术后病理诊断为早期肺腺癌22例、肺良性病变15例。患者术前均留取静脉血,应用新型配体靶向聚合酶链反应(LT-PCR)检测FR+ CTC水平(以自定义的FU/3 ml为单位),应用酶联免疫吸附试验检测癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、细胞角蛋白19片段CYFRA21-1、糖类抗原125(CA125)、CA199、胃泌素释放肽前体(pro-GRP)等肿瘤标志物水平。计量资料两组间比较采用t检验,以检测试剂盒说明书指定的CTC值8.70 FU/3 ml为临界值,应用二元logistic回归法分析肺结节为恶性的危险因素;采用kappa一致性检验分析以FR+ CTC水平诊断与手术切除标本的病理结果诊断的一致性;绘制受试者工作特征曲线(ROC),评估各指标对肺部亚厘米结节良恶性的诊断效能。
早期肺腺癌患者FR+ CTC表达水平高于肺良性病变患者,差异有统计学意义[(11.0±3.0)FU/3 ml比(7.0±3.7)FU/3 ml,t=-3.327,P=0.001];FR+ CTC水平与患者的年龄、性别、吸烟史均无相关性(均P>0.05)。经logistic回归分析显示,FR+ CTC水平高为肺结节恶性的危险因素(OR=37.333,95% CI 3.994~349.010,P=0.002)。kappa一致性检验结果显示FR+ CTC诊断肺亚厘米结节性质具有一定的准确性(κ=0.627,P<0.01)。ROC分析显示,FR+ CTC作为诊断肺结节恶性的指标时,其诊断价值优于CEA、NSE、CYFRA21-1三者联合;FR+ CTC的曲线下面积(AUC)为0.830(95%CI 0.639~0.968),诊断灵敏度为72.7%(95%CI 49.6%~88.4%),特异度为93.3%(95%CI 66.0%~99.7%);将FR+ CTC、CEA、NSE、CYFRA21-1四者联合诊断肺癌时,AUC为0.776(95%CI 0.614~0.938),诊断灵敏度为86.4%,特异度为73.3%。
FR+ CTC检测对肺部亚厘米结节的良恶性诊断具有较高的价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性肺癌是世界范围内发病率和死亡率最高的恶性肿瘤,5年生存率仅为19%,而Ⅰ期非小细胞肺癌(NSCLC)的5年生存率达88%~100%[1,2,3]。随着低剂量螺旋CT(LDCT)的广泛应用,越来越多的肺部小结节被发现,如何科学合理地诊断并处理这类肺结节已成为挑战。循环肿瘤细胞(CTC)的概念最早在1869年被提出[4],目前定义为自发或因诊疗操作由实体瘤或转移灶释放进入外周血液循环的肿瘤细胞[5]。CTC检测是一种新兴的微创液体活组织检查技术,有助于疾病的早期诊断和治疗过程中的疾病监测。叶酸受体(FR)是一种细胞表面受体糖蛋白,在多种肿瘤中均高表达,72%~83%的NSCLC患者细胞表面过表达FR[6,7]。既往研究表明,应用新型配体靶向聚合酶链反应(LT-PCR)检测NSCLC患者的FR+ CTC具有良好的临床价值[8,9]。但是目前已有的研究未具体区分肺结节的大小,且研究对象大多为直径较大的肺结节患者,单纯对亚厘米肺结节(结节最大径≤10 mm)患者进行CTC检测的研究较少。本研究对37例亚厘米肺结节患者采用LT-PCR法检测FR+ CTC,采用酶联免疫吸附试验(ELISA)检测肿瘤标志物水平,探讨它们尤其是FR+ CTC对亚厘米肺结节的诊断价值,以辅助临床医生为那些不知如何处理小结节的焦虑患者定制个性化治疗方案。
纳入标准:(1)胸部CT检查提示有可疑恶性的小结节(结节最大径≤10 mm),同时未伴有纵隔淋巴结肿大或其他转移灶;(2)既往未接受抗肿瘤药物治疗。排除标准:(1)胸部CT检查提示肺结节最大径>10 mm;(2)其他部位肿瘤继发肺转移;(3)既往接受手术及放化疗治疗;(4)肺部肿瘤复发。选取2018年7月至12月我院收治的胸部CT检查有最大径≤10 mm肺部亚厘米结节患者37例,其中男性17例,女性20例;年龄37~77岁。所有患者均接受手术治疗,术后依据石蜡标本进行病理诊断,其中早期肺腺癌22例,肺良性病变15例。本研究符合2013年修订的《赫尔辛基宣言》的要求,患者均知情同意并签署知情同意书。
患者在入院后第1天抽取静脉血3 ml,乙二胺四乙酸(EDTA)抗凝,30 min内送至我院检验科进行血样处理,采用LT-PCR法检测FR+ CTC水平,采用ELISA对癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、细胞角蛋白19片段CYFRA21-1、糖类抗原125(CA125)、CA199、胃泌素释放肽前体(pro-GRP)等肿瘤标志物定量。采用美国Biotek EL×800全自动酶联免疫分析仪进行肿瘤标志物的检测,FR+ CTC检测试剂盒由南通格诺思博生物科技有限公司提供。FR+ CTC的检测过程:首先通过免疫磁珠负向富集法从3 ml外周血中捕获CTC,然后通过靶向探针对FR+ CTC进行标记,最后用PCR法定量检测FR+ CTC。以FU/3 ml为FR+ CTC定量的单位[9,10]。CEA>5.0 ng/ml、CA125>35.0 U/ml、CA199>37.0 U/ml、NSE>17 ng/ml、CYFRA21-1>3.3 ng/ml、pro-GRP>69.2 pg/ml中,满足任何1项即为阳性。
采用SPSS 20.0软件进行统计学分析。FR+ CTC水平呈正态分布,用均数±标准差( ±s)表示,两组间比较用t检验,组间分类资料比较用χ2检验。以检测试剂盒说明书指定的CTC值8.70 FU/3 ml为临界值,对FR+ CTC水平诊断肺结节恶性情况赋值,其中≥8.70 FU/3 ml为1,<8.70 FU/3 ml为0;以FR+ CTC水平为因变量,以性别、年龄、吸烟史、病理类型为自变量,应用二元logistic回归法分析肺结节恶性的危险因素;以手术切除标本的病理结果作为诊断肺癌的金标准,采用kappa一致性检验分析FR+ CTC水平诊断亚厘米肺结节良恶性与金标准诊断的一致性;绘制受试者工作特征曲线(ROC),计算曲线下面积(AUC),评估各指标的诊断效能。P<0.05为差异有统计学意义。
±s)表示,两组间比较用t检验,组间分类资料比较用χ2检验。以检测试剂盒说明书指定的CTC值8.70 FU/3 ml为临界值,对FR+ CTC水平诊断肺结节恶性情况赋值,其中≥8.70 FU/3 ml为1,<8.70 FU/3 ml为0;以FR+ CTC水平为因变量,以性别、年龄、吸烟史、病理类型为自变量,应用二元logistic回归法分析肺结节恶性的危险因素;以手术切除标本的病理结果作为诊断肺癌的金标准,采用kappa一致性检验分析FR+ CTC水平诊断亚厘米肺结节良恶性与金标准诊断的一致性;绘制受试者工作特征曲线(ROC),计算曲线下面积(AUC),评估各指标的诊断效能。P<0.05为差异有统计学意义。
术后病理诊断早期肺癌22例,其中男性9例,女性13例,中位年龄56岁(42~77岁);均为腺癌,均未发现淋巴结转移灶和远处转移灶,即均为ⅠA1期;2例有吸烟史。术后病理诊断肺良性病变15例,其中男性8例,女性7例,中位年龄56岁(37~68岁),其中4例有吸烟史。早期肺癌组与肺良性病变组间年龄、性别、吸烟史构成差异均无统计学意义(均P>0.05),具有可比性。
早期肺癌患者的FR+ CTC水平高于肺良性病变患者,差异有统计学意义(P=0.001),不同年龄、性别、吸烟史分层的患者间,FR+ CTC水平差异均无统计学意义(均P>0.05)(表1)。logistic回归分析显示,FR+ CTC水平高为肺结节恶性的危险因素(OR=37.333,95%CI 3.994~349.010,P=0.002)。
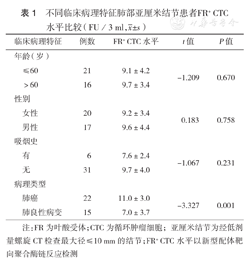
不同临床病理特征肺部亚厘米结节患者FR+ CTC水平比较(FU/3 ml, ±s)
±s)
不同临床病理特征肺部亚厘米结节患者FR+ CTC水平比较(FU/3 ml, ±s)
±s)
| 临床病理特征 | 例数 | FR+ CTC水平 | t值 | P值 | |
|---|---|---|---|---|---|
| 年龄(岁) | |||||
| ≤60 | 21 | 9.1±4.2 | - 1.209 | 0.670 | |
| >60 | 16 | 9.7±3.4 | |||
| 性别 | |||||
| 女性 | 20 | 9.2±3.4 | 0.183 | 0.758 | |
| 男性 | 17 | 9.6±4.4 | |||
| 吸烟史 | |||||
| 有 | 6 | 7.6±2.4 | - 1.067 | 0.231 | |
| 无 | 31 | 9.7±4.0 | |||
| 病理类型 | |||||
| 肺癌 | 22 | 11.0±3.0 | - 3.327 | 0.001 | |
| 肺良性病变 | 15 | 7.0±3.7 | |||
注:FR为叶酸受体;CTC为循环肿瘤细胞;亚厘米结节为经低剂量螺旋CT检查最大径≤10 mm的结节;FR+ CTC水平以新型配体靶向聚合酶链反应检测
kappa一致性检验表明,以FR+ CTC水平诊断亚厘米肺结节良恶性与金标准诊断有一定的一致性(κ=0.627,P<0.01)。绘制ROC,以CEA+NSE+CYFRA21-1联合对亚厘米肺结节恶性诊断的灵敏度较低;以CEA+CA125+CA199+NSE+CYFRA21-1+pro-GRP六者联合诊断的灵敏度较高,但特异度低至39.1%;以FR+ CTC诊断时,AUC最高,灵敏度为72.7%(95%CI 49.6%~88.4%),特异度为93.3%(95%CI 66.0%~99.7%),阳性预测值和阴性预测值均较高;以FR+ CTC+CEA+NSE+CYFRA21-1联合诊断的灵敏度最高(表2,图1)。
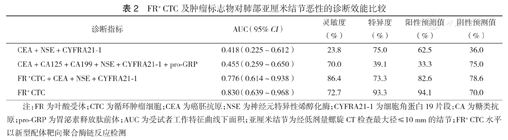
FR+ CTC及肿瘤标志物对肺部亚厘米结节恶性的诊断效能比较
FR+ CTC及肿瘤标志物对肺部亚厘米结节恶性的诊断效能比较
| 诊断指标 | AUC(95% CI) | 灵敏度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) |
|---|---|---|---|---|---|
| CEA+NSE+CYFRA21-1 | 0.418(0.225~0.612) | 23.8 | 75.0 | 62.5 | 36.0 |
| CEA+CA125+CA199+NSE+CYFRA21-1+pro-GRP | 0.455(0.259~0.650) | 70.0 | 39.1 | 33.3 | 75.0 |
| FR+CTC+CEA+NSE+CYFRA21-1 | 0.776(0.614~0.938) | 86.4 | 73.3 | 82.6 | 78.6 |
| FR+ CTC | 0.830(0.639~0.968) | 72.7 | 93.3 | 94.1 | 70.0 |
注:FR为叶酸受体;CTC为循环肿瘤细胞;CEA为癌胚抗原;NSE为神经元特异性烯醇化酶;CYFRA21-1为细胞角蛋白19片段;CA为糖类抗原;pro-GRP为胃泌素释放肽前体;AUC为受试者工作特征曲线下面积;亚厘米结节为经低剂量螺旋CT检查最大径≤10 mm的结节;FR+ CTC水平以新型配体靶向聚合酶链反应检测
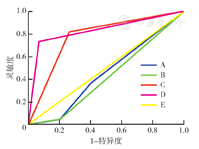

注:A为CEA+CA125+CA199+NSE+CYFRA21-1+pro-GRP;B为CEA+NSE+CYFRA21-1;C为FR+ CTC+CEA+NSE+CYFRA21-1;D为FR+ CTC;E为参考线;FR为叶酸受体;CTC为循环肿瘤细胞;CEA为癌胚抗原;CA为糖类抗原;NSE为神经元特异性烯醇化酶;CYFRA21-1为细胞角蛋白19片段;pro-GRP为胃泌素释放肽前体;亚厘米结节为经低剂量螺旋CT检查最大径≤10 mm的结节;FR+ CTC水平以新型配体靶向聚合酶链反应检测
科学技术的进步推动了精准医疗的迅速发展,液体活组织检查通过非侵入式的对血液中的CTC及循环肿瘤DNA进行检测,正逐渐成为肿瘤精准医疗领域强有力的诊断工具。以血液或其他体液样本为基础的非侵入性技术,已经被证明是有效的[11],可作为肺癌筛查或早期诊断的无创方法[12,13]。
早期NSCLC患者生存率高,对其早发现、早诊治能极大地提高我国肺癌患者的整体生存率和治愈率。肿瘤的大小是预测NSCLC预后的重要指标。随着近年来高分辨率CT和低剂量CT筛查方案的应用,越来越多的较小肺结节被检出,尤其是最大径<10 mm的肺结节。
最大径≤10 mm的孤立性肺结节被称为亚厘米肺结节[14,15],符合第8版肺癌TNM分期系统中T1a病变的标准。肿瘤长径超过2 mm时便可诱导血管生成,为肿瘤提供血供,从而为肿瘤细胞迁移提供条件。动物实验表明,在转基因小鼠种植后17~18周,即可在血液中检出细胞角蛋白(CK)与人类表皮生长因子受体2(HER2)同时阳性表达的细胞,而此时原发肿瘤体积<1 mm3。而且随着肿瘤逐渐增大,CTC的数量呈指数级别上升[16,17]。故本研究选取肺亚厘米结节患者为研究对象,探讨FR+ CTC对其的诊断效能。
本研究共入组了22例ⅠA1期肺癌患者和15例肺部良性病变患者,结果显示ⅠA1期肺癌组的FR+ CTC水平高于肺良性病变组(P=0.001)。该研究与既往不同检测CTC方法的研究得出一致的结论[8,9,10,18,19,20],尤其与Chen等[19]研究结果相同,在该研究中,早期肺癌患者FR+ CTC的水平高于良性病变患者[(12.41±9.02)FU/3 ml比(6.95±5.45)FU/3 ml,P<0.001]。提示FR+ CTC的水平能有效区分肺癌和肺部良性疾病,因此临床诊疗过程中可以进行FR+ CTC的检测,以辅助对那些不知如何处理结节的患者定制个体化治疗方案。
有研究指出:肺癌患者CTC的水平与患者的无进展生存和总生存有明显的相关性,可以作为一种新的NSCLC患者预后指标[21,22,23]。本研究中ⅠA1期患者的FR+ CTC水平也存在差异,FR+ CTC水平的高低与预后是否存在明显的临床差异,我们也将持续进行随访观察。
本研究以8.70 FU/3 ml为截断值,FR+ CTC诊断肺结节恶性的灵敏度为72.7%,特异度为93.3%,与之前的大样本研究结果大体相符[9,19]。其中,Chen等[19]的大样本研究以8.93 FU/3 ml为最佳截断值,其灵敏度为74.4%,特异度为86.6%;但其研究对象中早期肺癌患者包括ⅠA1期、ⅠA2期和ⅠA3期患者。较大肺结节及中晚期肺癌患者的FR+ CTC水平理论上高于亚厘米肺结节患者,而本研究的对象仅为亚厘米肺结节患者,即ⅠA1期患者,但得到相近的预测效果,甚至稍优于Chen等[19]的研究结果。本研究结果提示CTC检测筛查ⅠA1期肺癌具有高灵敏度及特异度。
另外,为了提高诊断效能,本研究将传统肿瘤标志物与FR+ CTC进行了对比研究。已知的肺癌相关血清肿瘤标志物筛查肺癌的灵敏度较低,缺乏特异性。本研究结果显示,以LT-PCR检测的FR+ CTC水平对肺结节恶性诊断的阳性预测值高达94.1%,阴性预测值可达70.0%。另外,与CEA、NSE和CYFRA21-1相比,单独用FR+ CTC进行诊断的AUC高于三个肿瘤标志物联合的检测结果,也稍高于FR+ CTC与三个肿瘤标志物联合的诊断结果。Chen等[19]的研究表明,将FR+ CTC与CEA、NSE、CYFRA21-1联合进行肺癌的诊断时,其AUC大于单纯FR+ CTC诊断的AUC。本研究的结果与此不同,但二者的AUC相近,可能因为本研究的研究对象为亚厘米肺结节患者,因而与早期肺癌的肿瘤标志物的表达水平相对较低有关,也可能与本研究的样本量较小有关,需要进一步验证。
综上所述,FR+ CTC检测可作为辅助筛查亚厘米肺结节、诊断早期肺癌的一种新型的有效生物标志物。但此次纳入的病例较少,进行大样本前瞻性研究来验证我们的结论是非常必要的。
所有作者均声明不存在利益冲突



























