
探讨肺肉瘤样癌(PSC)新辅助化疗对患者手术的影响。
回顾性分析南京医科大学附属老年医院收治的1例PSC(cT3NxM0)患者的临床资料、病理特点和治疗方案,并复习相关文献。
该患者接受2个周期新辅助化疗后,肺部原发灶退缩明显,获得手术切除机会,实现R0切除。术后病理分期为ypT1N0M0 ⅠA期。
PSC预后差,手术切除是最重要的治疗模式。早期患者建议采用新辅助化疗联合手术切除,或手术切除联合辅助化疗方式治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺肉瘤样癌(PSC)是一种较少见的癌和肉瘤样形态混合于一个瘤体内的恶性肿瘤,是一类分化差、发病率较低的非小细胞肺癌(NSCLC)。PSC侵袭性强,易复发与转移,对放化疗均不敏感,临床预后差。现报道我院收治的1例PSC新辅助化疗后行R0切除的患者,并复习文献。
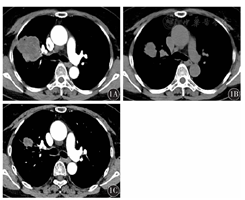
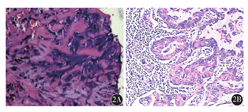
患者,女性,53岁,因右侧胸痛1个月余入我院。患者2017年6月无明显诱因出现右侧胸痛,无发热、咯血,无咳嗽、咳痰。既往体健,无吸烟史,无特殊基础病史。查体:体表面积1.51 m2,体能状态(PS)评分1分。神志清楚,精神尚可,浅表淋巴结未触及明显肿大。气管居中,颈静脉无怒张。双侧胸廓对称,双肺呼吸音清,无干湿性啰音及胸膜摩擦音。心率78次/min,律齐。实验室检查:血常规、癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、细胞角蛋白21-1(CY21-1)、糖类抗原19-9(CA19-9)等均在正常范围;血生化:清蛋白39 g/L,谷氨酰转肽酶98 U/L,葡萄糖6.38 mmol/L,超敏C反应蛋白55.59 mg/L。胸部CT示:右肺上叶肿块,大小为6.4 cm×5.1 cm,考虑肺癌,右肺门及纵隔淋巴结轻度增大(图1)。头颅磁共振检查:右侧额叶及颞叶皮层下缺血灶,两侧上颌窦炎。外院上腹部CT检查示:左肾囊肿。进一步行肺穿刺活组织检查,病理免疫组织化学结果:AE1/AE(+++)、CK7(+/-)、p63(+)、p40(+)、CK5/6(少数+)、TTF-1(-)、NapsinA(-)、Ki-67(40%+)、SMA(-)、Desmin(-)、CD117(-)、CD34(血管+)、Vim(+)、S-100(+/-)。右肺为恶性肿瘤,分化程度差,倾向肉瘤样癌或多形性癌可能(图2)。临床分期cT3NxM0。肺组织基因检测示:表皮生长因子受体(EGFR)突变(第19号外显子);ALK、RET、ROS1、MET、HER2、KRAS、BRAF均未检测到突变;MYC基因扩增,TP53 C135Y突变,VEGFA基因扩增。经我院多学科综合诊疗(MDT)评估后,该患者于2017年7月19日开始接受化疗,方案为紫杉醇脂质体210 mg第1天+顺铂40 mg第1天至第3天,21 d为1个疗程,化疗2个周期。第1个周期化疗后肺部肿块缩小明显(图1B),2个周期化疗后肿块进一步缩小(图1),遂于2017年9月行VATS右上肺叶切除+淋巴结清扫术。术中切除右上肺叶,系统性清扫纵隔、肺门淋巴结。术后病理示:(右上肺)周围型结节型低分化癌(化疗后改变),大小为2.5 cm×2.5 cm×2.0 cm,显示低分化腺癌成分,癌成分占肿块的10%,坏死组织占肿块的90%,胸膜、支气管切缘、神经、脉管无侵犯,淋巴结0/14(图2)。术后病理分期:ypT1N0M0,ⅠA期。术后继续完成原方案2个周期辅助化疗,患者耐受差,终止进一步治疗,定期随访评估。截至2019年2月底,该患者未见复发转移,生命质量良好。


PSC是一组较罕见的NSCLC[1],约占所有肺恶性肿瘤的0.1%~1.3%。该病最早在1980年由Kika等发现,被定义为一类兼有癌及肉瘤样成分的低分化NSCLC(两种成分需各占10%以上),其中上皮成分以鳞状细胞癌多见,其次为腺癌及大细胞癌,小细胞癌罕见[2]。2015年世界卫生组织(WHO)肺肿瘤分类中将其分为5种亚型:多形性癌、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤。PSC细胞低分化,侵袭性强,易复发与转移,化疗不敏感,临床预后差。
PSC多发于男性吸烟者,诊断时平均年龄60岁,病变部位以上叶略多,病灶直径多> 5 cm,且容易侵犯邻近组织器官,如胸膜、胸壁、横膈或纵隔等[3]。临床表现为咳嗽、胸痛、咯血、胸腔积液等,依肿块部位而定。CT作为PSC主要影像学检查手段,无明显特异性,主要表现为中央支气管型和周围侵犯型两大类型。中央支气管型生长较缓慢,以局部侵犯为主;而外周型则易早期广泛转移,预后较差。PET-CT上病灶中位最大标准摄取值约15,但与肿瘤大小、病理类型及分期无明显相关性,且不能提示预后[4]。单纯依靠组织病理学诊断PSC和其亚型准确性欠佳,进一步免疫组织化学分析必须有细胞角蛋白阳性,包括AE1AE3、CAM5.2、CK18、CK7;波形蛋白、CEA和平滑肌标志应为阳性;如果形态学上存在经典癌成分,那么上皮标志阳性并不是必需的。本例患者为女性,相对较年轻,肿块大小及发生部位符合PSC一般特点,但无局部侵犯,最终经肺穿刺活组织检查确诊。
2015年WHO推荐对PSC患者采用组织学标本进行分子学检测,PSC中常见的突变基因为KRAS和TP53,EGFR突变比例存在差异。近年来,Liu等[5]在PSC中发现Met基因改变存在一种独特的高频改变,导致第14号外显子跳跃(exon14Δ),可能存在靶向意义。Fallet等[6]对81例PSC患者组织学标本行检测发现,最常见的突变基因分别是KRAS(27.2%)、EGFR(22.2%)、TP53(22.2%)、STK11(7.4%)、NOTCH1(4.9%)、NRAS(4.9%)以及PI3KCA(4.9%),而32例患者同时存在两种及以上突变基因。Mehrad等[7]对23例PSC患者病理组织检测发现,TP53、KRAS、ATM、EGFR、MET exon14Δ突变比例分别为74.0%、43.4%、17.3%、8.7%和11.1%。另一项对125例PSC患者的分子检测显示:74%患者存在TP53突变,34%存在KRAS突变,其他分子突变情况包括:Met(13.6%)、EGFR(8.8%)、BRAF(7.2%)、HER2(1.6%)、RET(0.8%)以及MET exon14Δ(12%)[8]。此外,研究发现相比普通NSCLC,PSC有着更高的程序性死亡受体配体1(PD-L1)阳性率(25%~69.2%),且PD-L1的表达与N2淋巴结转移、KRAS突变存在相关性[9]。本例患者治疗前常规行组织病理基因检测[未行程序性死亡受体1(PD-1)、PD-L1检测],结果仅存在EGFR突变(第19号外显子),与既往研究报道存在较大差异。
相较于肺腺癌或鳞状细胞癌,PSC预后差。Maneenil等[10]统计了127例PSC患者,其中Ⅰ、Ⅱ、Ⅲ、Ⅳ期患者比例分别为15.9%,20.6%,22.2%和41.3%,结果显示中位生存时间9.9个月,1、2、5年生存率分别为42%、23%和15%。传统放化疗对于PSC的疗效均不理想,手术切除是最重要的治疗模式。早期患者,建议采用新辅助化疗联合手术切除,或手术切除联合辅助化疗方式治疗,传统姑息性化疗疗效不佳。即使部分患者未能达到R0切除,局部放疗也可使其局部复发率下降约15%。Vieira等[11]研究了97例晚期转移性PSC患者,其中73%的患者接受了含铂方案化疗,首次评估时,69%的患者出现疾病进展,31%患者为疾病稳定,16.5%达到部分缓解,生存分析发现含铂化疗方案较非含铂方案存在一定的生存优势,总生存时间延长近2个月。PSC的预后和分期及肿块大小相关。PSC容易转移可能与血管浸润相关,另外c-Met表达与血管浸润的相关性研究提示c-Met可能存在促血管生成作用,90%的PSC存在血管浸润提示抗血管生成可能对此类患者有效[12]。本例患者病灶局限,影像学未见局部侵犯,但肿块最大径> 5 cm,故采取新辅助化疗+手术切除+术后辅助化疗治疗模式,化疗方案选用顺铂联合紫杉醇,兼顾癌及肉瘤成分。该患者肿瘤细胞对化疗药物应答良好,2个周期化疗后肿块明显缩小,成功行R0切除,术后分期yT1cN0M0 ⅠA期,手术标本病理示肿瘤组织大量坏死,未见肉瘤样成分,提示肉瘤组织可能对顺铂+紫杉醇方案敏感,但仍需进行较大样本临床试验进一步证实。术后继续行原方案辅助化疗,但患者仅完成2个周期,自行终止治疗。目前定期随访复查,截至2019年2月底,未见疾病复发进展。预后方面,患者存在大肿块不良因素,但分期早、无局部浸润、年轻、病理无鳞状细胞癌成分,行R0手术切除+新辅助化疗,可能提示该患者预后较好,即使该患者后期出现复发,仍可采用原方案化疗,联合或不联合EGFR-酪氨酸激酶抑制剂或抗血管生成靶向治疗。
所有作者均声明不存在利益冲突



























