
探讨T3、T4期结直肠癌患者淋巴结转移危险因素,为临床诊疗提供参考。
回顾性分析2008年1月至2017年12月在空军军医大学西京消化病医院行结直肠癌根治术的1 112例T3、T4期结直肠癌患者的临床病理资料,分析淋巴结转移状态与临床病理因素及肿瘤标志物的相关性,应用logistic多因素回归法分析淋巴结转移的相关危险因素。
单因素分析结果显示,性别、年龄、肿瘤部位分层的结直肠癌患者间淋巴结转移率差异均无统计学意义(均P>0.05),淋巴结转移率在不同肿瘤长径[<5 cm和≥5 cm分别为37.75%(211/559)、52.26%(289/553),χ2=23.666,P<0.01]、大体类型[浸润、溃疡、蕈伞、隆起分别为37.04%(20/54)、47.52%(432/909)、34.33%(23/67)、69.51%(57/82),χ2=13.787,P=0.003]、分化程度[高、中、低分化分别为34.11%(102/299)、49.00%(317/647)、48.80%(81/166),χ2=19.771,P<0.01]、错配修复缺陷(dMMR)[是和否分别为26.34%(64/243)、50.17%(436/869),χ2=43.996,P<0.01]、神经侵犯[是和否分别为48.17%(421/874)、33.20%(79/238),χ2=16.954,P<0.01]、脉管侵犯[是和否分别为79.16%(338/427)、23.65%(162/685),χ2=327.493,P<0.01]以及术前癌胚抗原(CEA)[阳性(≥5 mg/ml)和阴性(<5 mg/ml)分别为52.87%(249/471)、39.16%(251/641),χ2=20.162,P<0.01]和CA199[阳性(≥35 U/ml)和阴性(<35 U/ml)分别为59.33%(124/209)、41.64%(376/903),χ2=21.465,P<0.01]分层患者间差异均有统计学意义。logistic多因素回归分析显示,脉管侵犯和术前CA199阳性是T3、T4期结直肠癌患者淋巴结转移独立危险因素(OR=13.006,95% CI 9.329~17.276,P<0.01;OR=2.194,95% CI 1.513~3.181,P<0.01),dMMR阳性是淋巴结转移的保护性因素(OR=0.279,95% CI 0.190~0.411,P<0.01)。
脉管侵犯是T3、T4期结直肠癌患者淋巴结转移的主要危险因素。术前肿瘤标志物CA199的检测可以作为预测T3、T4期结直肠癌患者淋巴结转移状态的指标,一定程度上可为诊疗方案的制订提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着我国人民生活方式、饮食习惯及饮食结构的改变,结直肠癌的发病率逐年上升,严重威胁着人们的健康[1,2]。目前,外科手术仍然是结直肠癌治疗的主要手段[3,4]。近年来,随着腔镜技术在临床的广泛应用及开展,结直肠癌疗效有了很大提高[5],但是结直肠癌术后的复发和转移始终是困扰临床一线医生的主要难题[6],其中,淋巴结转移在肿瘤术后复发和转移中作用尤为突出[7,8]。以往有研究发现,肿瘤的浸润深度与结直肠癌患者淋巴结转移密切相关[9]。然而,在临床实践中,我们发现同样浸润深度的T3、T4期结直肠癌患者淋巴结转移的状态并不完全相同,从而导致术后诊疗方案的制订及患者的预后存在一定的差异[10]。目前,传统的影像学检查并不能准确地评估结直肠癌患者术前淋巴结转移状态[11,12],因此,从病理组织学角度分析影响T3、T4期结直肠癌淋巴结转移的风险因素尤为重要。本研究分析T3、T4期结直肠患者淋巴结转移状态与病理组织学和术前肿瘤标志物水平的相关性,明确淋巴结转移风险因素,为临床诊疗提供参考。
回顾性分析2008年1月至2017年12月在空军军医大学西京消化病医院接受手术治疗的1 112例T3、T4期结直肠癌患者的临床资料。纳入标准:术后病理诊断明确,均证实为原发性腺癌;术前未接受放化疗或其他治疗。排除标准:临床病理资料不全者,合并其他肿瘤者。
术后标本立即用10%甲醛溶液固定,手术完毕后行病理检查。病理科取材医师将获得的标本切割成3~5 μm厚的薄片,石蜡包埋,制片,HE染色,由经验丰富的病理科医师进行诊断。最终的诊断结果由至少两位病理科医师确定。其中,错配修复缺陷(dMMR)通过检测错配修复蛋白MLH1、MSH2、MSH6和PMS2的表达情况进行判断,神经侵犯依据S100表达情况判断,脉管侵犯通过检测CD34和D2-40的表达情况来判定。鼠抗人MLH1单克隆抗体(克隆号ES05)、鼠抗人MSH2单克隆抗体(克隆号MX011)、鼠抗人MSH6单克隆抗体(克隆号MX056)、兔抗人PMS2单克隆抗体(克隆号EP51)、鼠抗人S100单克隆抗体(克隆号4C4.9)、鼠抗人CD34单克隆抗体(克隆号QBEnd/10)、鼠抗人D2-40单克隆抗体(克隆号SN3b)均购自福州迈新生物技术开发有限公司。以上蛋白检测均采用免疫组织化学EnVision法,检测程序按试剂盒说明书进行。蛋白阳性的判断参照试剂盒说明书中的阳性判断标准。
受检者在检测前保持空腹,采集清晨静脉血5 ml,将采集的血液放置到试管中进行离心处理,采用微粒子化学发光免疫检测仪及配套试剂进行检测。按照空军军医大学西京消化病医院标准判断血清肿瘤标志物是否阳性:癌胚抗原(CEA)≥5 mg/ml为阳性,CA199≥35 U/ml为阳性。
用SPSS 18.0软件进行统计学分析。计数资料比较应用χ2检验;用logistic多因素回归法分析淋巴结转移风险因素。以P<0.05为差异有统计学意义。
在不同性别、年龄、肿瘤部位结直肠癌患者间淋巴结转移率差异均无统计学意义(均P>0.05),不同肿瘤长径、大体类型、分化程度、dMMR、神经侵犯和脉管侵犯以及术前CEA和CA199水平间淋巴结转移率差异均有统计学意义(均P<0.05)(表1)。
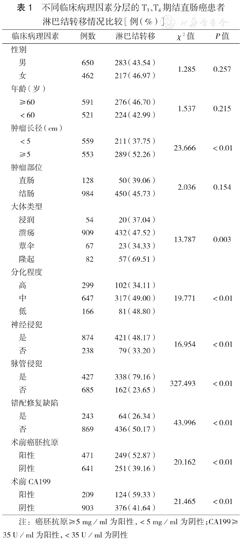
不同临床病理因素分层的T3、T4期结直肠癌患者淋巴结转移情况比较[例(%)]
不同临床病理因素分层的T3、T4期结直肠癌患者淋巴结转移情况比较[例(%)]
| 临床病理因素 | 例数 | 淋巴结转移 | χ2值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 650 | 283(43.54) | 1.285 | 0.257 | |
| 女 | 462 | 217(46.97) | |||
| 年龄(岁) | |||||
| ≥60 | 591 | 276(46.70) | 1.537 | 0.215 | |
| <60 | 521 | 224(42.99) | |||
| 肿瘤长径(cm) | |||||
| <5 | 559 | 211(37.75) | 23.666 | <0.01 | |
| ≥5 | 553 | 289(52.26) | |||
| 肿瘤部位 | |||||
| 直肠 | 128 | 50(39.06) | 2.036 | 0.154 | |
| 结肠 | 984 | 450(45.73) | |||
| 大体类型 | |||||
| 浸润 | 54 | 20(37.04) | 13.787 | 0.003 | |
| 溃疡 | 909 | 432(47.52) | |||
| 蕈伞 | 67 | 23(34.33) | |||
| 隆起 | 82 | 57(69.51) | |||
| 分化程度 | |||||
| 高 | 299 | 102(34.11) | 19.771 | <0.01 | |
| 中 | 647 | 317(49.00) | |||
| 低 | 166 | 81(48.80) | |||
| 神经侵犯 | |||||
| 是 | 874 | 421(48.17) | 16.954 | <0.01 | |
| 否 | 238 | 79(33.20) | |||
| 脉管侵犯 | |||||
| 是 | 427 | 338(79.16) | 327.493 | <0.01 | |
| 否 | 685 | 162(23.65) | |||
| 错配修复缺陷 | |||||
| 是 | 243 | 64(26.34) | 43.996 | <0.01 | |
| 否 | 869 | 436(50.17) | |||
| 术前癌胚抗原 | |||||
| 阳性 | 471 | 249(52.87) | 20.162 | <0.01 | |
| 阴性 | 641 | 251(39.16) | |||
| 术前CA199 | |||||
| 阳性 | 209 | 124(59.33) | 21.465 | <0.01 | |
| 阴性 | 903 | 376(41.64) | |||
注:癌胚抗原≥5 mg/ml为阳性,<5 mg/ml为阴性;CA199≥ 35 U/ml为阳性,<35 U/ml为阴性
经logistic多因素回归分析,脉管侵犯和术前CA199阳性是T3、T4期结直肠癌患者淋巴结转移的危险因素,dMMR是淋巴结转移的保护性因素(均P<0.01)(表2)。
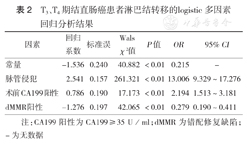
T3、T4期结直肠癌患者淋巴结转移的logistic多因素回归分析结果
T3、T4期结直肠癌患者淋巴结转移的logistic多因素回归分析结果
| 因素 | 回归系数 | 标准误 | Wals χ2值 | P值 | OR | 95% CI |
|---|---|---|---|---|---|---|
| 常量 | -1.536 | 0.240 | 40.882 | <0.01 | 0.215 | - |
| 脉管侵犯 | 2.541 | 0.157 | 261.321 | <0.01 | 13.006 | 9.329~17.276 |
| 术前CA199阳性 | 0.786 | 0.190 | 17.173 | <0.01 | 2.194 | 1.513~3.181 |
| dMMR阳性 | -1.276 | 0.197 | 42.065 | <0.01 | 0.279 | 0.190~0.411 |
注:CA199阳性为CA199≥35 U/ml;dMMR为错配修复缺陷;-为无数据
目前,外科手术仍然是结直肠癌最主要的治疗手段。与此同时,随着循证医学的发展,为结直肠癌患者制订更加精确、合理的个体化治疗方案就显得极其重要。当前,基于肿瘤浸润深度、淋巴结转移和远处转移的TNM分期为结直肠癌患者诊疗方案的制订提供了重要的参考。许多研究已经证实,淋巴结的转移不仅是肿瘤术后复发、转移的主要危险因素,而且与患者的预后密切相关[7,8,13]。因此,准确的N分期判定成为结直肠癌术后放化疗方案制订的重要参考[14,15]。以往研究发现,肿瘤浸润深度是影响结直肠癌患者淋巴结转移的主要风险因素[9]。主要因为结直肠黏膜层无淋巴管,而黏膜下淋巴管道非常丰富,当肿瘤浸润深度达黏膜下层时,肿瘤与淋巴管的接触概率会变大,从而导致淋巴结转移的可能性也会增大[16]。然而,在临床实践中,我们往往发现同样浸润深度的T3、T4期肿瘤的淋巴结状态也不相同。本研究结果显示,在T3、T4期结直肠癌中,不同肿瘤直径、大体类型、分化程度、dMMR以及有无神经侵犯和脉管侵犯与淋巴结转移状态有关,logistic多因素回归分析显示脉管侵犯和术前肿瘤标志物CA199阳性是影响T3、T4期结直肠癌淋巴结转移的危险因素,而dMMR是影响淋巴结转移状态的保护性因素。
脉管系统包括心血管系统和淋巴系统,是一套分布于全身各处的封闭管道。脉管侵犯指癌细胞侵袭心血管系统和淋巴管系统,是恶性肿瘤常见的生物学行为之一,最早在直肠癌患者中被发现并提出[17]。后来有学者发现,脉管侵犯不仅与结直肠癌的复发和远处转移相关,还与结直肠癌患者的预后密切相关[18,19,20]。在2011年版的美国国立综合癌症网络(NCCN)结直肠癌临床实践指南中,要求将脉管侵犯作为病理报告的必要内容。本研究结果发现,在T3、T4期结直肠癌中,脉管侵犯是影响淋巴结转移的主要危险因素。当肿瘤浸润深度突破黏膜层时,肿瘤周边密布着丰富的毛细淋巴管和微血管,管腔之间距离较大且连接不紧密。当微血管或毛细淋巴管外压力高于管内压力时,脱落的癌细胞可随着压力进入淋巴管,运输至淋巴结,形成区域淋巴结内转移,进而形成广泛的淋巴结转移。因此有学者认为,脉管侵犯是结直肠癌早期淋巴结转移的重要标志[21]。
目前,术前对结直肠癌患者疾病状态的评估仍然依赖传统的影像学检查、内镜检查和血清学检查。血清肿瘤标志物因价格实惠、操作简单等独特的优势被广泛应用于临床。CA199为人类结肠癌细胞株SW1116产生的单克隆抗体,存在于细胞表面,在信息传递、分化和生化中具有重要作用。有研究发现,CA199不仅与肿瘤的复发和转移有关,更是判断结直肠癌患者预后的强有力预测因子[22,23,24,25]。本研究发现,术前血清肿瘤标志物CA199是T3、T4期结直肠癌淋巴结转移的主要危险因素之一,与T3、T4期结直肠癌淋巴结转移密切相关。
总之,我们发现脉管侵犯是影响T3、T4期结直肠癌患者淋巴结转移状态的主要危险因素。与此同时,术前肿瘤标志物CA199的检测可以帮助临床医生对T3、T4期结直肠癌患者的淋巴结状态进行有效的判断,进而制订更加合理、精确的治疗方案,服务于临床。
所有作者均声明不存在利益冲突



























