
探讨四肢脂肪肉瘤患者的临床病理特征、诊断及鉴别诊断。
选取2002年3月至2019年12月首都医科大学附属北京天坛医院收治的非典型脂肪瘤性肿瘤/高分化脂肪肉瘤(ALT/WDL)、去分化脂肪肉瘤(DDL)、黏液样脂肪肉瘤(ML)患者共14例,采用荧光原位杂交(FISH)和免疫组织化学染色法检测肿瘤组织中MDM2基因扩增和S-100、CDK4、MDM2蛋白表达,结合临床资料和病理组织学特点综合分析不同类型脂肪肉瘤的特点。
14例患者年龄(55.6±16.7)岁,男性10例,女性4例。ALT/WDL为2例,DDL为6例,ML为6例。免疫组织化学结果显示,所有患者S-100均有表达,包括散在阳性、部分阳性及广泛阳性;CDK4、MDM2在ALT/WDL和DDL中均有表达,在ML中弱表达(4例);所有患者Vimentin均表达。2例ALT/WDL和6例DDL均检测到MDM2基因扩增。
脂肪肉瘤发病率高,具有明显的形态多样性,准确的病理诊断是判断肿瘤预后和治疗的关键。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脂肪肉瘤是一种常见的具有脂肪细胞分化的软组织肉瘤,约占所有成年人肉瘤的20%[1]。脂肪肉瘤常发生于下肢深部软组织和腹膜后,分别占四肢肉瘤和腹膜后软组织肉瘤的24%和45%[2]。它由不同分化程度和不同异型程度的脂肪细胞组成,具有明显的形态多样性。我们对14例四肢脂肪肉瘤的临床病理特征进行了回顾性分析,总结脂肪肉瘤的临床特点、组织形态学特点、免疫表型及分子遗传学特点,旨在加深对不同类型脂肪肉瘤的认识,减少漏诊和误诊。
收集2002年3月至2019年12月我科确诊的14例四肢脂肪肉瘤患者的临床资料、病理组织学特点、免疫表型及MDM2基因扩增情况。依据2013年世界卫生组织(WHO)骨和软组织肿瘤分类[3],复阅所有患者切片,补充免疫组织化学指标及分子遗传学指标,由2名病理专业副主任医师复核诊断。本研究符合2013年修订的《赫尔辛基宣言》相关要求,所有患者均签署知情同意书。
组织标本经10%中性甲醛溶液固定,常规脱水、石蜡包埋,切片厚3~4 μm,HE染色。免疫组织化学染色采用EnVision二步法,一抗包括S-100、CD34、desmin、Vimentin、p16、h-caldesmon、HMB45、Melan-A、CDK4、MDM2、STAT6、Ki-67等,均购自北京中杉金桥公司。根据抗体说明书及实验室规范进行操作,常规设立阳性和阴性对照。结果判读:无阳性染色定义为阴性,阳性染色细胞比例≤50%定义为局部阳性,阳性染色细胞比例>50%定义为弥漫阳性。
MDM2探针及FISH试剂盒为美国雅培公司产品,操作步骤按照试剂盒说明书进行。荧光显微镜下观察,随机计数200个肿瘤细胞的细胞核荧光信号,MDM2扩增阳性定义为肿瘤细胞核内可见≥3个橘红色荧光信号。
本组14例患者中,男性10例,女性4例;年龄(55.6±16.7)岁,年龄范围32~80岁。肿瘤发生于上肢2例,下肢12例。组织学类型:非典型脂肪瘤性肿瘤/高分化脂肪肉瘤(ALT/WDL)2例,男女各1例,分别为38岁及32岁,分别发生在下肢近膝部和上肢;去分化脂肪肉瘤(DDL)6例,包括男性4例,女性2例,年龄(70.8±9.4)岁,年龄范围53~80岁,下肢5例(大腿3例,膝部2例),上肢前臂1例;黏液样脂肪肉瘤(ML)6例,男性5例,女性1例,年龄(47.2±7.2)岁,年龄范围40~61岁,均发生于下肢,大腿5例,小腿1例(表1)。
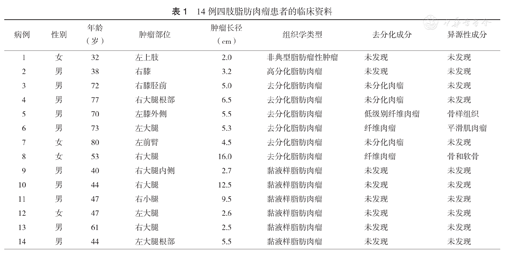
14例四肢脂肪肉瘤患者的临床资料
14例四肢脂肪肉瘤患者的临床资料
| 病例 | 性别 | 年龄(岁) | 肿瘤部位 | 肿瘤长径(cm) | 组织学类型 | 去分化成分 | 异源性成分 |
|---|---|---|---|---|---|---|---|
| 1 | 女 | 32 | 左上肢 | 2.0 | 非典型脂肪瘤性肿瘤 | 未发现 | 未发现 |
| 2 | 男 | 38 | 右膝 | 3.2 | 高分化脂肪肉瘤 | 未发现 | 未发现 |
| 3 | 男 | 72 | 右膝胫前 | 5.0 | 去分化脂肪肉瘤 | 未分化肉瘤 | 未发现 |
| 4 | 男 | 77 | 右大腿根部 | 6.5 | 去分化脂肪肉瘤 | 未分化肉瘤 | 未发现 |
| 5 | 男 | 70 | 左膝外侧 | 5.5 | 去分化脂肪肉瘤 | 低级别纤维肉瘤 | 骨样组织 |
| 6 | 男 | 73 | 左大腿 | 5.3 | 去分化脂肪肉瘤 | 纤维肉瘤 | 平滑肌肉瘤 |
| 7 | 女 | 80 | 左前臂 | 4.5 | 去分化脂肪肉瘤 | 未分化肉瘤 | 未发现 |
| 8 | 女 | 53 | 右大腿 | 16.0 | 去分化脂肪肉瘤 | 纤维肉瘤 | 骨和软骨 |
| 9 | 男 | 40 | 右大腿内侧 | 2.7 | 黏液样脂肪肉瘤 | 未发现 | 未发现 |
| 10 | 男 | 44 | 右大腿 | 12.5 | 黏液样脂肪肉瘤 | 未发现 | 未发现 |
| 11 | 男 | 47 | 右小腿 | 9.5 | 黏液样脂肪肉瘤 | 未发现 | 未发现 |
| 12 | 女 | 47 | 左大腿 | 2.6 | 黏液样脂肪肉瘤 | 未发现 | 未发现 |
| 13 | 男 | 61 | 右大腿 | 2.5 | 黏液样脂肪肉瘤 | 未发现 | 未发现 |
| 14 | 男 | 44 | 左大腿根部 | 5.5 | 黏液样脂肪肉瘤 | 未发现 | 未发现 |
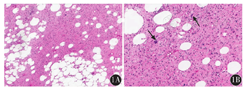
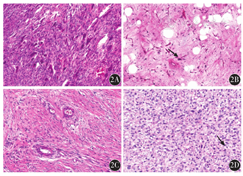
大体标本:肿瘤位于深部软组织,呈结节状及分叶状,切面呈淡黄色、灰黄色、灰白灰黄色或灰白色;质地软或中等、细腻;部分区域实性、富含黏液或胶冻样。例8患者肿瘤为双结节,在最大径约16 cm的大结节边缘内侧可见一个最大径约5 cm圆形骨样结节。无包膜者11例,有部分包膜者2例,有完整包膜者1例。2例ALT/WDL(图1,例1、2)呈脂肪瘤样脂肪肉瘤形态,由相对成熟的脂肪组织构成,脂肪细胞大小不等,核有异型性,可见脂母细胞,呈空泡状或多泡状,脂肪细胞间为厚薄不一的纤维组织间隔,其内可见散在的异型间质细胞及多核瘤细胞。6例DDL(图2,例3~8)由分化好的脂肪肉瘤成分及去分化成分组成,二者的过渡形式有3种:分界清楚,过渡突然(4例);逐渐过渡(1例);交错分布,呈马赛克样去分化(1例)。4例可见高级别去分化成分,1例既有高级别也有低级别去分化成分,1例可见低级别去分化成分。高级别成分中3例呈未分化肉瘤形态,表现为肿瘤细胞异型性及多形性明显,瘤巨细胞散在分布其中,病理性核分裂象易见。可见坏死及黏液变性。2例为高级别梭形细胞肉瘤形态,表现为瘤细胞呈梭形,密度较高,类似于纤维肉瘤。可见异源性分化,包括骨肉瘤(2例)及平滑肌肉瘤(1例)成分。低级别成分呈低级别纤维肉瘤形态,表现为以纤维母细胞样细胞为主,密度相对较低,间质较丰富,核轻或中度异型。6例ML(图3,例9~14)低倍镜下呈分叶状生长,肿瘤由圆形细胞、卵圆形细胞、星形细胞、短梭形细胞、处于不同分化阶段的不成熟脂肪细胞、大小不等的印戒样脂母细胞、纤细的丛状或枝芽状毛细血管网及黏液样基质组成。高倍镜下,4例瘤细胞形态以星形、短梭形为主,2例以圆形、卵圆形为主,形态较一致,细胞异型性明显,核分裂象易见。


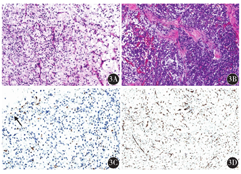

免疫组织化学结果示,所有患者S-100均有表达(图3),包括散在阳性、部分阳性及广泛阳性;CDK4、MDM2在ALT/WDL和DDL中均表达,在ML中弱表达(4例);所有患者Vimentin均有表达。p16在DDL中表达,h-caldesmon、desmin在异源性平滑肌肉瘤中表达,HMB45、CD34、STAT6、Melan-A等标志物均不表达,以排除其他软组织肿瘤。Ki-67表达:ALT(例1)<1%,WDL(例2)约3%;DDL例5 10%,例6 15%,其余为25%~40%;ML瘤细胞以星形、短梭形为主,偶+或<1%;以圆形、卵圆形为主(例11及例13),约60%。
2例ALT/WDL和6例DDL均进行了MDM2基因检测,均检测到MDM2基因扩增。
脂肪肉瘤可能来源于未分化间叶细胞[4],好发于中老年人,发病高峰年龄50~70岁,发生部位广泛,以男性多见,发生于腹膜后者以女性略多见,临床上大多表现为深部无痛性肿块。2013年版WHO骨和软组织肿瘤分类中,脂肪肉瘤分为ALT/WDL、DDL、ML、多形性脂肪肉瘤(PL)、脂肪肉瘤非特殊类型(混合型脂肪肉瘤)5个类型[3]。本组病例中观察到3个类型,分别为ALT/WDL(2例)、DDL(6例)、ML(6例)。
ALT/WDL是脂肪肉瘤中最常见类型,占脂肪肉瘤的40%~45%[5],患者常较年轻,容易漏诊。肿瘤发生部位广泛,好发于大腿,其次是腹膜后和睾丸旁,亦可发生于腹股沟、精索、纵隔、胸腔、头颈部(如喉、气管)、内脏器官(如胃、阑尾)、背部等[6]。表现为深部软组织内缓慢生长的无痛性结节或肿块。ALT/WDL包括4种亚型,(1)脂肪瘤样脂肪肉瘤:由相对成熟的脂肪组织构成,脂肪细胞大小不等,可见脂母细胞,纤维间隔厚薄不一,散在其中的核深染细胞常为间质细胞及数量不等的单泡或多泡脂肪母细胞。(2)硬化性脂肪肉瘤:在胶原纤维化背景中有奇异形核深染的间质细胞,常常仅有少量或无脂母细胞。(3)炎症性脂肪肉瘤:在(1)或(2)的类型特点中加上淋巴细胞和浆细胞浸润,对于此种亚型最重要的是不要误诊为炎症,要特别注意发病部位、大小不等的脂肪细胞及散在核深染的间质细胞。(4)梭形细胞脂肪肉瘤:纤维性和(或)黏液样背景中有纤维母细胞样细胞增生,并有脂肪瘤样脂肪肉瘤成分,梭形细胞无明显异型性。上述4种亚型也可并存。普遍认为脂母细胞是脂肪肉瘤的诊断要点,实际上不是所有脂肪肉瘤均有脂母细胞,例如硬化性脂肪肉瘤可无脂母细胞。同时,仅有脂母细胞亦不能诊断脂肪肉瘤(如脂肪母细胞瘤)。本组14例患者中仅2例为ALT/WDL,可能与本组病例数较少有关,也可能因为本研究为回顾性研究,过去工作中漏诊了部分病例,漏诊原因包括肿瘤异型性不大、缺乏FISH检测。
DDL约占脂肪肉瘤的18%,包括ALT/WDL向非脂肪源性的肉瘤成分转化,或偶尔向同源性的多形性脂肪肉瘤转化[7]。发病高峰年龄70岁,无性别倾向性[8],常为无痛性肿块。约90%的DDL为原发,10%为ALT/WDL多次复发后发生的去分化,任何部位的ALT/WDL均可发生去分化[9]。大多数(>75%)DDL位于腹膜后和盆腔软组织间隙内,其他部位包括肢体、精索/附睾区、胸腔、纵隔和头颈部(如喉、食管)等[10]。DDL瘤体通常较大,肿瘤直径最大可达60 cm,最小为2.5 cm[11],镜下为ALT/WDL区及去分化区,二者比例不定,去分化区不足1 cm时,称为微小去分化[12]。去分化成分与分化好的脂肪肉瘤成分的过渡形式有3种:(1)分界清楚,过渡突然;(2)逐渐过渡;(3)交错分布,呈马赛克样去分化。本组病例中3种形式均存在。去分化成分可表现为高级别去分化(90%)和低级别去分化(10%)。高级别去分化成分表现为高级别肉瘤形态,核分裂象>5个/10 HPF,但比相似的肉瘤少[13],最常见的是多形性未分化肉瘤样,以及高级别梭形细胞肉瘤(类似于纤维肉瘤)、高级别圆细胞肉瘤(类似于骨外尤文肉瘤或差分化滑膜肉瘤)、上皮样结构(类似于黑色素瘤、转移癌及间变性淋巴瘤等)[14]。低级别去分化成分表现为类似于低度恶性纤维黏液样肉瘤、纤维瘤病、低级别纤维肉瘤、炎症性肌纤维母细胞瘤以及孤立性纤维性肿瘤样等,核分裂象<5个/10 HPF。一个少见但有高度提示DDL作用的形态:围绕小血管的梭形细胞旋涡状结构,似脑膜瘤样结构,细胞似脑膜上皮细胞,但表达SMA。25%的病例高级别与低级别共存[11]。5%~10%的DDL发生异源性分化如骨、软骨、肌样分化(横纹肌、平滑肌),及少见的血管肉瘤样分化等[15]。需要与相似的去分化成分、异源性分化、同源性分化鉴别,如恶性外周神经鞘瘤、未分化肉瘤等。异源性分化如骨肉瘤、横纹肌肉瘤等。伴有同源性去分化时要与多形性脂肪肉瘤鉴别。所有需要与之鉴别的病变中,均缺少WDL区域,FISH检测缺少MDM2扩增,同时需要考虑患者年龄、发病部位及影像学表现[16]。
ALT/WDL、DDL均不同程度表达S-100、CDK4、MDM2、p16蛋白。Binh等[17]发现部分恶性间叶性肿瘤如多形性未分化肉瘤、平滑肌肉瘤等,MDM2蛋白也可表达,但这些肿瘤未发现MDM2基因扩增。诊断时4种免疫表型应联合使用,可提高诊断的特异性[18]。
ML是脂肪肉瘤第二大类型,仅次于ALT/WDL,占30%~35%。好发于下肢深部软组织,还可见于上肢、臀部、腹部及腹膜后。常为肢体深部无痛性肿块。发病高峰年龄段为30~50岁。ML镜下有4个特点:以圆细胞为主,黏液样基质,弥漫纤细的丛状或枝芽状毛细血管网,可见印戒样脂母细胞。圆细胞在肿瘤中所占比例越高,预后越差[19]。MDM2、CDK4在ML中表达率较低,S-100部分阳性,与本组病例表达一致。遗传学特征为95%的患者存在特异性FUS-DDIT3(也称TLS-CHOP)融合基因[20],5%的患者存在EWSR1-DDIT3融合基因[21]。
脂肪肉瘤的预后主要取决于肿瘤病理类型和手术切除的完整性[22]。肿瘤位置是影响患者无进展生存的独立因素,四肢脂肪肉瘤易完整切除而腹膜后脂肪肉瘤切缘的评价难度较大,准确性低。因此腹膜后脂肪肉瘤患者复发转移风险是四肢脂肪肉瘤患者的6.6倍[23]。完整手术切除仍是目前首选的治疗方式。
特别需要注意的是高分化脂肪肉瘤,虽然名称为脂肪肉瘤,但是WHO软组织肿瘤分类中将其归为具有局部侵袭性的中间恶性肿瘤,完整切除后密切随诊即可,不必过度治疗。
所有作者均声明不存在利益冲突



























