
探讨盐酸安罗替尼治疗晚期恶性肿瘤的安全性及有效性。
回顾性分析2018年7月至2019年7月山西白求恩医院收治的65例经二线治疗失败的晚期恶性肿瘤患者临床资料,其中非小细胞肺癌32例,小细胞肺癌12例,卵巢癌15例,腹膜癌6例,分析其客观总缓解率(ORR)、疾病控制率(DCR)、无进展生存(PFS)时间及相关不良反应。
非小细胞肺癌ORR为43.7%(14/32),DCR为68.8%(22/32);小细胞肺癌ORR为8.3%(1/12),DCR为25.0%(3/12);卵巢癌ORR为33.3%(5/15),DCR为73.3%(11/15);腹膜癌ORR为0(0/6),DCR为33.3%(2/6)。非小细胞肺癌中位PFS时间8.0个月(95% CI 6.2~9.8个月),小细胞肺癌中位PFS时间3.0个月(95% CI 1.9~4.1个月),卵巢癌中位PFS时间5.0个月(95% CI 3.1~6.9个月),腹膜癌中位PFS时间2.0个月(95% CI 0.0~5.6个月)。药物相关非血液学不良事件中,高血压最为常见,Ⅰ~Ⅱ级6例(9.2%),Ⅲ~Ⅳ级1例(1.5%);药物相关血液学不良事件中,血小板减少最为常见,Ⅰ~Ⅱ级8例(12.3%),Ⅲ~Ⅳ级1例(1.5%),所有患者未出现不能耐受的不良反应。
盐酸安罗替尼治疗晚期恶性肿瘤,药物相关不良反应小、疗效确切,是晚期恶性肿瘤治疗的选择之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2018年全球恶性肿瘤患者新增1 819万例,死亡960万例,而我国多数恶性肿瘤患者发现时即为晚期,肿瘤负荷重,病情进展迅速,二线以上治疗收效甚微[1,2]。恶性肿瘤细胞增殖过程中需要建立新生血管来提供能量,而血管内皮生长因子及其受体介导的细胞信号转导参与并调控肿瘤新生血管生成[3,4]。盐酸安罗替尼是由我国自主研发的于2018年上市的新型小分子多靶点酪氨酸激酶抑制剂,获批用于晚期非小细胞肺癌治疗,临床研究显示对小细胞肺癌、软组织肉瘤、甲状腺髓样癌等有良好的疗效,其通过抑制血管内皮生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)、c-kit等激酶,控制肿瘤生长并作用于VEGFR抑制肿瘤新生血管生成,发挥抗肿瘤作用[5,6,7,8]。本研究回顾性分析盐酸安罗替尼治疗晚期恶性肿瘤的安全性及有效性,为临床二线以上个体化治疗提供参考。
对2018年7月至2019年7月就诊于山西白求恩医院肿瘤中心65例晚期恶性肿瘤患者的临床资料进行回顾性分析。纳入标准:美国东部肿瘤协作组(ECOG)评分≤3分;均经病理确诊;CT或磁共振成像客观影像学检查可测量病灶;血常规、凝血及肝肾功能正常;预计生存期>3个月。排除标准:有咯血、呕血、便血的患者;高血压、蛋白尿不可控患者;有其他不可控因素或拒绝接受治疗患者。65例患者中,男性38例,女性27例;年龄范围35~76岁,年龄(58±12)岁;ECOG评分0~1分52例,2~3分13例;非小细胞肺癌Ⅳ期32例,小细胞肺癌广泛期12例,卵巢癌Ⅳ期15例,腹膜癌Ⅳ期6例。所有患者在用药前均知情同意并签署知情同意书。
对于ECOG评分为0~3分或年龄<75岁患者,盐酸安罗替尼起始剂量均为12 mg,每日1次,服用2周停服1周,当患者出现Ⅲ~Ⅳ级重度高血压、手足综合征、蛋白尿、血液学不良反应或合并感染等且患者无法耐受时,盐酸安罗替尼剂量降至10 mg。所有患者均每3周定期复查血常规、尿常规及肝肾功能,患者出现疾病进展(PD)或不能耐受的不良反应时,停止用药,每21 d为1个周期,治疗1个周期即可评价疗效及不良反应;所有患者均为晚期恶性肿瘤二线以上治疗,其中联合化疗者6例(均为卵巢癌患者,联合化疗方案为紫杉醇联合卡铂)。患者合并疾病包括高血压、冠心病、糖尿病、静脉血栓形成、前列腺增生等,均口服相关药物,病情稳定。
采用实体瘤的疗效评价标准(RECIST)1.1版每3周评价客观疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和PD,以CR+PR计算客观总缓解率(ORR),以CR+PR+SD计算疾病控制率(DCR)。无进展生存(PFS)时间为从患者用药至病情进展或疾病导致患者死亡或末次随访的时间。
所有患者均按照美国国立癌症研究所常见不良反应(NCI CTCAE)5.0分级标准评价药物的安全性。观察患者在治疗期间发生的药物不良反应(ADR),并记录相关临床表现、发生及持续时间、严重程度、处理方法。
末次随访截至2019年10月30日,随访时间3~12个月。主要采用电话或门诊随访,内容包括PD或患者死亡时间。截至随访结束,随访结局为其他原因死亡、中途失访的病例视为删失病例。
采用SPSS 19.0软件进行统计学分析。生存分析采用Kaplan-Meier法,行log-rank检验。以P<0.05为差异有统计学意义。
非小细胞肺癌、小细胞肺癌、卵巢癌、腹膜癌患者中,均无CR患者,各组ORR、DCR见表1。
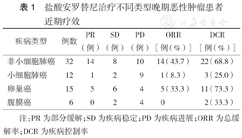
盐酸安罗替尼治疗不同类型晚期恶性肿瘤患者近期疗效
盐酸安罗替尼治疗不同类型晚期恶性肿瘤患者近期疗效
| 疾病类型 | 例数 | PR(例) | SD(例) | PD(例) | ORR[例(%)] | DCR[例(%)] |
|---|---|---|---|---|---|---|
| 非小细胞肺癌 | 32 | 14 | 8 | 10 | 14(43.7) | 22(68.8) |
| 小细胞肺癌 | 12 | 1 | 2 | 9 | 1(8.3) | 3(25.0) |
| 卵巢癌 | 15 | 5 | 6 | 4 | 5(33.3) | 11(73.3) |
| 腹膜癌 | 6 | 0 | 2 | 4 | 0 | 2(33.3) |
注:PR为部分缓解;SD为疾病稳定;PD为疾病进展;ORR为总缓解率;DCR为疾病控制率
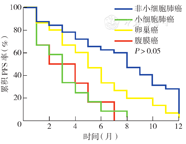
截至随访结束,失访2例,PD 52例,SD继续服用盐酸安罗替尼11例。中位PFS时间:非小细胞肺癌8.0个月(95% CI 6.2~9.8个月),小细胞肺癌3.0个月(95% CI 1.9~4.1个月),卵巢癌5.0个月(95% CI 3.1~6.9个月),腹膜癌2.0个月(95% CI 0.0~5.6个月)(图1)。

65例患者中发生ADR 52例(80.0%),其中≥Ⅲ级ADR发生率为4.6%(3/65)。Ⅰ~Ⅱ级非血液学ADR:高血压(6例,9.2%)、窦性心动过速(2例,3.0%)、手足反应(5例,7.7%)、皮疹(3例,4.6%)、蛋白尿(2例,3.0%)、恶心呕吐(5例,7.7%)、乏力及食欲减退(2例,3.0%)、腹泻(4例,6.2%)、口腔黏膜炎(1例,1.5%)、咯血(2例,3.0%)、转氨酶升高(1例,1.5%);Ⅲ~Ⅳ级非血液学ADR:高血压(1例,1.5%)、腹泻(1例,1.5%)。Ⅰ~Ⅱ级血液学ADR:白细胞减少(5例,7.7%)、血红蛋白下降(3例,4.6%)和血小板减少(8例,12.3%);Ⅲ~Ⅳ级血液学ADR:血小板减少(1例,1.5%)。上述ADR经对症处理后均好转,1例患者治疗期间因合并肺部真菌感染而将盐酸安罗替尼剂量由12 mg/d降至10 mg/d,其余患者均未调整药物剂量。
晚期恶性肿瘤患者因普遍体能评分较低、多线治疗后体质差、存在化疗药物耐受等问题,给临床治疗带来挑战。近年来随着肿瘤分子基因检测技术的发展,肿瘤靶向治疗以其低毒、精准等优势一直是肿瘤治疗领域的热点。安罗替尼作为一种新型小分子多靶点酪氨酸激酶抑制剂,通过抑制与肿瘤发生、侵袭、迁移和复发过程密切相关的干细胞因子受体c-kit达到抑制肿瘤生长的作用,同时其通过调控VEGFR、PDGFR、FGFR等因子,抑制肿瘤新生血管的形成、切断肿瘤血液供应,达到控制肿瘤的目的。近年来索拉菲尼、阿帕替尼、舒尼替尼等小分子靶向药物在软组织肉瘤、食管癌、肺癌、甲状腺癌、胃癌、肠癌、恶性黑色素瘤等多种疾病的临床应用和研究中也取得较大进展[9,10];盐酸安罗替尼在卵巢癌、软组织肉瘤上获得美国罕用药认定,为临床治疗提供了可靠的依据。
本研究回顾性分析安罗替尼在临床中的应用情况,结果提示其在非小细胞肺癌、卵巢癌二线以上治疗中表现出良好的疗效,且严重ADR发生率低,安全性高,ADR总发生率为80.0%,总体低于Ⅲ期临床试验报道的97.28%(根据安罗替尼生产企业提供的数据),≥Ⅲ级的ADR总体发生率为4.6%,低于安罗替尼Ⅲ期临床试验报道的15.31%[11,12]。本研究中,非小细胞肺癌组中位PFS时间7.6个月、DCR为68.8%,尤其卵巢癌联合化疗或单药二线以上治疗时,中位PFS时间5.6个月,DCR为73.3%,均较传统二线以上治疗显示出良好的疗效,为晚期卵巢癌安罗替尼联合化疗和维持治疗提供了思路。晚期小细胞肺癌组和腹膜癌组二线以上化疗有效率低,本研究安罗替尼治疗中DCR分别为25.5%和33.3%,但在个别患者中显示出良好的疗效,仍需要大样本研究来证实其疗效。
本研究通过对ADR观察提示,安罗替尼治疗中发生高血压、血小板减少及消化道反应较为常见,但ADR反应大多为Ⅰ~Ⅱ级,对症处理后可缓解,与安罗替尼Ⅲ期临床研究结果相符[11,12];治疗中未出现咯血、呕血等严重不良反应,仅在非小细胞肺癌患者中出现2例少量痰中带血;有1例患者治疗期间因合并肺部真菌感染而降低剂量,其余均未调整药物治疗剂量,患者耐受性好,安全性高。
综上所述,安罗替尼为晚期肿瘤患者带来了良好的临床获益,口服用药易于长期接受治疗,可明显缩短住院时间、提高了患者生命质量,但选择适应证及优势人群仍需进一步探索。因本研究为回顾性研究,存在一定局限性,适应证外的病种更需要进行大样本、前瞻性、随机对照临床研究来佐证。
所有作者均声明不存在利益冲突



























