
近年来,程序性死亡受体1(PD-1)/程序性死亡受体配体1(PD-L1)抑制剂在免疫治疗方面取得了一定疗效,但对提高患者远期生存作用方面仍有限,肿瘤免疫治疗的有效性一方面取决于正向作用的自身免疫系统对肿瘤高效的识别和特异性免疫,另一方面取决于负向作用的肿瘤免疫逃逸。吲哚胺-2, 3-双加氧酶-1 (IDO1)作为色氨酸代谢途径中重要的限速酶,其高表达可以发挥免疫逃逸及抑制作用,有望为免疫治疗提供新的靶点和途径,文章对IDO1在恶性肿瘤中的研究现状和进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
虽然肿瘤的治疗方法进展迅速,但晚期肿瘤的疗效仍不佳[1]。近年来以程序性死亡受体1(PD-1)/程序性死亡受体配体1(PD-L1)抑制剂为代表的免疫治疗因机制独特、疗效显著,开创了晚期肿瘤治疗的新模式[2]。但PD-1/PD-L1抑制剂的有效性有限,其原因可能为免疫调节机制复杂,导致肿瘤免疫逃逸的靶点及途径较多。吲哚胺-2, 3-双加氧酶-1(IDO1)作为色氨酸代谢途径中的关键酶,其催化色氨酸分解产生的代谢产物对肿瘤免疫逃逸起到了关键作用,基于此,IDO1有望成为补充免疫治疗的新靶点和途径。
IDO1是由一个含血红素的氧化酶基团与亚铁血红素铁的活性部分(Fe2b)结合形成的单体。相对分子质量为45×103,由人类染色体8p22上的INDO基因编码表达。在全身各种组织和细胞中广泛表达,IDO1的转录调控复杂[3]。在INDO基因启动子区发现干扰素γ(IFN-γ)刺激的响应元件,因此IFN-γ被广泛认为是大多数细胞中IDO1的主要诱导因子。在分子结构方面,IDO1分子环增加不同氧化还原配体有助于抑制剂的结合[4,5]。我们认为该酶特定晶体结构中的不同特征,可能有助于设计新型的IDO1抑制剂。
IDO1的主要作用是将色氨酸分解为犬尿酸及其下游代谢产物。因此色氨酸耗竭成为免疫调节的一种机制,并且色氨酸的代谢产物也可以调节T细胞相关免疫反应[6]。IDO1降解色氨酸会导致色氨酸缺乏,其缺乏可通过诱导无电荷色氨酸t-RNA积累而导致细胞"饿死"。不带电的t-RNA被应激反应激酶GCN2感知,随后GCN2阻止T细胞活化。GCN2基因已破坏的T细胞不受体内IDO1介导的增殖抑制影响,这些T细胞也不会被树突细胞(DC)抑制,从而调节免疫反应[7]。IDO1介导的色氨酸消耗的另一个影响是犬尿氨酸的产生,它可以与芳烃受体结合,芳烃受体激活后的生物学效应包括抑制T细胞活化、诱导DC激活调节性T细胞(Treg细胞)[8]。色氨酸代谢途径见图1。
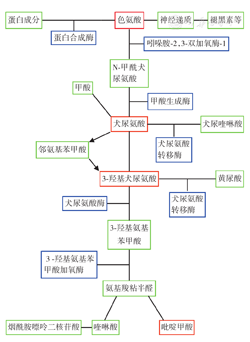

注:体内约95%的游离色氨酸通过犬尿氨酸途径代谢,产生数种生物活性代谢产物,包括犬尿氨酸、犬尿酸、3-羟基犬尿氨酸、3-羟基邻氨基苯甲酸、吡啶甲酸和喹啉酸以及烟酰胺嘌呤二核苷酸,产生的每种代谢物的相对比例取决于其他犬尿氨酸途径酶的表达,而这些酶的作用是细胞刺激依赖型的。其余色氨酸可以通过甲氧基吲哚途径穿梭生成5-羟色胺和褪黑素,也可以用于蛋白质合成。红色框为色氨酸代谢途径中关键产物,绿色框为关键产物的中间产物,蓝色框为色氨酸代谢途径中关键酶
综上,IDO1在肿瘤中的相关免疫调节机制,可以作为一种促进肿瘤免疫逃逸/逃避的机制。
免疫逃逸是指肿瘤细胞通过多种机制逃避机体免疫系统识别和攻击,从而得以在体内生存和增殖的现象。肿瘤细胞在某些情况下能通过多种机制逃避机体的免疫监视,在体内迅速增殖,形成肿瘤。研究发现,IDO1介导的肿瘤逃逸阶段也是逐步形成的,目前机制未明,但大致可分为3个阶段,即免疫消除、免疫平衡、免疫逃逸。免疫消除:肿瘤产生的大部分异型性细胞在开始接触免疫系统时被高效识别和捕获,主要由自然杀伤(NK)细胞和效应T细胞完成免疫"消除"作用,这时IDO1在肿瘤组织的微环境中表达偏低,同时IDO1消耗色氨酸使局部肿瘤微环境中产生色氨酸"饥饿"状态,影响肿瘤利用色氨酸合成有效蛋白[9]。免疫平衡:留存下来的肿瘤异型细胞积累数量和突变,同时上一阶段色氨酸"饥饿"状态开始逐步诱导T细胞凋亡[10]。免疫逃逸:高表达的IDO1开始抑制效应T细胞并诱导其大量凋亡,同时使Treg细胞、DC、髓样树突细胞(mDC)表达升高,进一步抑制肿瘤微环境中的免疫反应,从而达到肿瘤逃逸[11]。
IDO1在许多肿瘤组织中表达均升高,如卵巢癌、子宫颈癌、乳腺癌、肺癌、结直肠癌、子宫内膜癌、黑色素瘤、胰腺癌、骨肉瘤等。肿瘤组织细胞、周围炎症细胞以及区域引流的淋巴结也是IDO1常表达的区域[12,13]。关于IDO1在组织中的表达情况及预后有多方面研究[14,15,16]。其多存在于肿瘤组织细胞中,同时转录水平的mRNA拷贝数也增加,相关的免疫微环境中IDO1表达升高,一般呈中高度表达,IDO1的表达上调与不良预后及肿瘤进展转移呈正相关。
对IDO1基因表达、代谢调节、生物反应等方面进行调节,结果显示IDO1介导的色氨酸分解代谢促进肿瘤进展[17],因此IDO1抑制剂成为临床开发的有力靶点。IDO1在正常组织中表达水平较低,但在肿瘤中表达上调,同时抑制IDO1不易造成严重的不良反应。动物实验中IDO1基因敲除小鼠在不同的小鼠品系中无明显的结构和功能表型变化[18]。此外,临床前试验数据显示,IDO1的抑制可与免疫检查点阻断产生协同效应[19]。临床数据表明,抗PD-1抗体治疗肉瘤患者,血浆犬尿氨酸/色氨酸比例增加。推测阻断免疫检查点会引起IDO1表达升高,这可能是抗PD-1抗体疗效有限的原因之一,提示免疫检查点抑制剂联合IDO1抑制剂有望协同抗肿瘤。因此IDO1抑制剂受到临床关注,目前正在临床试验中测试各种类型的IDO1抑制剂,主要作为免疫治疗方式的辅助手段。
美国Incyte公司开发的epacadostat (INCB024360)是一种IDO1抑制剂,通过与IDO1的含铁血红素基团直接结合[20],与色氨酸竞争结合IDO1,是临床研究中最新的IDO1抑制剂[21],无论是单药治疗,还是与PD-1/PD-L1抗体和(或)CTLA-4抗体联合使用[22],epacadostat通过增强T细胞和NK细胞增殖和功能来增强抗肿瘤作用。一项临床前期研究中,epacadostat协同增强了PD-1/PD-L1或CTLA-4抗体对黑色素瘤生长的抑制作用[23]。已有多项epacadostatⅠ~Ⅲ期临床试验,涵盖实体肿瘤与血液肿瘤。一项Ⅰ期临床试验证实了epacadostat的安全性和80%~90%抑制IDO1的有效性,单药治疗,每天2次,测定血浆剂量≥100 mg。52例患者中7例病情稳定≥16周[24]。大多数epacadostat的临床试验都调查了其作为抗PD-1抗体帕博利珠单抗(pembrolizumab)辅助药物的效果,无论是否有其他治疗方式[23]。对于晚期黑色素瘤、转移性非小细胞肺癌、肾癌、尿路上皮癌和头颈部鳞状细胞癌的治疗,均完成了Ⅲ期临床试验。但在Ⅲ期ECHO-301试验中,epacadostat联合帕博利珠单抗治疗晚期黑色素瘤未能达到无进展生存的主要终点。因此,epacadostat联合免疫检查点抑制的Ⅲ期临床试验要么暂停,要么转入随机的Ⅱ期试验[25]。
indoximod也被称为1-甲基-d-色氨酸(D-1-MT),与直接IDO1抑制剂不同,indoximod的生物学效应为减少Treg细胞的数量,从而降低肿瘤微环境中免疫抑制状态。与美国百时美施贵宝公司的BMS-986205类似,美国NewLink Genetics公司并未开始针对晚期黑色素瘤患者的indoximod联合帕博利珠单抗和(或)纳武单抗(nivolumab)的Ⅲ期临床试验。针对未指明的实体肿瘤,给予患者2 000 mg/d口服,联合多烯紫杉醇(NCT01191216)的Ⅰ期临床试验中,48例患者中有5例病情稳定超过6个月。然而,indoximod和taxane(NCT01792050)的联合应用,在转移性乳腺癌患者的Ⅱ期试验中,未能在无进展生存期、总生存期或客观缓解率方面获得满意的终点[26]。
PD-1/PD-L1是肿瘤免疫调节通路上重要的受体,效应T细胞作用于肿瘤时同时分泌IFN-γ,诱发Treg细胞表面PD-1表达,从而负反馈作用于效应T细胞,达到免疫抑制的效果,同IDO1基因协同表达,均受IFN-γ激活表达上调,相互形成局部免疫微环境的抑制效应。PD-1/PD-L1的靶向抑制剂同样用于临床,目前在不可切除的转移性黑色素瘤、非小细胞肺癌、肾癌中获得了一定的生存获益,但也存在局限性。在非小细胞肺癌PD-1/PD-L1抑制剂耐药的研究中,Li等[27]通过动物建模研究实验发现,IDO1的高表达是导致PD-1/PD-L1抑制剂耐药的主要原因。TCGA数据库分析得出,通过靶向RET-SRc轴,瑞戈非尼有效抑制JAK1/2-STAT1和MAPK信号转导,随后减弱IFN-γ诱导的PD-L1和IDO1表达,从而进一步增强局部肿瘤免疫杀伤。目前关于IDO1抑制剂与PD-1/PD-L1抑制剂联合用药治疗进展期黑色素瘤也在进行Ⅰ、Ⅱ期临床试验,结果令人满意[23,27]。
近年来,针对免疫治疗新靶点的研究越来越受到关注,因IDO1在肿瘤组织及引流淋巴结中表达较高,具有免疫逃逸调节作用,且可加强PD-1/PD-L1抑制剂在肿瘤免疫治疗中的作用。目前针对IDO1相关的免疫抑制剂在多期临床试验中已经观察到疗效,有望成为免疫治疗新的靶点及途径,但仍需要不断开发新的抑制剂,进行临床试验,为免疫治疗提供新方案。
所有作者均声明不存在利益冲突































