
探讨BRAF V600E基因突变与甲状腺癌超声表现及病变侵袭性之间的关系。
选取2018年1月至2019年10月在山西省肿瘤医院行甲状腺手术切除、术后病理诊断为甲状腺癌的153例患者为研究对象,其中甲状腺乳头状癌146例。术前进行超声检查,术后利用石蜡包埋组织检测BRAF V600E基因突变。按照BRAF V600E基因检测结果分为突变组与未突变组,比较两组超声特征的差异,并对BRAF V600E基因突变与超声特征、临床病理特征以及颈部淋巴结转移的关系进行logistic回归分析。
153例甲状腺癌中,130例(85.0%)BRAF V600E基因突变,23例未发生突变。其中146例甲状腺乳头状癌患者中BRAF V600E基因突变128例(87.7%)。BRAF基因突变组病灶与被膜分界不清患者比例高于未突变组,差异有统计学意义[46.9%(60/128)比11.1%(2/18),χ2=8.261,P=0.004],两组在年龄、性别、结节长径、纵横比、结节位置、内部钙化、内部回声、回声均匀与否、囊实性、结节形态、边界是否清楚、血流信号、癌灶数量、淋巴结是否转移、是否伴结节性甲状腺肿方面差异均无统计学意义(均P>0.05)。多因素logistic回归分析结果表明,甲状腺病灶与被膜分界是否清晰为BRAF V600E基因突变的独立影响因素(OR=14.400,95% CI 1.847~112.246,P=0.011),病灶大小为甲状腺乳头状癌颈部淋巴结转移的独立影响因素(OR=2.714,95% CI 1.335~5.517,P=0.006)。
甲状腺乳头状癌中,BRAF V600E基因突变和病灶与被膜分界不清有关,而与淋巴结转移无关;病灶大小和淋巴结转移有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着甲状腺超声检查的普及,甲状腺疾病的诊断率明显提高。超声检查对于甲状腺结节的初步筛查、恶性风险评估、是否进行细针穿刺细胞学检查均具有重要的临床价值。BRAF V600E基因突变是甲状腺癌常见的基因突变,已应用到甲状腺癌的临床诊断中。本研究回顾性分析甲状腺乳头状癌BRAF V600E基因突变情况以及超声诊断结果、临床资料,探讨甲状腺乳头状癌BRAF V600E基因突变与超声表现及病变侵袭性之间的关系。
选取2018年1月至2019年10月在我院手术治疗的153例甲状腺癌患者,入选标准:(1)患者首次接受甲状腺手术治疗;(2)未因甲状腺疾病进行射频消融、核素治疗;(3)石蜡组织提取DNA病例;(4)术前15 d内在我院行超声检查,病变信息记录完整。排除标准:(1)病变资料不全或不配合相关检查;(2)患者曾经接受射频消融、核素治疗、颈部放疗、其他甲状腺手术治疗;(3)妊娠期;(4)合并其他部位恶性肿瘤的患者。153例甲状腺癌患者中,4例滤泡癌,1例髓样癌,2例低分化癌,146例乳头状癌。146例甲状腺乳头状癌中,男性33例,女性113例,年龄(47±11)岁,年龄范围20~77岁。本研究符合2013年修订的《赫尔辛基宣言》的要求,患者均签署知情同意书。
本组153例甲状腺肿物及所取颈部淋巴结病理标本均经10%中性甲醛溶液固定,取材、常规脱水、石蜡包埋、4 μm切片,苏木精-伊红(HE)染色,由具有10年以上肿瘤诊断经验的病理科医师阅片。记录甲状腺癌的病理类型、癌灶个数、颈部淋巴结有无转移、甲状腺组织有无伴发结节性甲状腺肿。
全部病例由病理科医师选取最佳蜡块进行基因检测,确保肿瘤部分>20%。使用厦门艾德生物医药科技股份有限公司的核酸提取试剂(货号ADx-FF03)提取DNA。BRAF V600E基因突变检测使用厦门艾德生物医药科技有限股公司的人类BRAF V600E基因突变检测试剂盒(荧光聚合酶链反应)。实验操作严格按照山西省肿瘤医院病理科分子病理实验室标准操作规程进行,结果由专业的分子病理主治医师进行判读。
主要仪器有Esaotemylab ClassC、Philips Epiq 7、Logiq E9、SIEMENS Acuson Oxana2彩色多普勒超声诊断仪,采用高频线阵探头。由具有10年以上甲状腺超声诊断经验的医师进行甲状腺及颈部淋巴结检查分析。超声诊断医师经过统一培训,对超声检查结果有一致的诊断标准。超声特点的描述均在超声诊断医师在不了解甲状腺病灶病理结果的情况下进行,以减少诊断性偏倚。记录以下超声特征:结节位置、大小、纵横比、形状、边界、钙化、内部回声、回声均匀与否、结节与被膜分界是否清晰、囊实性、血流以及颈部淋巴结位置、大小、结构、形态。病灶的血流信号丰富程度参照Adler半定量法判断,0级:内部无血流信号;1级:少量血流信号,可见1~2处点状血流;2级:中量血流信号,可见3~4处点状血流或1条重要血管,其长度可接近或超过病灶半径;3级:血流信号丰富,可见5个以上点状血管或2条较长血管。超声诊断中病灶与被膜分界不清指甲状腺结节接触处被膜回声带模糊、连续性差或中断。多发甲状腺癌病灶仅对其中较大病灶进行分析。
采用SPSS 17.0软件进行统计分析。计量资料符合正态分布,用均数±标准差( ±s)表示,两组间比较采用t检验;计数资料组间比较用χ2检验或Fisher确切概率法;多因素分析采用logistic回归模型。以P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验;计数资料组间比较用χ2检验或Fisher确切概率法;多因素分析采用logistic回归模型。以P<0.05为差异有统计学意义。
153例甲状腺癌中,130例(85.0%)存在BRAF V600E基因突变,23例未发现突变;其中146例甲状腺乳头状癌中,BRAF V600E基因突变128例(87.7%),未突变18例(12.3%)。4例滤泡癌和1例髓样癌未发生BRAF V600E基因突变,2例低分化癌存在BRAF V600E基因突变。
146例甲状腺乳头状癌患者病理结果显示,颈部淋巴结转移67例(45.9%),多发恶性结节57例(39.0%),伴发结节性甲状腺肿81例(55.5%)。
146例甲状腺乳头状癌患者中,病灶大小(1.11±0.65)cm,范围0.20~4.58 cm;纵横比1.13±0.29,范围0.58~2.44。左叶56例,右叶61例,峡部10例,双叶多发19例;超声显示甲状腺病灶与被膜分界不清62例(42.5%)(图1);实性141例(96.6%);内部回声均匀54例(37.0%);边界不清136例(93.2%)。内部钙化:无钙化34例(23.3%),微小钙化92例(63.0%),粗大钙化18例(12.3%),环周钙化2例(1.4%);内部回声:极低回声65例(44.5%),低回声79例(54.1%),等回声2例(1.4%);形态:形态规则24例(16.4%),成角13例(8.9%),分叶状6例(4.1%),不规则103例(70.5%);血流信号:0级21例(14.4%),1级103例(70.5%),2级15例(10.3%),3级7例(4.8%)。
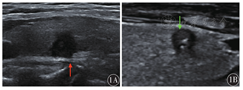

BRAF V600E基因突变组在病灶与被膜分界不清患者比例高于未突变组,差异有统计学意义(P=0.004);BRAF V600E基因突变组与未突变组的结节部位、内部钙化、内部回声、回声均匀与否、囊实性、结节形态、边界、血流信号比较,差异均无统计学意义(均P>0.05)(表1)。为了明确微小钙化与BRAF V600E基因突变之间的关系,将钙化重新分为微小钙化组、非微小钙化组,两组间差异无统计学意义(P=0.222)。突变组与未突变组结节长径[(1.12±0.60)cm比(1.08±0.58)cm,t=0.218,P=0.828]、纵横比(1.13±0.29比1.07±0.24,t=0.878,P=0.381)差异均无统计学意义。
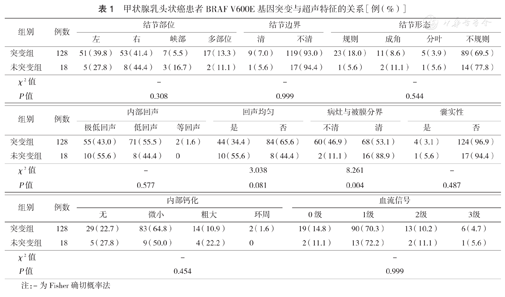
甲状腺乳头状癌患者BRAF V600E基因突变与超声特征的关系[例(%)]
甲状腺乳头状癌患者BRAF V600E基因突变与超声特征的关系[例(%)]
| 组别 | 例数 | 结节部位 | 结节边界 | 结节形态 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 左 | 右 | 峡部 | 多部位 | 清 | 不清 | 规则 | 成角 | 分叶 | 不规则 | ||
| 突变组 | 128 | 51(39.8) | 53(41.4) | 7(5.5) | 17(13.3) | 9(7.0) | 119(93.0) | 23(18.0) | 11(8.6) | 5(3.9) | 89(69.5) |
| 未突变组 | 18 | 5(27.8) | 8(44.4) | 3(16.7) | 2(11.1) | 1(5.6) | 17(94.4) | 1(5.6) | 2(11.1) | 1(5.6) | 14(77.8) |
| χ2值 | - | - | - | ||||||||
| P值 | 0.308 | 0.999 | 0.544 | ||||||||
| 组别 | 例数 | 内部回声 | 回声均匀 | 病灶与被膜分界 | 囊实性 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 极低回声 | 低回声 | 等回声 | 是 | 否 | 不清 | 清 | 是 | 否 | ||
| 突变组 | 128 | 55(43.0) | 71(55.5) | 2(1.6) | 44(34.4) | 84(65.6) | 60(46.9) | 68(53.1) | 4(3.1) | 124(96.9) |
| 未突变组 | 18 | 10(55.6) | 8(44.4) | 0 | 10(55.6) | 8(44.4) | 2(11.1) | 16(88.9) | 1(5.6) | 17(94.4) |
| χ2值 | - | 3.038 | 8.261 | - | ||||||
| P值 | 0.577 | 0.081 | 0.004 | 0.487 | ||||||
| 组别 | 例数 | 内部钙化 | 血流信号 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 无 | 微小 | 粗大 | 环周 | 0级 | 1级 | 2级 | 3级 | ||
| 突变组 | 128 | 29(22.7) | 83(64.8) | 14(10.9) | 2(1.6) | 19(14.8) | 90(70.3) | 13(10.2) | 6(4.7) |
| 未突变组 | 18 | 5(27.8) | 9(50.0) | 4(22.2) | 0 | 2(11.1) | 13(72.2) | 2(11.1) | 1(5.6) |
| χ2值 | - | - | |||||||
| P值 | 0.454 | 0.999 | |||||||
注:-为Fisher确切概率法
BRAF V600E基因突变组与未突变组在性别、年龄、癌灶数量、伴结节性甲状腺肿与否、淋巴结是否转移等方面差异均无统计学意义(均P>0.05)(表2)。
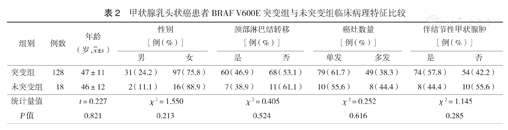
甲状腺乳头状癌患者BRAF V600E突变组与未突变组临床病理特征比较
甲状腺乳头状癌患者BRAF V600E突变组与未突变组临床病理特征比较
| 组别 | 例数 | 年龄(岁, ±s) ±s) | 性别[例(%)] | 颈部淋巴结转移[例(%)] | 癌灶数量[例(%)] | 伴结节性甲状腺肿[例(%)] | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | 是 | 否 | 单发 | 多发 | 是 | 否 | |||
| 突变组 | 128 | 47±11 | 31(24.2) | 97(75.8) | 60(46.9) | 68(53.1) | 79(61.7) | 49(38.3) | 74(57.8) | 54(42.2) |
| 未突变组 | 18 | 46±12 | 2(11.1) | 16(88.9) | 7(38.9) | 11(61.1) | 10(55.6) | 8(44.4) | 8(44.4) | 10(55.6) |
| 统计量值 | t=0.227 | χ2=1.550 | χ2=0.405 | χ2=0.252 | χ2=1.145 | |||||
| P值 | 0.821 | 0.213 | 0.524 | 0.616 | 0.285 | |||||
logistic回归分析的结果显示,病灶与被膜分界是甲状腺乳头状癌BRAF V600E基因突变的独立影响因素(OR=14.400,95%CI 1.847~112.246,P=0.011);病灶大小为甲状腺乳头状癌淋巴结转移的独立影响因素(OR=2.714,95%CI 1.335~5.517,P=0.006)。
甲状腺超声检查是筛查和诊断甲状腺癌的第一步,甲状腺超声检查的广泛应用使得甲状腺癌的检出率明显提高。能否利用超声检查无创性地早期分析甲状腺癌的分子表达情况,对于术前评估病变的侵袭性和预后及选择合理的治疗有重要意义。随着甲状腺结节检出率的增高,甲状腺癌越来越受到关注,其中RAS-RAF-MEK-ERK MAPK为目前研究较多的通路之一,是诱发细胞核内反应的重要转导通路。此通路中的BRAF基因是甲状腺乳头状癌启动基因之一,其中BRAF V600E突变最为多见。BRAF即鼠类肉瘤滤过性毒菌致癌同源体B1,属于丝氨酸-苏氨酸蛋白激酶,是参与MAPK信号通路的活化剂。BRAF基因是RAF基因家族成员之一,位于人类染色体7q34。BRAF是肿瘤中常见的突变表达基因,绝大多数突变发生在第15号外显子的第1799位核苷酸(T>A),导致翻译蛋白第600位密码子的缬氨酸被谷氨酸取代,引起异常磷酸化,激活MAPK信号通路[1]。BRAF V600E基因突变在甲状腺乳头状癌中的高发生率使其成为辅助诊断甲状腺乳头状癌最敏感的指标之一。有关甲状腺乳头状癌的BRAF V600E基因突变率报道不一,一项关于甲状腺乳头状癌复发与BRAF V600E基因突变率相关性的国际多中心研究表明,甲状腺乳头状癌BRAF V600E基因突变率为48.5%[2];另一项韩国的研究表明甲状腺乳头状癌中BRAF V600E基因突变率为80.8%[3]。近期有研究报道甲状腺乳头状癌BRAF V600E基因突变检出率为75%[4]。本研究中甲状腺乳头状癌BRAF V600E基因突变率(87.7%)较高,可能与研究对象的标本类型、病变分期、病灶大小、检测方法、人种、地域、生活习惯等有关。BRAF V600E基因突变亦与甲状腺乳头状癌的侵袭性和复发相关[2,5],BRAF V600E基因突变阳性的患者更容易出现肿瘤长径≥10 mm、腺体外侵犯、淋巴结转移以及TNM分期较高[6]。美国甲状腺协会(ATA)指南指出对细针穿刺细胞学检查(FNA)不能确诊的患者,可以检查分子标志物,如BRAF、RAS、RET,对甲状腺癌细胞学辅助诊断有一定的意义[7,8]。
甲状腺超声检查中达成共识的可疑恶性征象包括实性、低回声、形态不规则、边缘不规则、钙化缺损、纵横比≥1、微钙化、病灶向外浸润或累及甲状腺被膜等[9],虽然单独恶性征象均不能良好预测结节恶性风险,但每个超声特征的含义和诊断权重有所不同,如砂粒样钙化可降低假阳性率,极低回声强烈提示甲状腺恶性肿瘤[10]。研究甲状腺声像图中是否有与BRAF V600E基因突变相关的特征,以便从影像学的角度去判断甲状腺乳头状癌的侵袭性与预后,对于早期诊断很有意义。既往对于BRAF V600E基因突变与超声表现之间关系的研究结果有分歧[11],本研究显示,甲状腺乳头状癌的超声表现中病变与被膜分界是否清晰和BRAF V600E基因突变有关,结果与文献[12,13]的研究结果高度一致。BRAF V600E基因突变组中更多出现病变与甲状腺被膜分界不清,表明BRAF V600E基因突变与病变的侵袭性有关,提示在超声诊断中应该更加重视甲状腺结节与被膜分界是否清晰,当分界不清时对诊断甲状腺癌及判断预后更有意义。并且有研究表明甲状腺乳头状癌的三组亚型间是否靠近被膜与BRAF V600E突变之间差异有统计学意义[14]。也有研究表明BRAF V600E突变组甲状腺被膜侵犯出现得更少[15],但该研究中BRAF检测用免疫组织化学方法,与本研究的基因检测内容和方法不同。此外本研究4例滤泡状癌和1例髓样癌均未发生BRAF V600E基因突变,2例低分化癌都存在BRAF V600E基因突变,反映出的趋势是滤泡状癌、髓样癌不易伴随BRAF基因突变,低分化癌极易发生BRAF V600E基因突变,但病例较少,尚需进一步探索研究。
颈部淋巴结转移在甲状腺乳头状癌中发生率高,超声检查中颈部淋巴结转移的位置和大小关系到手术方式的选择,所以颈部淋巴结转移的相关因素值得关注。本研究结果表明BRAF V600E基因突变与淋巴结转移无相关性,不同于其他研究报道[16]。由于BRAF V600E基因突变与病变和被膜分界不清有关,而与颈部淋巴结转移无关,据此推测甲状腺乳头状癌BRAF V600E基因突变者更易发生直接浸润,而非淋巴结转移。本研究logistic多因素回归分析结果显示甲状腺乳头状癌的淋巴结转移仅与甲状腺肿物大小有关,而BRAF V600E基因突变、病变与甲状腺被膜分界情况等超声特点均未进入回归方程。有研究表明超声图像中肿瘤较大是单灶甲状腺乳头状癌患者中央区淋巴结转移的独立危险因素[17],这与本研究结果一致。因此,尚需进一步按照部位研究甲状腺癌淋巴结转移与BRAF V600E基因突变、超声特征之间的关系。
所有作者均声明不存在利益冲突



























