
探讨艾曲泊帕在实体肿瘤化疗所致血小板减少症治疗中的应用。
收集2019年5月至2020年4月清华大学附属北京清华长庚医院收治的实体肿瘤化疗所致血小板减少症患者4例,对其临床特征、应用艾曲泊帕后的疗效及不良反应进行分析。
4例患者应用艾曲泊帕前中位血小板计数为32×109/L[(8~54)×109/L],中位血小板恢复时间为18.5 d。所有患者对药物耐受性良好,未出现头痛、肝肾损害及血栓形成等不良反应,均达完全缓解。
艾曲泊帕可有效提高血小板数量,且使用方便、不良反应小,可为临床医生处理实体肿瘤化疗所致血小板减少症治疗提供一定的借鉴。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
化疗所致血小板减少症(CIT)是肿瘤化疗中常见的不良反应。CIT目前治疗主要包括输注血小板和给予促血小板生长因子。促血小板生长因子包括重组人血小板生成素(rhTPO)、重组人白细胞介素11(rhIL-11)和血小板生成素受体(TPO-R)激动剂。其中艾曲泊帕是第2代TPO-R,可有效提高血小板计数,减少输血依赖。现对我院收治的4例化疗所致CIT患者应用艾曲泊帕的疗效和不良反应进行总结,并复习相关文献。
收集2019年5月1日至2020年4月30日我院收治的CIT患者4例。CIT诊断标准[1]:(1)外周血血小板计数<100×109/L;(2)发病前有确切的应用某种可引起血小板减少的化疗药物,且停药后血小板减少所致症状与体征逐渐减轻或血小板计数恢复正常;(3)排除其他可能导致血小板减少症的原因,如再生障碍性贫血、急性白血病、放射病、免疫性血小板减少性紫癜、脾功能亢进和骨髓肿瘤细胞浸润等;(4)排除使用能够引起血小板减少的非化疗药物,如磺胺类药物等;(5)避免以乙二胺四乙酸(EDTA)作为检测样本抗凝剂所致的假性血小板减少症;(6)患者伴或不伴出血倾向,如皮肤上有出血点、瘀斑或原因不明的鼻出血等表现,甚至出现更加严重的器官组织出血迹象;(7)重新使用同样化疗药后血小板减少症再次出现。CIT分级参照美国国立卫生研究院常见不良反应术语评定标准(CTCAE)5.0版。
患者血小板计数<75×109/L时给予艾曲泊帕50 mg/d口服治疗。记录患者治疗前后血小板计数变化值。参照文献[2]标准判定疗效,完全缓解(CR):血小板计数>100×109/L,且无出血症状。有效:治疗后血小板计数(30~100)×109/L,至少是基线血小板计数的2倍,且无出血。无效:血小板计数低于30×109/L或不到基线血小板计数的2倍;在达到CR或有效后,复发血小板计数低于30×109/L,或低于基线计数或出血。
4例患者均为男性,中位年龄53岁,年龄范围46~68岁。原发病分别为胃腺癌、结肠癌、非小细胞肺癌及肝外胆管癌,化疗方案分别为清蛋白结合型紫杉醇+替吉奥、FOLFOXIRI方案+贝伐珠单抗、吉西他滨+顺铂及吉西他滨+贝伐珠单抗+帕博利珠。4例患者在应用艾曲泊帕前中位血小板计数为32×109/L[(8~54)×109/L]。中位血小板恢复时间18.5 d。4例患者原发病的化疗方案、艾曲泊帕治疗前血小板计数水平、应用艾曲泊帕前CIT治疗药物及血小板减少分级见表1。
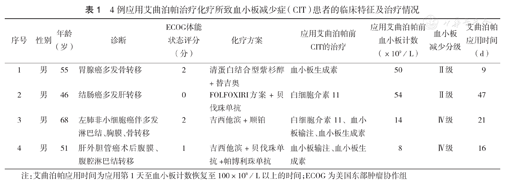
4例应用艾曲泊帕治疗化疗所致血小板减少症(CIT)患者的临床特征及治疗情况
4例应用艾曲泊帕治疗化疗所致血小板减少症(CIT)患者的临床特征及治疗情况
| 序号 | 性别 | 年龄(岁) | 诊断 | ECOG体能状态评分(分) | 化疗方案 | 应用艾曲泊帕前CIT的治疗 | 应用艾曲泊帕前血小板计数(×109/L) | 血小板减少分级 | 艾曲泊帕应用时间(d) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 男 | 55 | 胃腺癌多发骨转移 | 2 | 清蛋白结合型紫杉 | 血小板生成素 | 50 | ^级 | 9 |
| 2 | 男 | 46 | 结肠癌多发肝转移 | 0 | 醇+替吉奥FOLFOXIRI方案+贝 | 白细胞介素11 | 54 | ^级 | 47 |
| 3 | 男 | 68 | 左肺非小细胞癌伴多发淋巴结、胸膜、骨转移 | 2 | 伐珠单抗吉西他滨+顺铂 | 白细胞介素11、血小板输注、血小板生成素 | 14 | ^级 | 21 |
| 4 | 男 | 51 | 肝外胆管癌术后腹膜、腹腔淋巴结转移 | 1 | 吉西他滨+贝伐珠单抗+帕博利珠单抗 | 血小板输注、血小板生成素 | 8 | ^级 | 16 |
注:艾曲泊帕应用时间为应用第1天至血小板计数恢复至100×109/L以上的时间;ECOG为美国东部肿瘤协作组
所有患者对药物耐受性良好,其中2例患者出现乏力,乏力评分分别为3分和4分,为轻度及中度不良反应,其余患者无不适症状。4例患者均未出现头痛、肝肾损害及血栓形成等不良反应,经艾曲泊帕治疗后血小板计数恢复正常,均达到CR。
CIT的机制是化疗药物通过对巨核系细胞的抑制作用导致血小板生成不足和过度破坏[3],从而使外周血中血小板计数低于正常值。CIT是最常见的肿瘤治疗并发症之一,也是临床亟需处理的血液学不良反应。其导致化疗药物剂量减少、化疗时间延迟、相对剂量强度(RDI)降低,增加院内感染率,甚至延长住院时间、增加患者的治疗费用。持续和反复性的CIT可能降低化疗效果并降低患者的生命质量、缩短预期生存期。
艾曲泊帕是一种口服非肽小分子TPO-R激动剂,其结合于骨髓巨核细胞TPO-R的c-Mpl跨膜区,引起细胞质的Janus激酶(JAK)2和酪氨酸激酶的活化,随后引起STAT5、MAPK、AKT、ERK1/2等信号通路相关因子的磷酸化,诱导巨核细胞增殖和分化,刺激血小板生成[4]。目前,艾曲泊帕已被用于多种血小板减少性疾病的治疗,如免疫性血小板减少症、丙型肝炎病毒(HCV)相关性血小板减少症、再生障碍性贫血、急性髓系白血病、骨髓增生异常综合征、造血干细胞移植后血小板减少、复发难治多发性骨髓瘤及系统性红斑狼疮相关血小板减少等[5],但其在实体肿瘤CIT的应用较少。艾曲泊帕常见不良反应包括头痛、鼻咽炎,严重的不良反应包括血栓形成、肝功能损害、白内障、骨髓纤维化等[6]。有研究显示抗磷脂综合征患者接受艾曲泊帕治疗后易形成血栓,甚至发生肺栓塞[7]。
Kellum等[8]进行的一项关于艾曲泊帕在卡铂联合紫杉醇治疗进展期实体肿瘤中有效性及安全性的随机、双盲、对照临床试验研究中,183例患者随机分为安慰剂组、艾曲泊帕50 mg组、艾曲泊帕75 mg组和艾曲泊帕100 mg组,在化疗第2天至第11天给予口服药物治疗,21 d为1个周期,至少2个周期。结果显示在治疗的第1个周期和第2个周期中所有艾曲泊帕治疗组与安慰剂组相比,均明显提升患者血小板计数水平,常见不良反应为恶心和脱发,一般耐受性良好。可以认为艾曲泊帕可提升晚期实体瘤化疗患者的血小板水平,且患者的耐受性良好。
Winer等[9]进行的一项艾曲泊帕治疗以吉西他滨为基础的晚期实体瘤CIT的随机对照Ⅱ期临床试验中,患者按2∶1的比例随机分配至试验组和对照组。其中试验组患者在化疗前5 d及化疗后开始口服艾曲泊帕100 mg,1次/d,对照组给予安慰剂。结果显示试验组化疗前血小板计数高于对照组,而3~4级血小板减少症的发生率低于对照组。试验组的血小板计数从最低值恢复至正常值的平均时间为8 d,而安慰剂组为15 d。本研究中的4例患者在应用艾曲泊帕前均接收过至少1种CIT常规治疗,结果显示艾曲泊帕中位血小板恢复时间为18.5 d,4例均有效,不良反应方面仅表现为轻、中度乏力。在本研究中血小板恢复时间为从应用艾曲泊帕第1天到血小板计数恢复至100×109/L以上的时间,因此较文献报道的恢复时间有所延长。我们的研究结果显示艾曲泊帕治疗CIT是安全、有效的。但是由于观察的患者数较少,还有待于更大样本量的研究。
综上,艾曲泊帕作为口服肽类TPO-R激动剂,可有效提高血小板数量,且使用方便、不良反应小。本研究可为临床医生处理实体肿瘤CIT治疗提供一定的借鉴。
所有作者均声明不存在利益冲突



























