
观察吉西他滨和奥沙利铂联合靶向药物阿帕替尼治疗胆囊癌的效果。
对2017年5月至2018年12月山东省海阳市人民医院、烟台市烟台山医院和烟台市海阳荣军医院收治的82例胆囊癌患者病例资料进行回顾性分析,依据用药情况分为对照组与观察组,各41例。对照组患者采用吉西他滨联合奥沙利铂方案治疗(吉西他滨1 000 mg/m2,30 min静脉滴注,第1、8天;奥沙利铂100 mg/m2,3 h静脉滴注,第1天),观察组在对照组的治疗方法基础上,联合甲磺酸阿帕替尼500 mg/d。比较两组患者治疗效果、血清肿瘤标志物水平、不良反应及生存情况。
对照组患者的疾病控制率为70.73%(29/41),低于观察组的92.68%(38/41)(χ2=6.609,P<0.05)。治疗后观察组血管内皮生长因子(VEGF)、癌胚抗原(CEA)、可溶性白细胞介素2受体(sIL-2R)及Dickkopf-1水平均低于观察组,差异均有统计学意义(t值分别为6.011、3.048、4.444、4.514,均P<0.05)。观察组患者蛋白尿、手足综合征发生率均低于对照组,差异均有统计学意义(χ2值分别为6.116、4.986,均P<0.05)。随访1年,观察组2例死亡,生存率为95.13%(39/41),对照组8例死亡,生存率为80.49%(33/41),两组患者随访后生存率差异有统计学意义(χ2=4.100,P<0.05)。
吉西他滨和奥沙利铂联合阿帕替尼治疗胆囊癌效果较好,可有效降低患者血清肿瘤标志物水平,改善患者的预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆囊癌是胆道系统中较为常见的恶性肿瘤之一,其特征主要为生长速度快、发病率高、起病隐匿、恶性程度较高等,严重影响患者的生命质量[1]。随着胆囊癌研究的进展,其治疗方法也不断改进,化疗与靶向药物的不断应用和多学科综合治疗模式的开展,使胆囊癌的治疗效果显著提升。胆囊癌在早期无特殊的表现,其起病隐匿、生长速度快,患者在发现病症时,往往疾病进入了中晚期,已失去了最佳治疗时机,且疾病的恶性程度较高,手术切除的治疗效果不佳[2]。对于胆囊癌,化疗可直接杀伤肿瘤细胞,新型抗肿瘤药物吉西他滨有较强广谱抗肿瘤活性,作用机制独特,被广泛应用[3]。在肿瘤治疗中,奥沙利铂具有高效、不良反应小的特征。甲磺酸阿帕替尼是对抗血管内皮生长因子受体2的分子靶向药物,有促进肿瘤细胞的凋亡的作用。本研究对采用吉西他滨和奥沙利铂联合靶向药物阿帕替尼治疗胆囊癌的效果进行回顾性分析。
回顾性分析2017年5月至2018年12月海阳市人民医院、烟台市烟台山医院和烟台市海阳荣军医院收治的82例胆囊癌患者临床资料,按照用药情况分为观察组和对照组,各41例。纳入标准:(1)所有患者均符合中华医学会外科学分会胆道外科学组胆囊癌诊治指南[5],并经病理学检查证实;(2)均为既往未接受过放化疗的初治患者;(3)预计生存时间>3个月,有实体病灶且可进行测量。排除标准:(1)存在凝血功能异常;(2)存在心电图、肝肾功能严重异常;(3)对化疗药物变态反应或有禁忌证;(4)伴发中枢神经系统转移。两组患者性别、病程、年龄、分期等一般资料比较,差异均无统计学意义(均P>0.05)(表1),具有可比性。
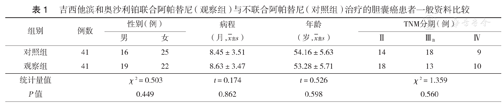
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗的胆囊癌患者一般资料比较
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗的胆囊癌患者一般资料比较
| 组别 | 例数 | 性别(例) | 病程(月, ±s) ±s) | 年龄(岁, ±s) ±s) | TNM分期(例) | |||
|---|---|---|---|---|---|---|---|---|
| 男 | 女 | Ⅱ | ⅢB | Ⅳ | ||||
| 对照组 | 41 | 16 | 25 | 8.45±3.51 | 54.16±5.63 | 14 | 18 | 9 |
| 观察组 | 41 | 19 | 22 | 8.63±3.47 | 53.28±5.71 | 18 | 13 | 10 |
| 统计量值 | χ2=0.503 | t=0.174 | t=0.526 | χ2=1.359 | ||||
| P值 | 0.449 | 0.862 | 0.598 | 0.560 | ||||
对照组患者接受吉西他滨联合奥沙利铂方案化疗:吉西他滨1 000 mg/m2,配制于0.9% NaCl溶液中,30 min静脉滴注,第1、8天;奥沙利铂100 mg/m2,配制于5%葡萄糖溶液中,3 h静脉滴注,第1天。治疗3周休息1周,为1个周期,共进行2个周期治疗。观察组在对照组的治疗方法基础上联合甲磺酸阿帕替尼治疗,阿帕替尼500 mg/d,1次/d,餐后30 min口服,2个月为1个周期,连续治疗2个周期。治疗2个周期后进行疗效评价。
对化疗过程中可能会出现的Ⅲ~Ⅳ级骨髓抑制进行造血因子注射治疗。治疗期间每周复查血常规,对白细胞计数<20×109/L患者进行粒细胞集落刺激因子治疗。每2周复查肝肾功能,密切观察患者的血液学不良反应及胃肠道不良反应。
(1)参照实体肿瘤疗效评价标准(RECIST)评价疗效[6]:完全缓解(CR)为目标病灶完全消失,维持4周以上;部分缓解(PR)为基线病灶长径之和减少≥30%;病灶稳定(SD)为基线病灶长径之和减少,但减少<30%,或增加,但增加<20%;疾病进展(PD)为出现新病灶或基线病灶长径之和至少增加20%。疾病控制率(DCR)以CR+PR+SD计算。(2)血清肿瘤标志物检测:所有患者治疗前后均取静脉血检测血管内皮生长因子(VEGF)、癌胚抗原(CEA)、可溶性白细胞介素2受体(sIL-2R)、Dickkopf-1水平。(3)比较两组患者不良反应发生情况。(4)对所有患者进行为期1年的随访调查,记录患者生存时间,比较随访后的生存率。
采用SPSS 19.0软件进行统计学分析。计数资料比较采用χ2检验;计量资料符合正态分布,以均数±标准差( ±s)表示,两组间比较采用t检验。检验水准α=0.05。
±s)表示,两组间比较采用t检验。检验水准α=0.05。
治疗后观察组患者的DCR高于对照组,差异有统计学意义[92.68%(38/41)比70.73%(29/41),χ2=6.609,P=0.010](表2)。
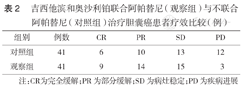
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗胆囊癌患者疗效比较(例)
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗胆囊癌患者疗效比较(例)
| 组别 | 例数 | CR | PR | SD | PD |
|---|---|---|---|---|---|
| 对照组 | 41 | 6 | 10 | 13 | 12 |
| 观察组 | 41 | 9 | 14 | 15 | 3 |
注:CR为完全缓解;PR为部分缓解;SD为病灶稳定;PD为疾病进展
治疗前两组患者血清肿瘤标志物VEGF、sIL-2R、CEA、Dickkopf-1水平比较,差异均无统计学意义(均P>0.05),治疗后观察组4项指标的水平均低于对照组,差异均有统计学意义(均P<0.05)(表3)。
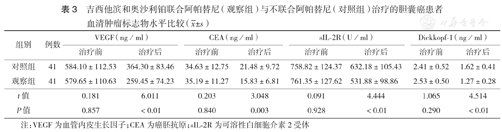
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗的胆囊癌患者血清肿瘤标志物水平比较( ±s)
±s)
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗的胆囊癌患者血清肿瘤标志物水平比较( ±s)
±s)
| 组别 | 例数 | VEGF(ng/ml) | CEA(ng/ml) | sIL-2R(U/ml) | Dickkopf-1(ng/ml) | ||||
|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 对照组 | 41 | 584.10±112.53 | 364.30±83.46 | 34.63±12.75 | 21.48±9.72 | 758.82±124.37 | 632.18±105.43 | 2.41±0.52 | 1.62±0.41 |
| 观察组 | 41 | 579.65±110.63 | 259.45±74.23 | 35.19±11.27 | 15.83±6.81 | 761.35±127.62 | 531.88±98.86 | 2.53±0.50 | 1.27±0.28 |
| t值 | 0.181 | 6.011 | 0.203 | 3.048 | 0.091 | 4.444 | 1.065 | 4.514 | |
| P值 | 0.857 | <0.01 | 0.840 | 0.003 | 0.928 | <0.01 | 0.290 | <0.01 | |
注:VEGF为血管内皮生长因子;CEA为癌胚抗原;sIL-2R为可溶性白细胞介素2受体
两组患者间血压升高、恶心呕吐、骨髓抑制发生率差异均无统计学意义(均P>0.05),观察组患者蛋白尿、手足综合征发生率均低于对照组,差异有统计学意义(均P<0.05)(表4)。
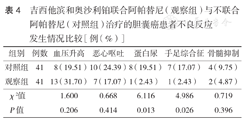
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗的胆囊癌患者不良反应发生情况比较[例(%)]
吉西他滨和奥沙利铂联合阿帕替尼(观察组)与不联合阿帕替尼(对照组)治疗的胆囊癌患者不良反应发生情况比较[例(%)]
| 组别 | 例数 | 血压升高 | 恶心呕吐 | 蛋白尿 | 手足综合征 | 骨髓抑制 |
|---|---|---|---|---|---|---|
| 对照组 | 41 | 8(19.51) | 10(24.39) | 8(19.51) | 7(17.07) | 4(9.75) |
| 观察组 | 41 | 13(31.70) | 7(17.07) | 1(2.43) | 1(2.43) | 2(4.87) |
| χ2值 | 1.600 | 0.668 | 6.116 | 4.986 | 0.719 | |
| P值 | 0.206 | 0.414 | 0.013 | 0.026 | 0.396 |
所有患者随访1年,无失访者。观察组2例死亡,生存率为95.13%(39/41);对照组8例死亡,生存率为80.49%(33/41)。两组患者随访后生存率差异有统计学意义(χ2=4.100,P=0.043)。
多学科综合治疗是恶性肿瘤主要治疗模式,根治性切除是唯一可能治愈胆囊癌的治疗方法。发现胆囊癌后应先争取进行手术探查,在胆囊癌的发病早期进行根治性切除可使患者5年生存率达到75%以上[7]。但因胆囊癌缺乏特异性,早期表现不明显、起病隐匿、生长速度快等,部分患者在确诊时病情已进入了中晚期,肿瘤细胞已侵袭浆膜,出现肝脏、腹膜等多处淋巴结转移、扩散[8]。晚期胆囊癌患者进行根治性切除手术的时间较长,切除的范围较大,术后并发症多,围术期风险大,与非手术的晚期胆囊癌患者预后无较大差别。因此,对晚期胆囊癌患者建议的主要治疗方式是化疗,治疗方案应根据患者的身体状况等各项指标综合评估后进行制订[9]。
化疗是胆囊癌的重要治疗方法,目前,在胆囊癌的化疗方案制订中尚无统一标准。化疗药物吉西他滨是新型的抗肿瘤药物,主要作用机制是其在人体内的主要代谢物进入细胞的DNA中,对DNA合成期的肿瘤细胞产生影响,阻断细胞DNA修复、合成、复制,从而抑制肿瘤的生长,但其对肿瘤细胞不具有特异性杀伤作用,其在对肿瘤细胞进行杀伤时,对人体正常细胞也会造成破坏,在作为联合放疗方案的基础药物具有一定优势[10]。奥沙利铂是第三代铂类抗肿瘤药物,其在DNA链条和链间形成加合物,影响肿瘤细胞的DNA合成、复制,且可与其他抗肿瘤药物起到协同作用[11]。吉西他滨与奥沙利铂抗肿瘤机制有较明显的差异,但均是广谱的高活性细胞毒性药物,与吉西他滨单独用药比较,联合铂类药物会增强对肿瘤细胞的抑制作用,但不良反应加大。靶向药物的研究在近年取得较大进展,甲磺酸阿帕替尼是一种小分子酪氨酸激酶抑制剂,对依赖血管内皮生长因子受体2的血管产生抑制,阻断下游信号转导,从而达到抑制肿瘤细胞转移、生长的效果,改善患者的细胞免疫抑制状态。靶向药物与化疗药物联合后,疗效较为显著。
在本研究中,化疗药物联合靶向药物治疗胆囊癌的DCR为92.68%,高于采用吉西他滨联合奥沙利铂的对照组(70.73%),并且前者治疗后血清肿瘤标志物水平降低较后者更为显著。提示化疗药物联合靶向药物可有效抑制胆囊癌,阻断肿瘤细胞的合成,使肿瘤细胞停止生长。在不良反应方面,观察组手足综合征、蛋白尿发生率均低于对照组。随访1年后,观察组生存率高于对照组。表明化疗药物联合靶向药物治疗胆囊癌可改善预后,且安全性更高。
所有作者均声明不存在利益冲突



























