
探讨肿瘤型人工膝关节假体置换术治疗膝关节周围恶性骨肿瘤的效果、并发症及患者生存情况。
回顾性分析2010年1月至2018年4月在山西医科大学第二医院行肿瘤型膝关节假体置换术的47例患者资料,其中男性21例,女性26例,中位年龄21岁(7~70岁);骨肉瘤39例,软骨肉瘤3例,恶性纤维组织细胞瘤2例,骨巨细胞瘤2例,纤维肉瘤1例;肿瘤位于股骨远端者35例,胫骨近端者12例。骨肉瘤、恶性纤维组织细胞瘤患者术前均行2个疗程化疗,术后均行4~6个疗程化疗。收集资料包括患者生存时间、假体生存时间和并发症、肢体功能、肿瘤复发、肺转移等。
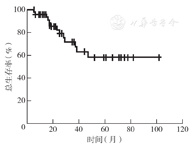
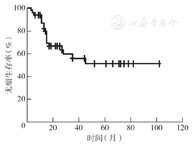
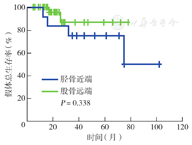
患者中位随访25个月(5~102个月)。患者1、3、5年总生存率分别为95.74%、71.29%、58.06%,1、3、5年无瘤生存率分别为86.42%、55.49%、50.86%。10例(21.28%)患者术后3年内出现了肿瘤局部复发,其中8例为软组织肿瘤复发,行肿瘤再切除,其余2例行截肢术;15例(31.91%)发生肺转移。假体5年总生存率为82.33%,其中股骨远端肿瘤患者的假体5年总生存率高于胫骨近端患者(86.96%比75.00%,P=0.338);3例(6.38%)出现假体感染,1例(2.13%)假体松动后翻修,1例(2.13%)假体断裂后翻修。患者末次随访时国际骨与软组织肿瘤协会(MSTS)评分中位数(P25,P75)为21分(15分,24分),优良率为61.70%(29/47)。胫骨近端肿瘤患者伸膝延迟发生率高于股骨远端肿瘤患者,差异有统计学意义[33.33%(4/12)比2.86%(1/35),P=0.016]。
肿瘤型人工膝关节假体置换术能够有效治疗膝关节周围恶性骨肿瘤,可保持满意的肢体功能和生存率,但术后相关并发症可导致保肢失败,需通过规范的放化疗、广泛严格的肿瘤切除及适当的康复锻炼来减少并发症的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性恶性骨肿瘤占所有恶性肿瘤的比例不到0.2%,主要发生在股骨远端、胫骨近端、股骨近端及肱骨近端[1]。其中股骨远端是骨肿瘤最常见的部位,其次是胫骨近端,因而膝关节周围成为恶性骨肿瘤的好发部位[2]。对于膝关节周围恶性骨肿瘤,手术方法主要分为截肢术和保肢术。有报道称在所有四肢骨和软组织肉瘤患者中,70%~95%的患者选择进行保肢手术[3]。随着新辅助化疗的开展、影像学技术及重建技术的进步,使用肿瘤型膝关节假体进行保肢手术已经成为治疗膝关节周围恶性骨肿瘤的主要方法[4,5]。但肿瘤型膝关节假体置换术在具有显著的外观和功能优势的同时,也存在着不可避免和不可忽视的问题。我们对52例患者行肿瘤型膝关节假体置换术,其中47例获得随访,现将治疗效果及预后总结如下。
纳入标准:(1)膝关节周围(股骨远端及胫骨近端)恶性骨肿瘤;(2)行肿瘤型膝关节假体置换术。排除标准:(1)存在严重心、脑、肝、肾等器官疾病;(2)有外院治疗史;(3)出现远处转移;(4)随访资料不完整。恶性骨肿瘤诊断根据病史、体征、影像学检查及组织病理结果确定。2010年1月至2018年4月在我院行肿瘤型膝关节假体置换术的52例患者中,47例符合标准,纳入本回顾性研究。包括男性21例,女性26例,中位年龄21岁(7~70岁);骨肉瘤39例,软骨肉瘤3例,恶性纤维组织细胞瘤2例,骨巨细胞瘤2例,纤维肉瘤1例;肿瘤位于股骨远端者35例,胫骨近端者12例;合并病理性骨折1例。
骨肉瘤、恶性纤维组织细胞瘤患者术前均联合应用多柔比星、顺铂、长春新碱、异环磷酰胺及甲氨蝶呤进行化疗,给药2个疗程。定期复查血尿常规及肝、肾功能等以预防并发症的发生。化疗后,若病理检查肿瘤坏死程度<90%,术后化疗方案需进一步制订。
手术方法:取膝内侧切口,距瘤体以远5 cm处截骨,行后方剥离时需注意保护重要血管及神经,切除膝关节周围韧带,髌骨予以保留不行置换;于肢体残端扩髓,试装假体,进行调试,确定假体松紧合适及活动度满意后,行骨水泥固定,重建伸膝装置;充分冲洗切口,留置负压引流管,逐层缝合,关闭切口。
术后即指导患者进行踝泵功能锻炼。第2日可行股四头肌等长收缩锻炼。第3日依据引流量拔除引流管。术后1周开始膝关节屈伸功能锻炼。待切口愈合拆线后,骨肉瘤、恶性纤维组织细胞瘤患者行4~6个疗程化疗巩固疗效。
术后2年内每3个月随访1次,2年后每6个月随访1次,5年后每年随访1次。随访时复查患肢局部、肺部X线片或CT,并记录患者基本资料,包括生存时间、死亡时间、假体生存时间和并发症、肢体功能、肿瘤复发、肺转移等。总生存时间为从手术至死亡或末次随访时间;无瘤生存时间为从手术至转移或局部复发或末次随访时间;假体生存时间为从置换至翻修或截肢或末次随访时间。应用国际骨与软组织肿瘤协会(MSTS)评分系统进行功能评分,对于翻修或截肢患者,以初次假体置换保肢手术的末次随访为准;功能优为24~30分,良为18~23分,中为12~17分,差为<12分[6]。
应用SPSS 25.0软件对数据进行统计学分析。MSTS评分为非正态分布计量资料,以中位数(P25,P75)表示,两组间比较采用秩和检验;计数资料比较采用χ2检验;应用Kaplan-Meier法分析患者总生存、无瘤生存及假体生存,并行log-rank检验。以P<0.05为差异有统计学意义。
中位随访25个月(5~102个月)。患者1、3、5年总生存率分别为95.74%、71.29%、58.06%(图1);其中股骨远端肿瘤患者5年总生存率为46.21%,胫骨近端肿瘤患者为74.07%,差异无统计学意义(P=0.182)。患者1、3、5年无瘤生存率分别为86.42%、55.49%、50.86%(图2)。术后3年内,股骨远端肿瘤患者局部复发率、肺转移率与胫骨近端患者比较,差异均无统计学意义(均P>0.05)(表1)。
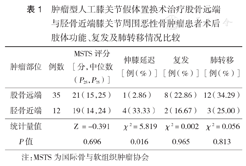
肿瘤型人工膝关节假体置换术治疗股骨远端与胫骨近端膝关节周围恶性骨肿瘤患者术后肢体功能、复发及肺转移情况比较
肿瘤型人工膝关节假体置换术治疗股骨远端与胫骨近端膝关节周围恶性骨肿瘤患者术后肢体功能、复发及肺转移情况比较
| 肿瘤部位 | 例数 | MSTS评分[分,中位数(P25,P75)] | 伸膝延迟[例(%)] | 复发[例(%)] | 肺转移[例(%)] |
|---|---|---|---|---|---|
| 股骨远端 | 35 | 21(15,25) | 1(2.86) | 8(22.86) | 12(34.29) |
| 胫骨近端 | 12 | 19(14,24) | 4(33.33) | 2(16.67) | 3(25.00) |
| 统计量值 | Z =-0.391 | χ2=5.819 | χ2=0.002 | χ2=0.056 | |
| P值 | 0.696 | 0.016 | 0.965 | 0.813 |
注:MSTS为国际骨与软组织肿瘤协会


47例患者中,10例(21.28%)出现肿瘤局部复发(其中8例软组织肿瘤复发者行肿瘤再切除,2例行截肢术),3例(6.38%)出现假体感染(1例感染后经清创置管冲洗治愈,2例行二期翻修),1例(2.13%)假体松动后翻修,1例(2.13%)假体断裂后翻修。假体5年总生存率为82.33%,其中股骨远端肿瘤患者假体5年总生存率为86.96%,胫骨近端肿瘤患者为75.00%,差异无统计学意义(P=0.338)(图3)。

在20世纪70年代以前,由于单纯肿瘤切除术后患者的复发率和死亡率高,截肢术成为当时治疗肢体恶性骨肿瘤的最主要方法[7]。但截肢术预后不尽如人意,不但降低了患者的生命质量,而且引起很多术后并发症,同时较难抑制肿瘤转移[8]。Ferrari和Palmerini[9]报道骨肉瘤患者截肢术后5年总生存率不足20%。为此诸多学者进行探索和研究。Rosen等[10]利用术前间隙给予患者化疗,以防止肿瘤进展,于1979年正式提出了新辅助化疗的概念。新辅助化疗可以清除全身潜在微小病灶,缩小原发肿瘤体积及反应带,为保肢术治疗恶性骨肿瘤提供了有效保证。目前新辅助化疗已经成为治疗恶性骨肿瘤的标准模式,它的实施是保肢术成功的关键[11]。虽然新辅助化疗提高了保肢率与生存率,但仍有患者对化疗不敏感、药物不耐受等情况存在。膝关节周围恶性骨肿瘤的保肢术包括机械重建和生物重建:机械重建即肿瘤型假体置换;生物重建即瘤段灭活再植,将自体或异体骨移植进行重建。相对于生物重建,机械重建后早期关节稳定,术后卧床时间减少,肢体功能更快恢复,并且患者更容易接受术后肢体外观。Wunder等[12]在膝关节恶性骨肿瘤切除后两种重建方法的比较研究中指出,肿瘤型膝关节假体置换比异体骨重建有更好和更可预测的效果。国内研究报道目前肿瘤假体置换由于较低的并发症发生率和较好的功能恢复,已成为保肢治疗的首选[13]。对于肿瘤型假体置换术,术前要根据化疗效果、影像学资料来确定截骨平面以及合适的假体;术中要完整切除肿瘤,包括瘤体、周围反应区及反应区外5 cm的正常组织;手术完成后,科学的康复锻炼和标准化的化疗也是相当关键的。
文献[14]报道肿瘤膝关节假体5年总生存率为57%~93%。本研究中假体5年总生存率为82.33%。我们发现胫骨近端肿瘤患者假体生存率要低于股骨远端肿瘤患者,但差异无统计学意义,其他研究也有相似的报道[14,15]。胫骨近端肿瘤切除后,一方面由于缺乏有效软组织覆盖,另一方面由于切除会破坏股四头肌-髌骨-胫骨粗隆构成的伸膝装置,故相对于股骨远端,胫骨近端肿瘤置换术对重建要求更高,但这会缩短此部位假体生存时间。关于重建伸膝装置,临床上有很多方法,包括将髌韧带直接固定在假体上以及将腓肠肌内侧头肌瓣前移和髌韧带固定等。髌韧带和金属假体之间的附着虽然一定程度上改善了伸膝功能,但它们之间并非生物固定,是不稳定、不可靠的[16]。有研究表明髌韧带与金属假体缝合连接处断裂造成再次手术的比例达到10%以上[17,18]。Malawer和McHale[19]认为将腓肠肌内侧头肌瓣前移与髌韧带缝合可形成稳定的生物固定,同时腓肠肌可覆盖缺损,降低切口并发症发生率。
肿瘤型膝关节假体相关并发症主要包括软组织衰竭、无菌性松动、感染、假体结构性失败、肿瘤进展等。临床中并发症通常并不单独存在,它们之间是相互影响的。术后软组织功能失调或缺陷可致肢体功能受损,即软组织衰竭,包括切口不愈合、血肿形成、腓神经损伤、髌骨半脱位、关节不稳定以及伸膝机制断裂等。这类并发症发生率较低,且不一定会导致假体置换失败。
无菌性松动是长期随访中最常见的并发症[20,21],在短中期随访中相对少见。本研究中1例患者出现假体无菌性松动,发生率为2.13%,与文献[22]报道(2%~17%)一致。无菌性松动的原因包括劣质骨水泥固定、过多的活动、金属假体减震能力差、接触面应力异常集中等。为防止假体松动,李伟栩等[23]利用自体或异体骨制成皮质外骨桥,可转移金属假体与骨接触应力,将骨水泥与假体磨损碎屑相隔离,获得良好效果。
置换术后肿瘤型膝关节假体感染发生率为2%~12%[24]。本研究中假体感染发生率为6.38%。国外学者Henderson等[25]报道感染是引起假体置换失败的最主要因素。近年国内研究表明感染已成为肿瘤型膝关节假体置换失败的主要原因[26,27]。引起假体感染的原因包括放化疗免疫抑制、软组织切除多、残腔大、积血、积液以及手术时间长等[28]。术后患者患膝出现疼痛、红肿、皮温增高甚至窦道形成,应高度怀疑为假体感染。确定感染后可行抗生素保守治疗,若无效,需行清创及一期或二期翻修。
假体结构性失败包括以下3个方面:(1)假体断裂通常发生在假体柄部和股骨假体髁部。郭卫等[29]对100例患者行肿瘤型假体重建后跟踪随访,发现6例患者发生假体断裂,这与假体材料质量、假体柄粗细以及假体所受应力有关。本研究中1例患者术后75个月发生假体断裂,发生率为2.13%,低于文献[30,31]报道(3%~10%)。(2)假体周围骨折发生率低,患者通常具有外伤史,术中组织切除范围大,假体与骨之间存在弹性模量差,导致应力在骨与假体接触界面过于集中而发生骨折。术后患者应适量活动,避免外伤,若发生假体周围骨折需使用钛缆、钢板、记忆合金环抱器等进行内固定。(3)随着假体使用时间延长,衬垫磨损风险也逐步增高,其风险取决于金属-衬垫界面的载荷和扭转应力以及衬垫材料的耐磨性[32]。Myers等[33]对335例股骨远端假体重建病例进行回顾性研究发现,有16%的患者需要一次甚至多次更换衬垫,而年轻患者几乎不可避免。衬垫磨损后要进行更换,否则可引起松动等其他并发症。本研究无假体周围骨折及衬垫磨损病例。
肿瘤局部复发是保肢术不可避免的严重并发症,其可污染内植假体,导致假体摘除、截肢。本研究47例患者中,10例出现肿瘤局部复发,8例行肿瘤再切除,2例行截肢治疗。为防止肿瘤局部复发,需要避免术中手术器械直接接触肿瘤,广泛完整切除肿瘤,施行有效放化疗。
本研究中股骨远端肿瘤患者MSTS评分高于胫骨近端患者;胫骨近端伸膝延迟发生率高于股骨远端。这是由于胫骨近端肿瘤切除后需要重建髌韧带止点,造成伸膝装置强度、力量减弱。重建后,患肢需伸直位制动,在伸膝装置结合牢固后进行膝关节锻炼,过早锻炼会使伸膝装置破裂,过晚锻炼则会影响功能恢复。
文献[34]报道肿瘤部位是影响恶性骨肿瘤预后的重要因素。胫骨近端肿瘤预后明显好于其他部位,这与胫骨近端软组织覆盖少,容易早期发现肿瘤有关。本研究中胫骨近端肿瘤患者5年总生存率(74.07%)高于股骨远端肿瘤患者(46.21%)。是否合并病理骨折及化疗灵敏性也是影响肿瘤学预后的因素。本研究中仅1例患者合并病理骨折。骨肉瘤、恶性纤维组织细胞瘤患者采用多剂量联合新辅助和辅助化疗。术后患者生存率和肢体功能总体满意。
总之,使用肿瘤型人工膝关节假体进行保肢手术是治疗膝关节周围恶性骨肿瘤的一个很好的选择,该技术能保持良好的肢体功能和较高的患者生存率、假体生存率,但也要防止术后并发症的出现。
所有作者均声明不存在利益冲突



























