
探讨尿液核基质蛋白22(NMP22)联合膀胱肿瘤抗原(BTA)检测在膀胱癌诊断中的价值,为膀胱癌的早期筛查提供实验室依据。
回顾性分析2018年8月至2019年7月陕西省宝鸡市中心医院收治的315例疑似膀胱癌患者的临床病理资料,其中经手术病理或膀胱镜活组织检查确诊为膀胱癌248例,泌尿系统良性疾病67例;同时选择同期体检健康者100名作为健康对照组。采用酶联免疫吸附试验(ELISA)检测尿液NMP22和BTA水平。
膀胱癌组、泌尿系统良性疾病组和健康对照组尿液NMP22表达水平分别为(28.4±8.8)ng/ml、(12.7±3.0)ng/ml、(4.3±1.5)ng/ml,差异具有统计学意义(F=26.41,P<0.05);BTA表达水平分别为(25.1±8.1)ng/ml、(10.4±2.9)ng/ml、(6.4±2.4)ng/ml,差异具有统计学意义(F=23.62,P<0.05)。不同TNM分期、病理分级的膀胱癌患者尿液NMP22和BTA表达水平比较,差异均具有统计学意义(均P<0.05)。尿液NMP22和BTA联合检测的受试者工作特征曲线下面积、灵敏度、阴性预测值分别为0.895、96.98%和61.11%,均高于其单项检测,差异均具有统计学意义(均P<0.05)。NMP22和BTA诊断膀胱癌的cut-off值分别为32.42 ng/ml和29.13 ng/ml。
尿液NMP22和BTA联合检测对膀胱癌诊断具有较高的临床价值,检测具有简便、快速、无创、批量筛查等优点,值得在临床上推广。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
膀胱癌作为泌尿系统最常见的恶性肿瘤,具有多中心、易复发及浸润性生长等特征,其发病率和死亡率呈逐年上升趋势[1,2]。膀胱癌难诊断、易复发、进展快、治疗费用高,尽早诊断及治疗是降低膀胱癌死亡率和提高患者生命质量的关键。目前诊断膀胱癌的金标准是膀胱镜检查,虽然诊断率较高,但属于有创操作,患者耐受性差,不适合用于普查。尿液脱落细胞学检查虽简便,但灵敏度较低[3]。B型超声、CT诊断肌层浸润性膀胱癌准确率较低,难以发现原位癌[4]。尿液核基质蛋白22(NMP22)作为核基质蛋白家族特殊的一员,与膀胱癌的进展程度呈正相关,可以作为膀胱癌诊断的标志物[5]。膀胱肿瘤抗原(BTA)是一种膀胱镜的补充检测手段,是诊断膀胱癌的敏感标志物[6]。目前NMP22及BTA联合诊断膀胱癌鲜有报道。本研究旨在探讨NMP22联合BTA检测对膀胱癌的诊断价值。
纳入标准:(1)病历资料完整;(2)膀胱癌诊断结论系手术病理或膀胱镜活组织检查确诊。排除标准:(1)心、肝、肺等脏器严重受损者;(2)存在除膀胱以外其他部位原发性肿瘤、转移癌或良性病变者;(3)膀胱良性疾病患者;(4)长期化疗、放疗患者;(5)病历资料不完整者。
选择2018年8月至2019年7月陕西省宝鸡市中心医院泌尿外科收治的315例疑似膀胱癌患者为研究对象,所有患者病历资料完整,且均为未经治疗的初诊患者。后经手术病理或膀胱镜活组织检查证实为膀胱癌248例和泌尿系统良性疾病67例。膀胱癌组男性149例,女性99例,年龄(61±14)岁,年龄范围35~87岁;TNM分期依据美国癌症联合委员会(AJCC)标准,Ⅰ期65例,Ⅱ期83例,Ⅲ期59例,Ⅳ期41例;病理分级依据世界卫生组织(WHO)标准,低级别152例,高级别96例。泌尿系统良性疾病组中,男性38例,女性29例,年龄(60±15)岁,年龄范围28~85岁;其中膀胱炎41例,泌尿系统结石22例,膀胱息肉3例,乳头状瘤1例。同时选择同期体检健康者100名作为健康对照组,包括男性60名,女性40名,年龄(61±15)岁,年龄范围25~85岁。三组年龄、性别比较差异均无统计学意义(均P>0.05)。本研究通过陕西省宝鸡市中心医院医学伦理委员会批准[批准文号:(2019)No. 312],所有患者均签署知情同意书。
收集晨起清洁中段尿液5 ml,离心半径8 cm,2 000 r/min离心5 min,取上清液,-20 ℃保存备用。尿液NMP22和BTA检测均采用酶联免疫吸附试验(ELISA),NMP22试剂盒由武汉华美生物工程有限公司提供,BTA试剂盒由美国BPB生物公司提供。所有检测操作步骤均按试剂盒说明书执行。酶标仪RT-6100和洗板机RT-3100均由深圳雷杜生命科学股份有限公司提供。
采用SPSS 19.0统计学软件对数据进行处理。计量资料符合正态分布,以均数±标准差( ±s)表示,多组间比较采用方差分析,两组间比较采用t检验;计数资料比较采用χ2检验;采用受试者工作特征(ROC)曲线分析诊断效能。以P<0.05为差异具有统计学意义。
±s)表示,多组间比较采用方差分析,两组间比较采用t检验;计数资料比较采用χ2检验;采用受试者工作特征(ROC)曲线分析诊断效能。以P<0.05为差异具有统计学意义。
膀胱癌组、泌尿系统良性疾病组和健康对照组尿液NMP22和BTA水平比较,差异均具有统计学意义(均P<0.05)(表1)。
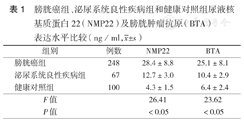
膀胱癌组、泌尿系统良性疾病组和健康对照组尿液核基质蛋白22(NMP22)及膀胱肿瘤抗原(BTA)表达水平比较(ng/ml, ±s)
±s)
膀胱癌组、泌尿系统良性疾病组和健康对照组尿液核基质蛋白22(NMP22)及膀胱肿瘤抗原(BTA)表达水平比较(ng/ml, ±s)
±s)
| 组别 | 例数 | NMP22 | BTA |
|---|---|---|---|
| 膀胱癌组 | 248 | 28.4±8.8 | 25.1±8.1 |
| 泌尿系统良性疾病组 | 67 | 12.7±3.0 | 10.4±2.9 |
| 健康对照组 | 100 | 4.3±1.5 | 6.4±2.4 |
| F值 | 26.41 | 23.62 | |
| P值 | <0.05 | <0.05 |
不同TNM分期和病理分级的膀胱癌患者尿液NMP22和BTA水平组间比较,差异均具有统计学意义(均P<0.05)(表2、表3)。
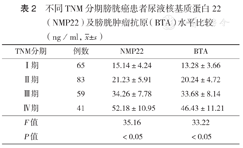
不同TNM分期膀胱癌患者尿液核基质蛋白22 (NMP22)及膀胱肿瘤抗原(BTA)水平比较(ng/ml, ±s)
±s)
不同TNM分期膀胱癌患者尿液核基质蛋白22 (NMP22)及膀胱肿瘤抗原(BTA)水平比较(ng/ml, ±s)
±s)
| TNM分期 | 例数 | NMP22 | BTA |
|---|---|---|---|
| Ⅰ期 | 65 | 15.14±4.24 | 13.28±3.66 |
| Ⅱ期 | 83 | 21.23±5.91 | 20.24±4.72 |
| Ⅲ期 | 59 | 34.26±7.78 | 33.68±8.14 |
| Ⅳ期 | 41 | 52.18±10.95 | 46.43±11.21 |
| F值 | 35.16 | 33.22 | |
| P值 | <0.05 | <0.05 |
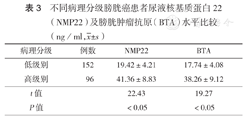
不同病理分级膀胱癌患者尿液核基质蛋白22(NMP22)及膀胱肿瘤抗原(BTA)水平比较(ng/ml, ±s)
±s)
不同病理分级膀胱癌患者尿液核基质蛋白22(NMP22)及膀胱肿瘤抗原(BTA)水平比较(ng/ml, ±s)
±s)
| 病理分级 | 例数 | NMP22 | BTA |
|---|---|---|---|
| 低级别 | 152 | 19.42±4.21 | 17.74±4.08 |
| 高级别 | 96 | 41.36±8.83 | 38.26±9.12 |
| t值 | 22.43 | 19.27 | |
| P值 | <0.05 | <0.05 |
尿液NMP22和BTA联合检测的ROC曲线下面积(AUC)、灵敏度、阴性预测值均高于单项检测,差异均具有统计学意义(均P<0.05),NMP22和BTA诊断膀胱癌的cut-off值分别为32.42 ng/ml和29.13 ng/ml(表4)。
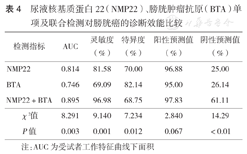
尿液核基质蛋白22(NMP22)、膀胱肿瘤抗原(BTA)单项及联合检测对膀胱癌的诊断效能比较
尿液核基质蛋白22(NMP22)、膀胱肿瘤抗原(BTA)单项及联合检测对膀胱癌的诊断效能比较
| 检测指标 | AUC | 灵敏度(%) | 特异度(%) | 阳性预测值(%) | 阴性预测值(%) |
|---|---|---|---|---|---|
| NMP22 | 0.814 | 81.58 | 70.00 | 96.88 | 25.00 |
| BTA | 0.746 | 69.09 | 82.14 | 95.00 | 26.14 |
| NMP22+BTA | 0.895 | 96.98 | 68.75 | 97.83 | 61.11 |
| χ2值 | 8.291 | 9.140 | 7.234 | 2.840 | 14.29 |
| P值 | 0.003 | 0.001 | 0.012 | 0.067 | <0.01 |
注:AUC为受试者工作特征曲线下面积
膀胱癌是发生于膀胱黏膜上皮的恶性肿瘤,其发病率居我国泌尿系统肿瘤的首位[7]。因早期缺乏典型的临床症状和体征,常易出现漏诊或误诊,延误最佳治疗时机。目前,诊断膀胱癌的方法众多,如常规检查、影像学检查、膀胱镜检查、尿脱落细胞检测、血清标志物检测等,但在诊断灵敏度、特异度、准确度、患者耐受性等方面存在很大差异。因此迫切需要寻求一种快速、简便、无创、灵敏度和特异度高的方法或指标提高膀胱癌的诊断率。
NMP22作为构成细胞核内部结构的重要部分,参与了基因的表达和调节。NMP22大多存在于增殖活跃的癌变上皮细胞中,当细胞凋亡时,可随尿液排出体外而被检测到。据报道,膀胱癌上皮细胞内NMP22的表达量是正常细胞的25倍[8]。因此,NMP22可被视为尿路上皮特异性的肿瘤标志物。而且,有研究已经证实,NMP22检测的阳性率较尿脱落细胞学阳性率高,对于膀胱癌的早期诊断及预防更有意义[9]。本研究结果显示,NMP22水平在膀胱癌组、泌尿系统良性疾病组和健康对照组之间差异有统计学意义(P<0.05),表明NMP22检测可用于膀胱良、恶性疾病的鉴别诊断,对于早期膀胱癌的筛查具有十分重要的临床价值。本研究对膀胱癌组患者进行TNM分期和病理分级后的进一步研究发现,随着膀胱癌TNM分期递增和病理分级级别增高,NMP22水平快速升高,各组之间差异均有统计学意义(均P<0.05),表明尿液NMP22检测可用于预测疾病的分期、分级及疾病发展的严重程度,对于疾病进展的辅助诊断具有一定的临床价值。尿液NMP22诊断膀胱癌的灵敏度为81.58%,特异度为70.00%,这与Rouprêt等[10]报道的灵敏度78.2%、特异度69.6%基本一致。本研究结果显示,NMP22预测膀胱癌的cut-off值为32.42 ng/ml。
BTA是由(16~165)×103的特异性多肽组成,系膀胱肿瘤细胞分泌的基底蛋白与基底膜表面蛋白受体结合后,所释放蛋白水解酶破坏基底膜产生的碎片进入膀胱聚合成的高分子复合物。Miyanaga等[11]研究显示,BTA检测膀胱癌的灵敏度显著高于尿细胞学,尤其对孤立的、小体积的、浅表肿瘤更敏感。本研究结果显示,BTA水平在膀胱癌组、泌尿系统良性疾病组和健康对照组之间差异有统计学意义(P<0.05),提示BTA检测亦可用于膀胱良、恶性疾病的鉴别诊断。通过对膀胱癌组患者进行TNM分期和病理分级后的进一步研究发现,随着膀胱癌TNM分期递增和病理分级级别增高,BTA水平逐渐升高,各组之间差异均有统计学意义(均P<0.05),表明尿液BTA检测可用于膀胱癌的分期、分级及预测疾病发展的严重程度。尿液BTA诊断膀胱癌的灵敏度为69.09%,较NMP22低,表明在早期诊断方面较差;诊断膀胱癌的特异度为82.14%,较NMP22高,表明在疾病排除方面优于NMP22。但有报道显示,BTA检测的假阳性率较高,限制了其在临床中的广泛应用[12,13]。本研究结果显示,BTA预测膀胱癌的cut-off值为29.13 ng/ml。我们在统计资料时也发现,在严重血尿情况下,如泌尿系炎症、泌尿系结核、肾结石、膀胱乳头状瘤等泌尿系统良性疾病和肾细胞癌、膀胱类癌等恶性肿瘤时,BTA检测结果高于参考区间上限。因此,BTA不能作为膀胱癌早期诊断的确诊依据,只能作为一种筛查手段。本研究NMP22和BTA联合诊断膀胱癌的AUC为0.895,灵敏度为96.98%,均高于单项检测(P<0.05),但联合检测的特异度降低。表明联合检测可提高膀胱癌诊断的准确度,降低漏诊率。
综上所述,尿液NMP22和BTA都是诊断及辅助诊断膀胱癌的重要标志物,二者检测具有简便、快速、无创、批量筛查等优点。因NMP22和BTA诊断性能各有优劣,将二者联合后可提高检测的灵敏度和准确度,降低漏诊率,对于膀胱癌的早期筛查是一组较好的指标,值得在临床上推广。
所有作者均声明不存在利益冲突



























