
探讨化疗联合贝伐珠单抗治疗老年晚期肺腺癌患者的效果及安全性。
回顾性分析2015年1月至2018年9月山东省肿瘤医院199例老年晚期肺腺癌患者资料,其中104例接受化疗联合贝伐珠单抗治疗(联合组),95例接受单纯化疗(化疗组)。评估两组患者的客观反应率(ORR)、疾病控制率(DCR)、总生存(OS)及无进展生存(PFS)。
治疗2个周期后第1次评价疗效,联合组部分缓解(PR)42例,疾病稳定(SD)50例,疾病进展(PD)12例,ORR为40.4%(42/104),DCR为88.5%(92/104);化疗组PR 22例,SD 64例,PD 9例,ORR为23.2%(22/95),DCR为86.9%(86/95);联合组ORR高于化疗组,差异有统计学意义(χ2=6.75,P<0.05)。联合组和化疗组的中位PFS时间分别为7.1个月(95%CI 6.8~7.5个月)和5.6个月(95% CI 5.1~6.1个月),差异有统计学意义(P<0.01);中位OS时间分别为15.3个月(95%CI 14.2~16.4个月)和12.4个月(95% CI 10.8~14.0个月),差异有统计学意义(P<0.01)。联合组和化疗组≥Ⅲ级不良反应发生率分别为81.7%(85/104)和80.0%(76/95),差异无统计学意义(χ2=0.10,P=0.76)。
老年晚期肺腺癌患者在化疗的基础上加用贝伐珠单抗可以获得更好的预后。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺癌是目前所有恶性肿瘤中发病率和死亡率最高的肿瘤,而我国肺癌的发病率还在不断升高[1,2]。化疗是晚期非小细胞肺癌(NSCLC)重要的治疗方法[3]。随着基因检测技术的发展,许多具有表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)和ROS原癌基因1(ROS1)等突变的患者可通过使用分子靶向药物进一步延长无进展生存(PFS)和总生存(OS)时间[4,5,6]。同时,免疫治疗也逐步进入临床[7,8,9,10,11,12]。但是并非所有患者都存在基因突变,即使应用酪氨酸激酶抑制剂(TKI),患者耐药后仍需接受化疗,而且由于免疫疗法价格昂贵,难以普及应用,其能否完全替代化疗还需要进一步研究。目前采用含铂方案化疗仍是晚期肺腺癌的主要治疗手段。贝伐珠单抗是一种重组人源化IgG1抗体,其可降低肿瘤间质高血压,从而使治疗药物更有效地输送到肿瘤中[13]。但是,贝伐珠单抗联合含铂双药化疗能否提高老年患者的临床获益一直是研究者们讨论的问题。本研究探讨化疗联合贝伐珠单抗治疗老年晚期肺腺癌患者的有效性和安全性。
纳入标准:(1)确诊为肺腺癌;(2)年龄≥65岁;(3)病理分期为ⅢB、ⅢC或Ⅳ期,无手术切除指征;(4)无颅脑转移或无颅脑转移指征。排除标准:(1)病历资料缺失或失访;(2)治疗2个周期后未行疗效评价;(3)入院时已有严重的肝肾疾病或心血管疾病,无法进行抗肿瘤治疗。
回顾性分析2015年1月至2018年9月山东省肿瘤医院199例老年晚期肺腺癌患者资料,患者中位年龄72岁(65~85岁),其中65~74岁114例,≥75岁85例;男性67例,女性132例;有吸烟史67例,无吸烟史132例;病理分期ⅢB、ⅢC期43例,Ⅳ期156例。根据治疗方案,104例(52.3%)接受培美曲塞、卡铂、贝伐珠单抗联合方案一线治疗(联合组),95例(47.7%)接受培美曲塞、卡铂方案化疗(化疗组)。两组患者基线特征比较,差异均无统计学意义(均P>0.05)(表1)。本研究符合《赫尔辛基宣言》的要求,且经山东省肿瘤医院医学伦理委员会批准,患者均知情同意。
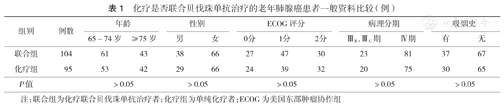
化疗是否联合贝伐珠单抗治疗的老年肺腺癌患者一般资料比较(例)
化疗是否联合贝伐珠单抗治疗的老年肺腺癌患者一般资料比较(例)
| 组别 | 例数 | 年龄 | 性别 | ECOG评分 | 病理分期 | 吸烟史 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 65~74岁 | ≥75岁 | 男 | 女 | 0分 | 1分 | 2分 | ⅢB、ⅢC期 | Ⅳ期 | 有 | 无 | ||
| 联合组 | 104 | 61 | 43 | 38 | 66 | 27 | 47 | 30 | 23 | 81 | 37 | 67 |
| 化疗组 | 95 | 53 | 42 | 29 | 66 | 24 | 39 | 32 | 20 | 75 | 30 | 65 |
| P值 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | |||||||
注:联合组为化疗联合贝伐珠单抗治疗者;化疗组为单纯化疗者;ECOG为美国东部肿瘤协作组
化疗组:培美曲塞500 mg/m2,第1天;卡铂按曲线下面积(AUC)=5计算剂量,第1天,每3周重复。联合组:在化疗组基础上加用贝伐珠单抗7.5 mg/kg,第1天,每3周重复。每2个周期进行一次CT检查,治疗持续至患者出现无法耐受的不良反应或疾病进展(PD)。
根据实体瘤疗效评价标准(RECIST 1.1)评价疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和PD。客观缓解率(ORR)以CR+PR计算,疾病控制率(DCR)以CR+PR+SD计算。PFS时间为第1次治疗至PD或死亡或末次随访的时间,OS时间为第1次治疗至死亡或末次随访的时间。不良反应评价根据美国国立癌症研究所不良反应通用术语标准(NCI-CTCAE)5.0版,分为0~Ⅳ级。
采用SPSS 19.0软件进行统计学分析。计数资料的比较采用χ2检验;生存分析采用Kaplan-Meier法,行log-rank检验。以P<0.05为差异有统计学意义。
治疗2个周期后评价疗效,联合组PR 42例,SD 50例,PD 12例,ORR为40.4%(42/104),DCR为88.5%(92/104);化疗组PR 22例,SD 64例,PD 9例,ORR为23.2%(22/95),DCR为86.9%(86/95);联合组ORR高于化疗组,差异有统计学意义(χ2=6.75,P<0.05)。在65~74岁患者中,联合组61例,PR 36例,SD 19例,PD 6例,ORR为59.0%(36/61),DCR为90.2%(55/61);化疗组53例,PR 16例,SD 34例,PD 3例,ORR为30.2%(16/53),DCR为94.3%(50/53);联合组ORR高于化疗组,差异有统计学意义(χ2=11.94,P<0.05)。在≥75岁患者中,联合组43例,PR 6例,SD 31例,PD 6例,ORR为14.0%(6/43),DCR为86.0%(37/43);化疗组42例,PR 6例,SD 30例,PD 6例,ORR为14.3%(6/42),DCR为85.7%(36/42)。
随访截至2019年6月30日。联合组的中位PFS时间为7.1个月(95%CI 6.8~7.5个月),化疗组为5.6个月(95%CI 5.1~6.1个月),差异有统计学意义(P<0.05)(图1A)。在65~74岁患者中,联合组与化疗组中位PFS时间分别为7.5个月(95%CI 7.4~7.6个月)和6.1个月(95%CI 5.3~6.3个月),差异有统计学意义(P<0.05)(图1B);在≥75岁患者中,联合组与化疗组中位PFS时间分别为6.4个月(95%CI 5.8~7.0个月)和5.4个月(95%CI 4.7~6.1个月),差异有统计学意义(P=0.04)(图1C)。联合组的中位OS时间为15.3个月(95%CI 14.2~16.4个月),化疗组为12.4个月(95%CI 10.8~14.0个月),差异有统计学意义(P<0.01)(图2A)。在65~74岁患者中,联合组和化疗组中位OS时间分别为16.4个月(95%CI 14.9~17.9个月)和13.5个月(95%CI 11.5~15.5个月),差异有统计学意义(P=0.01)(图2B);在≥75岁患者中,联合组和化疗组中位OS时间分别为14.1个月(95%CI 11.8~16.4个月)和10.5个月(95%CI 10.0~11.0个月),差异有统计学意义(P=0.03)(图2C)。
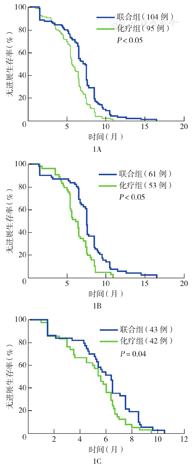

注:联合组为化疗联合贝伐珠单抗治疗者;化疗组为单纯化疗者
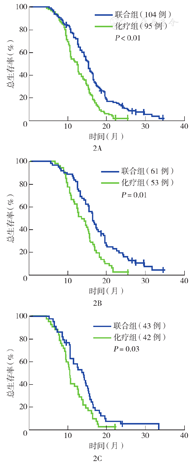

注:联合组为化疗联合贝伐珠单抗治疗者;化疗组为单纯化疗者
所有患者在治疗过程中最常见的不良反应是胃肠道反应、白细胞减少、中性粒细胞减少、贫血和血小板减少,两组各不良反应发生率差异均无统计学意义(均P>0.05)(表2)。联合组和化疗组≥Ⅲ级不良反应发生率分别为81.7%(85/104)和80.0%(76/95),差异无统计学意义(χ2=0.10,P=0.76)。两组均无致命性不良反应发生。
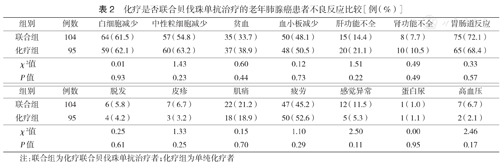
化疗是否联合贝伐珠单抗治疗的老年肺腺癌患者不良反应比较[例(%)]
化疗是否联合贝伐珠单抗治疗的老年肺腺癌患者不良反应比较[例(%)]
| 组别 | 例数 | 白细胞减少 | 中性粒细胞减少 | 贫血 | 血小板减少 | 肝功能不全 | 肾功能不全 | 胃肠道反应 |
|---|---|---|---|---|---|---|---|---|
| 联合组 | 104 | 64(61.5) | 57(54.8) | 35(33.7) | 50(48.1) | 15(14.4) | 8(7.7) | 75(72.1) |
| 化疗组 | 95 | 59(62.1) | 60(63.2) | 37(38.9) | 48(50.5) | 20(21.1) | 10(10.5) | 65(68.4) |
| χ2值 | 0.01 | 1.43 | 0.60 | 0.12 | 1.51 | 0.49 | 0.33 | |
| P值 | 0.93 | 0.23 | 0.44 | 0.73 | 0.22 | 0.49 | 0.57 |
| 组别 | 例数 | 脱发 | 皮疹 | 肌痛 | 疲劳 | 感觉异常 | 蛋白尿 | 高血压 |
|---|---|---|---|---|---|---|---|---|
| 联合组 | 104 | 6(5.8) | 7(6.7) | 22(21.2) | 47(45.2) | 12(11.5) | 1(1.0) | 7(6.7) |
| 化疗组 | 95 | 4(4.2) | 3(3.2) | 18(18.9) | 50(52.6) | 5(5.3) | 1(1.1) | 2(2.1) |
| χ2值 | 0.25 | 1.33 | 0.15 | 1.10 | 2.50 | 0.00 | 2.46 | |
| P值 | 0.61 | 0.25 | 0.70 | 0.29 | 0.11 | 0.95 | 0.17 |
注:联合组为化疗联合贝伐珠单抗治疗者;化疗组为单纯化疗者
贝伐珠单抗已在临床使用多年,ECOG4599对878例晚期NSCLC患者进行的随机试验显示[14],卡铂-紫杉醇联合贝伐珠单抗治疗NSCLC比卡铂-紫杉醇有显著的生存获益,后者开创了化疗联合贝伐珠单抗治疗NSCLC的时代。之后,AVAIL和SAiL等临床试验相继启动,还有专门针对中国患者的Beyond试验和针对亚洲人群的SAiL试验[15,16,17]。这些试验结果显示,贝伐珠单抗在有效改善化疗效果的同时不会增加不良反应。然而大型回顾性分析显示,贝伐珠单抗对65岁以上患者疗效不显著[18],这可能会导致这些老年患者失去使用贝伐珠单抗的机会。与之不同的是,在Beyond研究中,贝伐珠单抗可使≥65岁患者显著受益。
本研究结果显示,在≥65岁的晚期肺腺癌患者中,联合组中位PFS时间为7.1个月,比化疗组延长1.5个月;联合组中位OS时间为15.3个月,比化疗组延长2.9个月,差异均有统计学意义,表明贝伐珠单抗对我国老年晚期肺腺癌患者的PFS和OS是有利的。我们对患者的年龄段进行了分层分析,结果与总体样本结果一致,老年患者均可受益于培美曲塞/卡铂+贝伐珠单抗方案。本研究的PFS和OS还没有达到Beyond研究的水平,可能与本研究对象为老年患者有关,与Beyond研究纳入全年龄层患者相比,老年患者往往伴有其他基础疾病,耐受性相对更差[19],但本研究结果表明加用贝伐珠单抗能延长患者PFS和OS时间。
在安全性方面,加入贝伐珠单抗并未增加患者的不良反应,仅有7例出现高血压,1例出现蛋白尿,无上消化道出血等不良反应。可见,在老年晚期肺腺癌患者中使用培美曲塞/卡铂+贝伐珠单抗是可以耐受的。本研究得出了与Beyond研究相同的结论,即对于老年肺腺癌患者,在培美曲塞/卡铂的化疗方案中加入贝伐珠单抗可有效改善PFS及OS。同时,由于本研究样本量有限,所得结论需要进一步验证。
所有作者均声明不存在利益冲突



























