
评价右美托咪定不同给药方式对胃癌根治术老年患者围术期认知功能及Ramsay镇静评分的影响。
选择2018年12月至2019年12月山西省肿瘤医院择期拟行胃癌根治术的65~75岁患者150例,采用随机数字表法分为右美托咪定不同给药方式组(A组和B组)及对照组(C组),每组50例。麻醉诱导前,A组、B组分别静脉泵注0.5 μg·kg-1·h-1和0.3 μg·kg-1·h-1右美托咪定15 min,C组静脉泵注等负荷剂量的0.9% NaCl溶液15 min;随后A组和B组均以0.3 μg·kg-1·h-1的剂量持续静脉泵注右美托咪定至术毕前30 min,C组泵注等负荷剂量的0.9% NaCl溶液至术毕。采用蒙特利尔认知评估(MoCA)量表评价三组术前1天及术后第1、3、7天的认知功能,统计围术期神经认知障碍(PND)发生率;比较三组术后30 min及术后24、48 h的Ramsay镇静评分。
A组3例及C组3例因术后出现严重并发症转入重症监护室而出组。三组间术后第1、3、7天MoCA量表评分差异均有统计学意义(均P<0.01),其中A、B、C组术后第7天MoCA量表评分分别为(26.9±0.7)分、(26.6±1.0)分和(26.3±1.2)分,A组和C组间差异有统计学意义(P<0.01)。三组间术后第1、3、7天PND发生率差异均有统计学意义(均P<0.05),其中A组均低于B组和C组,差异均有统计学意义(均P<0.05)。三组术后30 min及术后24、48 h的Ramsay镇静评分差异均有统计学意义(均P<0.01),其中C组均低于A组和B组,差异均有统计学意义(均P<0.01);A组术后24 h的Ramsay评分均高于B组和C组(均P<0.01)。
右美托咪定辅助麻醉可减少胃癌根治术老年患者PND的发生,增强镇静效果,其中麻醉诱导前以0.5 μg·kg-1·h-1剂量给药效果最明显。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
围术期神经认知障碍(PND)是一种常见的手术麻醉并发症,以记忆、注意力、语言理解和社交能力的损伤为特征,包括术前和术后发生的所有围术期认知功能改变[1]。1955年Bedford[2]提出全身麻醉术后老年患者会出现认知障碍,随后多项研究也发现患者出现认知障碍与麻醉及手术有密切关系,并且术后的认知障碍多发生于65岁以上老年人群[3,4]。有研究证实右美托咪定能抑制炎症反应的发展,从而减少PND的发生[5,6,7]。目前右美托咪定改善老年患者术后认知功能的研究报道较多,但右美托咪定辅助麻醉的不同给药方式与PND关系的研究较少。本研究拟评价右美托咪定不同给药方式对老年胃癌根治术患者PND的影响,并确定给药的最佳时机及剂量,同时观察右美托咪定辅助麻醉对Ramsay镇静评分的影响,为临床提供参考。
纳入标准:年龄65~75岁;体质量指数(BMI)18~24 kg/m2;美国麻醉医师协会(ASA)分级Ⅰ、Ⅱ级;受教育程度为小学以上。排除标准:既往有精神疾病或家族史;长期酗酒或服用抗精神疾病药物;有引起脑功能障碍的神经系统疾病,如脑卒中、帕金森病、脑肿瘤等;空腹血糖>11.1 mmol/L;有严重肝、肾、心功能不全;有严重视觉、听觉或运动障碍,无法交流;有麻醉药物过敏史;有头部外伤史;术前1个月使用激素类药物史;术前蒙特利尔认知评估量表(MoCA)评分<26分;受教育程度低于小学水平。选择2018年12月至2019年12月山西省肿瘤医院行胃癌根治术患者150例,采用随机数字表法分为右美托咪定不同给药方式组(A组和B组)及对照组(C组),每组50例。本研究通过山西省肿瘤医院伦理委员会批准,患者及家属均签署知情同意书。
三组患者进入手术室后开放静脉通路,常规监测心电图(ECG)、心率(HR)、血压(BP)、脉搏、血氧饱和度(SpO2)。麻醉诱导前,A组、B组分别静脉泵注0.5 μg·kg-1·h-1和0.3 μg·kg-1·h-1右美托咪定(连云港恒瑞医药股份有限公司,规格为2 ml∶200 μg)15 min,C组静脉泵注等负荷剂量的0.9% NaCl溶液15 min。泵注完毕对三组患者进行麻醉诱导,均予0.04~0.06 μg/kg枸橼酸舒芬尼注射液(宜昌人福药业有限责任公司,规格为1 ml∶50 μg)、0.1~0.2 mg/kg依托咪酯脂肪乳注射液(徐州恩华药业股份有限公司,规格为10 ml∶20 mg)和0.2~0.3 mg/kg顺式阿曲库铵(上药东英江苏药业有限公司,规格:5 mg),全身麻醉诱导。随后气管内插管,连接麻醉机,设置呼吸频率为10~12次/min,潮气量为8~12 ml/kg,呼气末二氧化碳分压维持在35~45 mmHg(1 mmHg=0.133 kPa);之后A组和B组均持续静脉泵注0.3 μg·kg-1·h-1右美托咪定至术毕前30 min,C组泵注等负荷剂量0.9% NaCl溶液至术毕前30 min。
麻醉维持:所有患者术中静脉泵注丙泊酚4~8 mg·kg-1·h-1(北京费森尤斯卡比医药有限公司,规格为20 mg∶200 ml)和顺式阿曲库铵0.06~0.12 mg·kg-1·h-1,持续静脉泵入瑞芬太尼0.1~0.2 μg·kg-1·h-1。手术结束,待三组患者自主呼吸恢复(潮气量>8 ml/kg)、无吸氧状态2 min后,保持SpO2>95%,拔除气管导管。观察5 min,如患者生命体征平稳,送麻醉恢复室进行常规吸氧监测。
手术前后应用针对老年人轻度认知损害(MCI)筛查的MoCA量表(北京版)对患者进行认知能力测定[8],量表从视空间与执行能力、命名、记忆、注意、语言流畅、抽象思维、延迟记忆、定向力等方面全面评估认知功能,记录三组患者麻醉术前1天及术后第1、3、7天的认知能力。MoCA量表评分<26分或术后MoCA评分比术前下降≥2分时认为存在认知功能障碍[8,9,10]。所有认知功能测试均由具有心理学专业资质的同一名研究者进行。
Ramsay镇静评分:分别记录术后30 min及24、48 h的Ramsay镇静评分,得分范围为1~6分。6分:处于麻醉状态或深睡,呼唤无反应;5分:对外界刺激反应迟钝;4分:睡眠状态但可唤醒;3分:较嗜睡,对指令反应敏捷但发音含糊;2分:平静配合;1分:焦躁[11,12]。记录三组患者的麻醉时间、手术时间、术中补液量、出液量等。
采用SPSS 19.0统计学软件分析数据,计数资料组间比较采用χ2检验;计量资料符合正态分布,用均数±标准差( ±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
A组3例、C组3例因术后出现严重并发症转入重症监护室(ICU)而出组,共144例患者术前、术后完成了量表测定。三组患者年龄、性别、BMI、麻醉时间、手术时间、受教育时间、术中补液量及出液量等差异均无统计学意义(均P>0.05)(表1)。
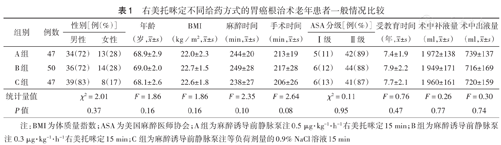
右美托咪定不同给药方式的胃癌根治术老年患者一般情况比较
右美托咪定不同给药方式的胃癌根治术老年患者一般情况比较
| 组别 | 例数 | 性别[例(%)] | 年龄(岁, ±s ) ±s ) | BMI(kg/m2, ±s ) ±s ) | 麻醉时间(min, ±s ) ±s ) | 手术时间(min, ±s ) ±s ) | ASA分级[例(%)] | 受教育时间(年, ±s ) ±s ) | 术中补液量(ml, ±s ) ±s ) | 术中出液量(ml, ±s ) ±s ) | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | Ⅰ级 | Ⅱ级 | |||||||||
| A组 | 47 | 34(72) | 13(28) | 68.9±2.9 | 22.0±2.3 | 244±20 | 213±19 | 5(11) | 42(89) | 7.4±1.9 | 1 972±138 | 739±137 |
| B组 | 50 | 36(72) | 14(28) | 69.0±2.0 | 22.7±1.5 | 249±28 | 217±28 | 6(12) | 44(88) | 7.9±2.2 | 1 949±171 | 716±169 |
| C组 | 47 | 39(83) | 8(17) | 68.1±2.6 | 22.6±1.8 | 238±27 | 206±26 | 6(13) | 41(87) | 7.7±2.1 | 1 960±161 | 720±159 |
| 统计量值 | χ2=2.01 | F=1.86 | F=1.86 | F=2.35 | F=2.64 | χ2=0.11 | F=0.76 | F=0.26 | F=0.30 | |||
| P值 | 0.37 | 0.16 | 0.16 | 0.10 | 0.08 | 0.95 | 0.47 | 0.77 | 0.74 | |||
注:BMI为体质量指数;ASA为美国麻醉医师协会;A组为麻醉诱导前静脉泵注0.5 μg·kg-1·h-1右美托咪定15 min;B组为麻醉诱导前静脉泵注0.3 μg·kg-1·h-1右美托咪定15 min;C组为麻醉诱导前静脉泵注等负荷剂量的0.9% NaCl溶液15 min
三组患者术前1天MoCA量表评分差异无统计学意义(P>0.05),术后第1、3、7天三组间MoCA量表评分差异均有统计学意义(均P<0.01);组内两两比较显示,术后第7天A组和B组MoCA量表评分差异无统计学意义(P>0.05),A组和C组MoCA量表评分差异有统计学意义(P<0.05)(表2)。三组患者术后第1、3、7天PND发生率差异均有统计学意义(均P<0.05),其中A组均低于B组和C组,差异均有统计学意义(均P<0.05)(表2)。
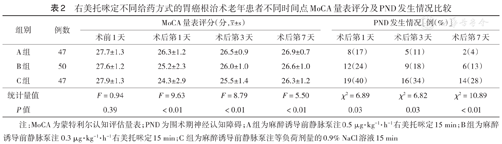
右美托咪定不同给药方式的胃癌根治术老年患者不同时间点MoCA量表评分及PND发生情况比较
右美托咪定不同给药方式的胃癌根治术老年患者不同时间点MoCA量表评分及PND发生情况比较
| 组别 | 例数 | MoCA量表评分(分, ±s ) ±s ) | PND发生情况[例(%)] | |||||
|---|---|---|---|---|---|---|---|---|
| 术前1天 | 术后第1天 | 术后第3天 | 术后第7天 | 术后第1天 | 术后第3天 | 术后第7天 | ||
| A组 | 47 | 27.7±1.3 | 26.3±1.2 | 26.5±0.9 | 26.9±0.7 | 8(17) | 5(11) | 2(4) |
| B组 | 50 | 27.6±1.2 | 25.2±2.3 | 26.0±1.0 | 26.6±1.0 | 12(24) | 9(18) | 6(13) |
| C组 | 47 | 27.9±1.3 | 24.3±2.9 | 25.5±1.4 | 26.3±1.2 | 19(40) | 16(34) | 14(28) |
| 统计量值 | F=0.94 | F=9.63 | F=8.79 | F=5.50 | χ2=6.89 | χ2=6.82 | χ2=10.89 | |
| P值 | 0.39 | <0.01 | <0.01 | <0.01 | 0.03 | 0.03 | <0.01 | |
注:MoCA为蒙特利尔认知评估量表;PND为围术期神经认知障碍;A组为麻醉诱导前静脉泵注0.5 μg·kg-1·h-1右美托咪定15 min;B组为麻醉诱导前静脉泵注0.3 μg·kg-1·h-1右美托咪定15 min;C组为麻醉诱导前静脉泵注等负荷剂量的0.9% NaCl溶液15 min
三组术后30 min及24、48 h的Ramsay镇静评分差异均有统计学意义(均P<0.01),其中C组均低于A组和B组,差异均有统计学意义(均P<0.01);A组术后24 h的Ramsay评分均高于B组和C组(均P<0.01)。
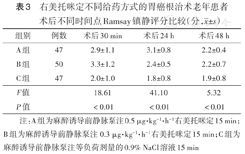
右美托咪定不同给药方式的胃癌根治术老年患者术后不同时间点Ramsay镇静评分比较(分, ±s)
±s)
右美托咪定不同给药方式的胃癌根治术老年患者术后不同时间点Ramsay镇静评分比较(分, ±s)
±s)
| 组别 | 例数 | 术后30 min | 术后24 h | 术后48 h |
|---|---|---|---|---|
| A组 | 47 | 2.9±1.1 | 3.1±0.8 | 2.2±0.4 |
| B组 | 50 | 3.3±1.2 | 2.4±0.5 | 2.2±0.7 |
| C组 | 47 | 2.0±1.0 | 1.8±0.8 | 1.9±0.8 |
| F值 | 18.61 | 41.10 | 5.32 | |
| P值 | <0.01 | <0.01 | <0.01 |
注:A组为麻醉诱导前静脉泵注0.5 μg·kg-1·h-1右美托咪定15 min;B组为麻醉诱导前静脉泵注0.3 μg·kg-1·h-1右美托咪定15 min;C组为麻醉诱导前静脉泵注等负荷剂量的0.9% NaCl溶液15 min
PND是由原来的术后认知功能障碍(POCD)更名而来的,其发生是多因素协同作用的结果[13,14]。本研究采用MoCA量表评分(北京版)筛查[8],在选取研究对象时,尽量排除对认知测定有影响的因素,如受教育程度、有无精神类和神经类疾病等因素,评估结果更具有参考价值。
手术与麻醉导致PND最常见的机制是中枢炎症机制。动物实验证实,手术后小鼠由于手术应激产生的炎症细胞在海马部位明显增多,影响突触的功能,从而产生认知障碍[15]。右美托咪定是高选择性α2肾上腺素能受体激动剂,对大脑炎症有抑制作用[16,17],可改善老年大鼠术后长期空间记忆,促进神经细胞尤其是海马的再生,进而降低PND及一系列不良反应的发生率[17,18]。本研究结果也证实,使用右美托咪定辅助麻醉的两组患者PND发生率均低于未使用右美托咪定的患者,而未使用右美托咪定的患者术后第1天MoCA量表评分即较低,早期PND患者多,表明右美托咪定有保护手术患者大脑认知功能的优点,可改善患者术后早期的认知功能,本研究结果与以往的Meta分析结果一致[19]。
目前关于右美托咪定给药的理想方式和时间尚未统一。以往临床医师对右美托咪定与术后患者PND的关系研究多集中在麻醉维持阶段右美托咪定不同剂量的使用对比。与以往研究不同,本研究根据麻醉诱导前15 min不同的给药剂量分组,维持阶段剂量不变。结果显示麻醉诱导前负荷量0.5 μg·kg-1·h-1患者比0.3 μg·kg-1·h-1患者PND发生率低,表明麻醉诱导前15 min负荷量0.5 μg·kg-1·h-1右美托咪定静脉泵注应是更为理想的给药剂量,其能更有效减轻术中及术后炎症反应,对患者术后的神经系统保护作用更强。很多麻醉药物,如丙泊酚、氯胺酮等,引起的神经毒性在于线粒体分裂、神经炎症和神经营养蛋白表达失调等急性广泛的神经细胞死亡[20,21],而麻醉诱导前右美托咪定负荷量的准确使用,可在手术创伤未发生前收缩患者脑血管,最大限度保护脑细胞,使镇静状态下的脑细胞处于低代谢水平,从而更有效降低麻醉剂及手术应激对脑细胞的损伤[22]。
Ramsay镇静评分法是临床使用最广泛的镇静评分标准[23]。本研究显示,未使用右美托咪定的患者术后30 min、24 h、48 h的Ramsay镇静评分均低于使用右美托咪定患者,同时负荷量0.5 μg·kg-1·h-1组术后24 h的Ramsay评分优于0.3 μg·kg-1·h-1组,其与术后相同时间点认知障碍的发生程度基本一致。表明麻醉诱导前右美托咪定泵注最佳负荷量为0.5 μg·kg-1·h-1,对术后患者的谵妄和躁狂发生有很好的预防作用。右美托咪定的镇静和催眠作用被认为是通过激活蓝斑的中枢突触前和突触后α2受体来介导的[22,24],与丙泊酚需要中断给药以达到术中唤醒不同,右美托咪定镇静催眠下患者易于被外部刺激唤醒[25,26],故结合本研究结果可以推测,右美托咪定预防术后谵妄的机制可能与其接近自然睡眠-觉醒的镇静催眠机制有关,不良反应少,值得临床推广。
总之,右美托咪定能够优化麻醉,围术期麻醉诱导前右美托咪定的合理负荷量至关重要,其不仅能提高术后早期MoCA量表评分、降低老年患者PND的发生率,还能提高术后麻醉复苏满意度。右美托咪定辅助麻醉对术后患者PND的远期影响还有待进一步研究。
所有作者均声明不存在利益冲突



























