
探讨卡培他滨节拍化疗联合依西美坦对乳腺癌MCF-7细胞增殖及PI3K-AKT信号通路的影响。
体外培养MCF-7细胞,分为对照组(加入不含药物的DMEM培养液)、30 µmol/L依西美坦组和卡培他滨节拍化疗联合用药组[30 µmol/L依西美坦联合不同浓度(50、33、17 µmol/L)卡培他滨]。CCK-8法检测细胞增殖抑制率,计算药物半数抑制浓度(IC50)。流式细胞术检测各组细胞周期与细胞凋亡率的变化。蛋白质印迹法检测MCF-7细胞PI3K-AKT信号通路中相关蛋白的表达。
卡培他滨和依西美坦作用MCF-7细胞72 h的IC50分别为101.2 µmol/L和60.6 µmol/L。24、48 h 30 µmol/L依西美坦联合50、33、17 µmol/L卡培他滨组MCF-7细胞增殖抑制率均高于30 µmol/L依西美坦组(均P<0.01);30 µmol/L依西美坦组、30 µmol/L依西美坦+50 µmol/L卡培他滨组、30 µmol/L依西美坦+33 µmol/L卡培他滨组、30 µmol/L依西美坦+17 µmol/L卡培他滨组细胞凋亡率分别为(18.1±2.6)%、(34.6±3.0)%、(27.6±1.3)%、(23.1±1.6)%,差异有统计学意义(F=23.652,P<0.01)。与对照组相比,30 µmol/L依西美坦组MCF-7细胞G2期细胞比例上升[(16.7±2.6)%比(10.6±2.2)%],G1期细胞比例下降[(53.3±4.0)%比(56.3±3.2)%];30 µmol/L依西美坦+50 µmol/L卡培他滨组MCF-7细胞S期细胞比例上升[(39.0±3.6)%比(33.1±2.0)%];30 µmol/L依西美坦+33 µmol/L卡培他滨组MCF-7细胞更多停滞于S期[(51.7±4.1)%],G2期细胞几乎消失[(1.2±0.5)%];30 µmol/L依西美坦+17 µmol/L卡培他滨组MCF-7细胞G2期细胞比例上升[(26.2±3.1)%]。蛋白质印迹法检测显示,低剂量节拍化疗促进依西美坦抑制PI3K表达,促进AKT蛋白473位丝氨酸磷酸化[p-AKT(473)表达增高],促进信号通路下游S6蛋白表达及提高磷酸化水平(p-S6表达升高),从而激活凋亡信号。
卡培他滨节拍化疗联合依西美坦可协同抑制乳腺癌MCF-7细胞增殖,通过影响PI3K-AKT信号通路激活细胞凋亡机制。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
PI3K-AKT信号通路失调与肿瘤细胞转化、侵袭和转移密切相关[1]。PI3K-AKT过表达参与乳腺癌的形成与发展,其高表达程度与肿瘤恶性程度呈正相关[2];PI3K-AKT通路异常活化是雌激素受体(ER)阳性乳腺癌内分泌耐药的重要机制之一[3]。利用PI3K-AKT通路作为靶点已研发出多种靶向药物,使亚型乳腺癌患者个体化治疗成为可能[4]。临床上多数乳腺癌患者为激素依赖型,雄激素、雌激素和孕激素均能刺激乳腺肿瘤细胞的生长和增殖。因此内分泌治疗是乳腺癌初期的主要治疗方式,可改善患者预后,但仍有约30%乳腺癌患者内分泌治疗失败并复发,其主要原因为内分泌治疗出现耐药[5]。联合用药(如信号通路抑制剂联合芳香化酶抑制剂)可阻断内分泌信号通路,抑制内分泌耐药,从而促进肿瘤细胞凋亡,但具体机制及安全性、远期复发可能性仍处于积极的探索中。节拍化疗是一种小剂量化疗药物不间断持续高频次给药的方式,可抑制肿瘤血管内皮细胞增殖,从而达到抑制肿瘤生长的目的[6]。节拍化疗用药剂量小,不良反应少,患者接受度高,同时能保持与常规化疗几乎相同的疗效。本研究探讨卡培他滨节拍化疗联合第三代芳香化酶抑制剂依西美坦对乳腺癌MCF-7细胞增殖、凋亡和PI3K-AKT信号通路影响的相关机制。
人乳腺癌MCF-7细胞株为江苏省常熟市医学检验所中心实验室保存。DMEM高糖细胞培养液、10%胎牛血清、CCK-8检测试剂盒均购自美国Gibco公司;二甲基亚砜(DMSO)、卡培他滨、依西美坦、相关抗体均购自美国Proteintech生物公司;Annexin V-FITC检测试剂盒与BCA蛋白检测试剂盒均购自南京凯基生物公司;蛋白质印迹法检测试剂购自上海GenePharma公司;FACS Calibur流式细胞仪购自美国BD公司;美国伯乐PowerPacTMHC电泳仪购自美国Bio-Rad公司;采用上海复日FR-1800全功能发光及荧光生物图像分析系统及Gel-Pro Analyzer软件分析处理图像。其他常规试剂或耗材为本实验室配制或配备。
使用含10%胎牛血清的DMEM培养液,37 ℃、5% CO2饱和湿度培养箱中培养MCF-7细胞。取对数生长期MCF-7细胞,调整细胞密度为1×103/孔,接种至96孔板,待细胞融合度达80%~90%时,弃去培养液,以磷酸盐缓冲液(PBS)洗涤2次。加入1 ml Trypsin-乙二胺四乙酸(EDTA)液混匀后,吸去胰酶溶液,37 ℃静置2 min。加入2 ml DMEM培养液,吹打制成细胞悬液并稀释至5×105/ml,接种至96孔板培养过夜。待细胞贴壁后吸弃孔中培养液,实验组加入含不同浓度药物的工作液:依西美坦浓度分别为6.25、12.5、25.0、31.25、50.0、62.5、100.0、125.0、187.5 µmol/L,卡培他滨浓度分别为30.0、60.0、80.0、120.0、200.0、250.0、300.0、350.0、400.0 µmol/L,对照组加入不含药物的等量DMEM培养液。每24 h更换含药培养液,于37 ℃、5% CO2培养箱共培养72 h。弃去培养液,每孔加入新鲜培养液100 µl,避光加入CCK-8溶液5 µl,避光培养1.5 h后,酶标仪检测490 nm波长处吸光度(A)值,计算细胞增殖抑制率,依此计算卡培他滨和依西美坦对MCF-7细胞的半数抑制浓度(IC50)。每组重复5次。
细胞增殖抑制率(%)=(1-A实验组/A对照组)×100%
根据抗肿瘤细胞增殖联合节拍化疗方案以及卡培他滨和依西美坦的IC50,细胞分为对照组(加入不含药物的DMEM培养液)、30 µmol/L依西美坦组、30 µmol/L依西美坦+50 µmol/L卡培他滨组、30 µmol/L依西美坦+33 µmol/L卡培他滨组、30 µmol/L依西美坦+ 17 µmol/L卡培他滨组。
各组细胞经药物处理后用胰酶消化,制成密度为1×106个/ml的单细胞悬液。冰无水乙醇预冷,4 ℃过夜固定。离心半径7.5 cm、1 000 r/min离心5 min,弃上清。预冷PBS重悬,离心除去乙醇。250 µg/ml RNaseA 360 µl重悬细胞,37 ℃消化30 min。加入40 µl PI工作液,4 ℃避光染色30 min。根据细胞内DNA倍数判断细胞周期。
各组细胞经药物处理后,收集细胞至EP管,离心半径7.5 cm、2 000 r/min离心5 min,收集细胞。用不含EDTA的胰酶消化,离心半径7.5 cm、2 000 r/min离心5 min,弃培养液。预冷PBS洗涤细胞2次。再用400 µl 1×Binding Buffer悬浮细胞,细胞密度约为1×106/ml。在细胞悬浮液中加入5 µl Annexin V-FITC,轻轻混匀后2~8 ℃避光培养15 min。加入10 µl PI后轻轻混匀,2~8 ℃避光培养5 min。在1 h内采用流式细胞仪检测分析,计算细胞凋亡率。
收集并裂解细胞,4 ℃下,离心半径7.5 cm、10 000 r/min离心2 min,取上清,BCA法测量蛋白含量。将8 µl蛋白样本加入2 µl 5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液,100 ℃加热处理5 min,离心半径7.5 cm、10 000 r/min离心1 min去除不溶性沉淀;样品使用10% SDS-PAGE分离,每孔上样量10 µl;电泳结束后,将聚偏氟乙烯(PVDF)膜在甲醇中浸泡10 s,使用快速电泳缓冲液浸泡凝胶和PVDF膜10 min,使用湿转法进行转膜,200 mA,25 min;将PVDF膜在甲醇中浸泡10 s;加入适当稀释的一抗[PI3K、AKT、p-AKT(308)、p-AKT(473)、S6、p-S6、Tububin相关抗体],4 ℃培养过夜。用1×TBST洗涤5次,每次10 min;加入适当稀释的二抗,室温静置2 h。用1×TBST洗涤5次,每次10 min;取适量混合发光液加至PVDF膜上,用FR-1800图像分析系统检测。以目的蛋白条带与内参照Tububin蛋白条带灰度值的比值为目的蛋白的相对表达量。
采用SPSS 19.0软件行统计学分析。计量资料符合正态分布,以均数±标准差( ±s)表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
±s)表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
CCK-8法检测卡培他滨和依西美坦作用MCF-7细胞72 h的IC50分别为101.2 µmol/L和60.6 µmol/L。联合用药时药物细胞毒性会增加,因此取依西美坦30 µmol/L和卡培他滨50、33、17 µmol/L作为常规剂量用于后续细胞实验。药物作用24、48 h后,30 µmol/L依西美坦联合50、33、17 µmol/L卡培他滨组较30 µmol/L依西美坦组MCF-7细胞增殖抑制率均更高,差异有统计学意义(P<0.01)(表1)。
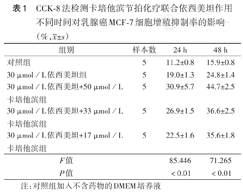
CCK-8法检测卡培他滨节拍化疗联合依西美坦作用不同时间对乳腺癌MCF-7细胞增殖抑制率的影响(%, ±s)
±s)
CCK-8法检测卡培他滨节拍化疗联合依西美坦作用不同时间对乳腺癌MCF-7细胞增殖抑制率的影响(%, ±s)
±s)
| 组别 | 样本数 | 24 h | 48 h |
|---|---|---|---|
| 对照组 | 5 | 11.2±0.8 | 15.9±0.8 |
| 30 µmol/L依西美坦组 | 5 | 19.0±1.3 | 24.8±1.4 |
| 30 µmol/L依西美坦+50 µmol/L卡培他滨组 | 5 | 30.9±5.7 | 44.7±2.5 |
| 30 µmol/L依西美坦+33 µmol/L卡培他滨组 | 5 | 26.9±1.5 | 36.6±2.5 |
| 30 µmol/L依西美坦+17 µmol/L卡培他滨组 | 5 | 22.5±1.6 | 35.6±1.8 |
| F值 | 85.446 | 71.265 | |
| P值 | <0.01 | <0.01 |
注:对照组加入不含药物的DMEM培养液
与对照组相比,30 µmol/L依西美坦组MCF-7细胞G2期细胞比例上升,G1期细胞比例下降;30 µmol/L依西美坦+ 50 µmol/L卡培他滨组MCF-7细胞S期细胞比例上升,细胞周期逐渐停滞于S期;降低节拍化疗联合用药中的卡培他滨剂量,33 µmol/L卡培他滨进一步使细胞更多停滞于S期,G2期细胞几乎消失;当卡培他滨降低至17 µmol/L时,G2期细胞比例上升,细胞倾向阻滞于G2期(表2)。
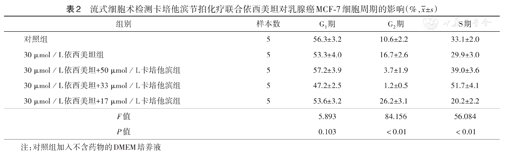
流式细胞术检测卡培他滨节拍化疗联合依西美坦对乳腺癌MCF-7细胞周期的影响(%, ±s)
±s)
流式细胞术检测卡培他滨节拍化疗联合依西美坦对乳腺癌MCF-7细胞周期的影响(%, ±s)
±s)
| 组别 | 样本数 | G1期 | G2期 | S期 |
|---|---|---|---|---|
| 对照组 | 5 | 56.3±3.2 | 10.6±2.2 | 33.1±2.0 |
| 30 µmol/L依西美坦组 | 5 | 53.3±4.0 | 16.7±2.6 | 29.9±3.0 |
| 30 µmol/L依西美坦+50 µmol/L卡培他滨组 | 5 | 57.2±3.9 | 3.7±1.9 | 39.0±3.6 |
| 30 µmol/L依西美坦+33 µmol/L卡培他滨组 | 5 | 47.2±2.5 | 1.2±0.5 | 51.7±4.1 |
| 30 µmol/L依西美坦+17 µmol/L卡培他滨组 | 5 | 53.6±3.2 | 26.2±3.1 | 20.2±2.2 |
| F值 | 5.893 | 84.156 | 56.084 | |
| P值 | 0.103 | <0.01 | <0.01 |
注:对照组加入不含药物的DMEM培养液
卡培他滨节拍化疗联合依西美坦作用于MCF-7细胞48 h后,流式细胞术检测结果显示联合用药更能促进MCF-7细胞凋亡,30 µmol/L依西美坦组、30 µmol/L依西美坦+ 50 µmol/L卡培他滨组、30 µmol/L依西美坦+ 33 µmol/L卡培他滨组、30 µmol/L依西美坦+17 µmol/L卡培他滨组细胞凋亡率分别为(18.1±2.6)%、(34.6±3.0)%、(27.6±1.3)%、(23.1±1.6)%,差异有统计学意义(F=23.652,P<0.01),提示低剂量卡培他滨节拍化疗联合用药即可抑制MCF-7细胞增殖,促进其凋亡(图1)。


蛋白质印迹法检测结果显示,加入卡培他滨会进一步增加30 µmol/L依西美坦对PI3K蛋白表达的抑制作用(P<0.05),且低浓度作用更为显著;对AKT及p-AKT(308)蛋白表达的作用不明显(均P>0.05),而对p-AKT(473)蛋白表达略有促进作用,但差异无统计学意义(P>0.05)。联合用药可对PI3K-AKT信号通路下游S6蛋白起到磷酸化激活作用(P<0.05)。节拍化疗中进一步降低卡培他滨剂量会弱化p-AKT(473)、p-S6磷酸化程度(图2、表3)。
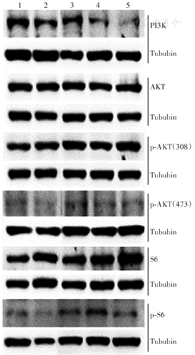

注:1为对照组(加入不含药物的DMEM培养液);2为30 µmol/L依西美坦组;3为30 µmol/L依西美坦+50 µmol/L卡培他滨组;4为30 µmol/L依西美坦+33 µmol/L卡培他滨组;5为30 µmol/L依西美坦+17 µmol/L卡培他滨组
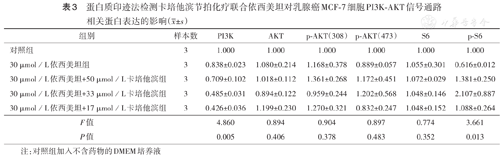
蛋白质印迹法检测卡培他滨节拍化疗联合依西美坦对乳腺癌MCF-7细胞PI3K-AKT信号通路相关蛋白表达的影响( ±s)
±s)
蛋白质印迹法检测卡培他滨节拍化疗联合依西美坦对乳腺癌MCF-7细胞PI3K-AKT信号通路相关蛋白表达的影响( ±s)
±s)
| 组别 | 样本数 | PI3K | AKT | p-AKT(308) | p-AKT(473) | S6 | p-S6 |
|---|---|---|---|---|---|---|---|
| 对照组 | 3 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 |
| 30 µmol/L依西美坦组 | 3 | 0.838±0.023 | 1.080±0.214 | 1.168±0.378 | 0.889±0.057 | 1.055±0.301 | 0.616±0.012 |
| 30 µmol/L依西美坦+50 µmol/L卡培他滨组 | 3 | 0.709±0.102 | 1.018±0.112 | 1.361±0.268 | 1.172±0.451 | 1.072±0.029 | 1.381±0.250 |
| 30 µmol/L依西美坦+33 µmol/L卡培他滨组 | 3 | 0.485±0.031 | 0.894±0.122 | 0.959±0.244 | 1.202±0.568 | 1.048±0.146 | 2.107±0.887 |
| 30 µmol/L依西美坦+17 µmol/L卡培他滨组 | 3 | 0.426±0.036 | 1.199±0.230 | 1.270±0.321 | 0.832±0.247 | 1.048±0.152 | 1.088±0.264 |
| F值 | 4.860 | 0.894 | 0.904 | 0.897 | 0.774 | 3.661 | |
| P值 | 0.005 | 0.406 | 0.378 | 0.483 | 0.352 | 0.013 |
注:对照组加入不含药物的DMEM培养液
内分泌治疗(他莫昔芬)一直是女性激素受体阳性乳腺癌患者的主要治疗手段,但仍有40%~50%患者会出现对他莫昔芬原发或继发性耐药[7]。激素受体阳性患者占乳腺癌患者的70%,因此克服其内分泌治疗耐药问题具有十分重要的临床意义。芳香化酶抑制剂是绝经后激素受体阳性乳腺癌患者的标准治疗方式之一[8],第三代芳香化酶抑制剂是辅助内分泌治疗的主要药物。作为甾体类芳香化酶抑制剂的主流药物,依西美坦可通过与芳香化酶不可逆性结合抑制其酶活性[9]。内分泌治疗药物的不良反应是临床上内分泌治疗成功与否的关键影响因素,同时需要密切关注内分泌治疗的适用性与耐药性。联合用药化疗,特别是化疗与内分泌治疗的联合在某些人群中具有一定的临床应用价值[10]。节拍化疗的低剂量、持续性与高频率不仅能抑制新生血管的生成,而且还因其不良反应小、依从性好,能使晚期患者获益。节拍化疗联合内分泌治疗可克服传统化疗较严重的不良反应,同时能抑制内分泌治疗耐药性的产生,因此该联合治疗方式可以较长期应用于老年、体质较差晚期患者。近几年研究发现该方式还存在另一些作用机制,能使激素受体阳性乳腺癌患者长期获益[10,11,12]。
本研究结果显示,低剂量卡培他滨与依西美坦具有一定的协同效应,联合用药能增加对MCF-7细胞增殖的抑制。低剂量卡培他滨剂量可减少化疗对正常细胞的毒性作用。相较于常规化疗方式,节拍化疗的主要优势不体现在对癌细胞抑制率的提高,而体现在大幅度降低不良反应发生率的同时维系一定的抑制率,从而增加患者的依从性,使患者长期获益。即使低剂量抑制效果不如常规剂量,也能使晚期、生理机能较差患者总体获益[8,10,12]。卡培他滨作用于DNA合成,导致DNA损伤,从而抑制细胞分裂。本研究流式细胞术结果也显示联合用药后,MCF-7细胞停滞于S期。依西美坦作用于成熟的细胞表面受体,所以其作用主要发挥于G2期。本研究发现卡培他滨节拍化疗的剂量对细胞周期和凋亡的影响较大。其内在的机制可能体现在作用位点的剂量效应,不同浓度药物会对部分信号通路中蛋白表达及活性状态产生不同的影响。
PI3K-AKT信号通路是细胞内感受胞外营养能量水平与生长因子等信号改变的一种丝/苏氨酸蛋白激酶,其在细胞周期、蛋白质合成与降解、能量代谢等多方面发挥着重要的生理功能。研究发现,多种生长因子信号通路间相互作用参与内分泌耐药的形成,PI3K-AKT信号通路异常激活及其与雌激素受体通路间的相互作用是导致内分泌治疗失败的重要原因[13]。AKT是PI3K-AKT通路的核心,能直接调控凋亡信号,其磷酸化可提高其活性。p-S6是PI3K-AKT信号通路下游执行功能的关键核糖体蛋白,其高表达状态与多种恶性肿瘤的发生、发展密切相关[14]。PI3K-AKT信号异常会刺激下游p-S6磷酸化为pS6k,增强了含嘧啶基因mRNA的翻译功能,从而提高一些核糖体蛋白与调节蛋白的表达[15]。研究表明PI3K-AKT信号通路在抑制细胞凋亡、促进细胞增殖中发挥着重要作用,与乳腺癌发生、发展密切相关[16]。该信号通路可能是乳腺癌内分泌治疗耐药的关键因素[17]。研究显示,单独运用PI3K-AKT通路中的一种抑制剂会造成该信号通路的负反馈调节机制,这种负反馈机制会一定程度上降低依维莫司的抗肿瘤作用[18]。多种信号转导通路网络的作用导致需要不同位点的靶向药物联合应用才可有效对抗ER阳性乳腺癌的内分泌耐药现象。
本研究结果显示,卡培他滨会进一步增强依西美坦对PI3K的抑制作用,且节拍化疗模式效果更为显著。虽然该方式对总体AKT及p-AKT(308)作用不明显,但对p-AKT(473)表达有促进作用,表明卡培他滨节拍化疗联合依西美坦会一定程度促进总AKT蛋白中部分蛋白473位点丝氨酸的磷酸化激活。进一步研究显示,联合用药同样会对PI3K-AKT信号通路下游S6起到磷酸化激活作用,从而影响DNA合成,使细胞周期停滞于S期,抑制MCF-7细胞增殖。
选择新型联合用药可提高靶向药物对肿瘤细胞增殖的抑制效果,避免耐药现象发生。节拍化疗新型给药方式能进一步减轻化疗药物不良反应,增加患者依从性,减少内分泌治疗耐药性的产生。卡培他滨节拍化疗联合依西美坦内分泌治疗对激素阳性乳腺癌患者,特别是癌症晚期、生理机能基础差患者的姑息治疗具有重要意义。
所有作者均声明不存在利益冲突



























