
探讨弥漫大B细胞淋巴瘤(DLBCL)患者经含脂质体多柔比星CHOP样方案治疗后间质性肺炎(IP)的发生情况及其危险因素。
回顾性分析2013年1月至2020年6月新疆医科大学附属肿瘤医院收治的145例初诊初治DLBCL患者的临床资料,其中含脂质体多柔比星的RCDOP方案治疗73例,RCHOP方案治疗72例。比较两组IP发生率,采用多因素logistic回归分析IP发生的危险因素。
145例患者中34例(23.4%)发生IP;发生IP者多集中在化疗3~5个周期时,占79.4%(27/34);发生IP时中位化疗4个周期。RCDOP方案组和RCHOP方案组IP发生率分别为31.5%(23/73)和15.3%(11/72),差异有统计学意义(χ2=5.319,P<0.05)。多因素logistic回归分析显示,应用脂质体多柔比星(OR=2.416,95% CI 1.059~5.509,P=0.036)、年龄≥60岁(OR=2.505,95% CI 1.127~5.567,P=0.024)是IP发生的独立危险因素。
脂质体多柔比星的应用是DLBCL患者IP发生的危险因素;应用RCDOP方案治疗4个周期后需加强对IP的预防和监测,特别是年龄≥60岁的患者。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着利妥昔单抗的应用,RCHOP(利妥昔单抗、环磷酰胺、多柔比星、长春新碱、泼尼松)方案作为公认的治疗CD20阳性弥漫大B细胞淋巴瘤(DLBCL)的标准治疗方案,使B细胞非霍奇金淋巴瘤(NHL)的疗效和预后得到了明显的改善[1,2,3,4]。聚乙二醇脂质体多柔比星(PLD)是多柔比星的一种新剂型,因其血浆半衰期更长且心脏毒性小得以推广,用PLD代替传统的多柔比星是治疗先前存在心脏功能障碍NHL患者的有效替代方法[5,6]。PLD得到广泛应用后,部分患者出现了间质性肺炎(IP),这在淋巴瘤的化疗中是一种潜在的致命性不良反应。间质性肺疾病被认为是一组具有不同病因的疾病,其特征在于慢性肺部炎症,伴有炎性细胞、淋巴细胞和巨噬细胞的积累,继而释放出促炎性细胞因子[7]。也有学者指出,细胞毒性和免疫机制均可能与药物诱导的间质性肺损伤有关[8]。与肿瘤药物有关的间质性肺疾病是临床关注的问题。国外一些病例报告或小样本研究强调,IP的发生与使用PLD有一定相关性[9,10],但目前国内外这方面的病例对照研究较少。本研究分析RCDOP(利妥昔单抗、环磷酰胺、脂质体多柔比星、长春新碱、泼尼松)方案和RCHOP方案治疗的DLBCL患者IP发生情况,探讨PLD与IP发生的关系以及IP发生的危险因素。
回顾性分析2013年1月至2020年6月我院145例CD20阳性DLBCL患者的病历资料。所有患者均经病理及免疫组织化学检查确诊,采用Ann Arbor分期系统对疾病分期;采用国际预后指数(IPI)评分进行预后判断;根据美国东部肿瘤协作组功能状态评分(ECOG-PS)标准进行体能状态评分。所有患者均为初诊初治,接受RCDOP或RCHOP方案中的一种进行治疗,且至少治疗4个周期。所有患者均无免疫系统疾病或使用过免疫抑制剂。治疗前CT检查基线情况均无异常。需除外以下情况:心功能不全、严重肝肾功能不全、骨髓抑制等基本状况较差者;有皮质激素禁忌证或对利妥昔单抗有变态反应者;免疫功能低下者,如合并人类免疫缺陷病毒感染;有其他恶性肿瘤病史者(除外已治愈的皮肤基底细胞癌、子宫颈原位癌、皮肤鳞状细胞癌);合并肺部感染、肺结核、肺癌、慢性阻塞性肺疾病、哮喘等其他肺部疾病;中枢神经系统受侵者;临床资料不完整或随访过程中失访者。其中RCDOP方案治疗73例,RCHOP方案治疗72例。
全组145例患者中,男性56例(38.6%),女性89例(61.4%);中位年龄为54岁(26~86岁),<60岁90例(62.1%),≥60岁55例(37.9%);有吸烟史28例(19.3%),无吸烟史117例(80.7%);有糖尿病史16例(11.0%),无糖尿病史129例(89.0%);IPI评分低危(0~1分)组78例(53.8%),中危(2~3分)组55例(37.9%),高危(4~5分)组12例(8.3%);ECOG-PS评分≤1分137例(94.5%),>1分8例(5.5%);伴有B症状13例(9.0%),无B症状132例(91.0%);Ann Arbor分期为Ⅰ~Ⅱ期63例(43.4%),Ⅲ~Ⅳ期82例(56.6%);病理类型均为DLBCL,其中生发中心B细胞(GCB)型45例(31.0%),非生发中心B细胞(nGCB)型86例(59.3%),分型不明14例(9.7%);β2微球蛋白水平正常59例(40.7%),升高86例(59.3%);血清乳酸脱氢酶(LDH)水平正常90例(62.1%),升高55例(37.9%)。本研究符合《赫尔辛基宣言》的相关要求。
RCDOP方案:利妥昔单抗375 mg/m2,第0天;环磷酰胺750 mg/m2,第1天;脂质体多柔比星25~40 mg/m2,第1天;长春新碱1.4 mg/m2(不超过2 mg/m2),第1天;泼尼松100 mg,第1天至第5天(21 d为1个周期)。RCHOP方案:吡柔比星50 mg/m2,第1天,或表柔比星50 mg/m2,第1天;其他化疗药物剂量同RCDOP方案。
IP的诊断主要依据胸部CT扫描结果和临床症状。(1)CT检查方面,与基线相比出现新的或加重的两肺磨玻璃影,网格状、蜂窝状、斑片状影,可伴或不伴牵拉性支气管扩张、胸膜增厚征及肺气肿和肺大泡[11]。CT影像由我院两名高年资放射科医师共同判读,如果两名医师解释不同,则进行全科室讨论,以协商一致的结果作为判读结果。(2)症状主要表现为发热、咳嗽、气急、血氧饱和度降低等,多数患者无症状。此外,需要排除其他已知原因的特发性肺纤维化(如家庭或职业环境暴露、结缔组织病等),有条件的部分患者经支气管镜肺活组织检查或支气管肺泡灌洗液排除其他疾病。最终结合临床症状、实验室检查、放射影像学等多学科方法诊断IP。
根据美国临床肿瘤学会(ASCO)/美国国家综合癌症网络(NCCN)指南(2018年)对药物相关IP进行严重程度分级[12]。(1)1级:无症状;局限于1个肺叶,或<25%肺实质受累;仅需临床或诊断(随访)的观察;(2)2级:新症状或症状持续加重(呼吸困难、咳嗽、胸痛、发热、需氧量增加);(3)3级:严重症状,包括全部肺叶均受累,或>50%肺实质受累,日常生活受限;(4)4级:危及生命。其中1级为轻度,2级为中度,3、4级为重度。
应用SPSS 24.0软件进行统计学分析。计数资料比较采用χ2检验;IP发生危险因素采用多因素logistic回归进行分析。以P<0.05为差异有统计学意义。
RCDOP方案组与RCHOP方案组患者的各临床病理特征差异均无统计学意义(均P>0.05)(表1)。
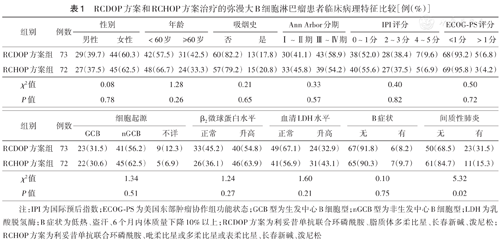
RCDOP方案和RCHOP方案治疗的弥漫大B细胞淋巴瘤患者临床病理特征比较[例(%)]
RCDOP方案和RCHOP方案治疗的弥漫大B细胞淋巴瘤患者临床病理特征比较[例(%)]
| 组别 | 例数 | 性别 | 年龄 | 吸烟史 | Ann Arbor分期 | IPI评分 | ECOG-PS评分 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | <60岁 | ≥60岁 | 否 | 是 | Ⅰ~Ⅱ期 | Ⅲ~Ⅳ期 | 0~1分 | 2~3分 | 4~5分 | ≤1分 | >1分 | ||
| RCDOP方案组 | 73 | 29(39.7) | 44(60.3) | 42(57.5) | 31(42.5) | 60(82.2) | 13(17.8) | 30(41.1) | 43(58.9) | 38(52.0) | 28(38.4) | 7(9.6) | 68(93.2) | 5(6.8) |
| RCHOP方案组 | 72 | 27(37.5) | 45(62.5) | 48(66.7) | 24(33.3) | 57(79.2) | 15(20.8) | 33(45.8) | 39(54.2) | 40(55.6) | 27(37.5) | 5(6.9) | 69(95.8) | 3(4.2) |
| χ2值 | 0.08 | 1.28 | 0.21 | 0.33 | 0.40 | 0.50 | ||||||||
| P值 | 0.78 | 0.26 | 0.65 | 0.57 | 0.82 | 0.72 | ||||||||
| 组别 | 例数 | 细胞起源 | β2微球蛋白水平 | 血清LDH水平 | B症状 | 间质性肺炎 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GCB | nGCB | 不详 | 正常 | 升高 | 正常 | 升高 | 无 | 有 | 无 | 有 | ||
| RCDOP方案组 | 73 | 23(31.5) | 41(56.2) | 9(12.3) | 33(45.2) | 40(54.8) | 49(67.1) | 24(32.9) | 67(91.8) | 6(8.2) | 50(68.5) | 23(31.5) |
| RCHOP方案组 | 72 | 22(30.6) | 45(62.5) | 5(6.9) | 26(36.1) | 46(63.9) | 41(56.9) | 31(43.1) | 65(90.3) | 7(9.7) | 61(84.7) | 11(15.3) |
| χ2值 | 1.34 | 1.24 | 1.60 | 0.10 | 5.32 | |||||||
| P值 | 0.51 | 0.27 | 0.21 | 0.75 | 0.02 | |||||||
注:IPI为国际预后指数;ECOG-PS为美国东部肿瘤协作组功能状态;GCB型为生发中心B细胞型;nGCB型为非生发中心B细胞型;LDH为乳酸脱氢酶;B症状为低热、盗汗、6个月内体质量下降10%以上;RCDOP方案为利妥昔单抗联合环磷酰胺、脂质体多柔比星、长春新碱、泼尼松;RCHOP方案为利妥昔单抗联合环磷酰胺、吡柔比星或多柔比星或表柔比星、长春新碱、泼尼松
145例患者中34例(23.4%)发生IP,包括男性13例,女性21例,男女比例为1∶1.6,中位年龄为64.5岁(34~82岁)。发生IP时化疗1~6个周期的患者分别有1、3、7、12、8、3例;发生IP者多集中在化疗3~5个周期时,占79.4%(27/34);发生IP时中位化疗4个周期。RCDOP方案组IP的发生率为31.5%(23/73),RCHOP组方案为15.3%(11/72),差异有统计学意义(χ2=5.319,P<0.05)。
单因素分析显示,≥60岁、RCDOP方案治疗患者IP发生率较高,差异均有统计学意义(均P<0.05)(表2)。将应用RCDOP方案、年龄≥60岁纳入IP发生的多因素logistic回归分析发现,应用RCDOP方案、年龄≥60岁是IP发生的独立危险因素(均P<0.05)(表3)。
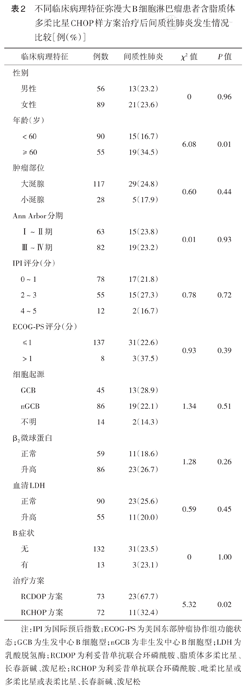
不同临床病理特征弥漫大B细胞淋巴瘤患者含脂质体多柔比星CHOP样方案治疗后间质性肺炎发生情况比较[例(%)]
不同临床病理特征弥漫大B细胞淋巴瘤患者含脂质体多柔比星CHOP样方案治疗后间质性肺炎发生情况比较[例(%)]
| 临床病理特征 | 例数 | 间质性肺炎 | χ2值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男性 | 56 | 13(23.2) | 0 | 0.96 | |
| 女性 | 89 | 21(23.6) | |||
| 年龄(岁) | |||||
| <60 | 90 | 15(16.7) | 6.08 | 0.01 | |
| ≥60 | 55 | 19(34.5) | |||
| 肿瘤部位 | |||||
| 大涎腺 | 117 | 29(24.8) | 0.60 | 0.44 | |
| 小涎腺 | 28 | 5(17.9) | |||
| Ann Arbor分期 | |||||
| Ⅰ~Ⅱ期 | 63 | 15(23.8) | 0.01 | 0.93 | |
| Ⅲ~Ⅳ期 | 82 | 19(23.2) | |||
| IPI评分(分) | |||||
| 0~1 | 78 | 17(21.8) | 0.78 | 0.72 | |
| 2~3 | 55 | 15(27.3) | |||
| 4~5 | 12 | 2(16.7) | |||
| ECOG-PS评分(分) | |||||
| ≤1 | 137 | 31(22.6) | 0.93 | 0.39 | |
| >1 | 8 | 3(37.5) | |||
| 细胞起源 | |||||
| GCB | 45 | 13(28.9) | 1.34 | 0.51 | |
| nGCB | 86 | 19(22.1) | |||
| 不明 | 14 | 2(14.3) | |||
| β2微球蛋白 | |||||
| 正常 | 59 | 11(18.6) | 1.28 | 0.26 | |
| 升高 | 86 | 23(26.7) | |||
| 血清LDH | |||||
| 正常 | 90 | 23(25.6) | 0.59 | 0.45 | |
| 升高 | 55 | 11(20.0) | |||
| B症状 | |||||
| 无 | 132 | 31(23.5) | 0 | 1.00 | |
| 有 | 13 | 3(23.1) | |||
| 治疗方案 | |||||
| RCDOP方案 | 73 | 23(67.7) | 5.32 | 0.02 | |
| RCHOP方案 | 72 | 11(32.4) | |||
注:IPI为国际预后指数;ECOG-PS为美国东部肿瘤协作组功能状态;GCB为生发中心B细胞型;nGCB为非生发中心B细胞型;LDH为乳酸脱氢酶;RCDOP为利妥昔单抗联合环磷酰胺、脂质体多柔比星、长春新碱、泼尼松;RCHOP为利妥昔单抗联合环磷酰胺、吡柔比星或多柔比星或表柔比星、长春新碱、泼尼松
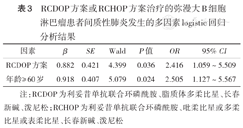
RCDOP方案或RCHOP方案治疗的弥漫大B细胞淋巴瘤患者间质性肺炎发生的多因素logistic回归分析结果
RCDOP方案或RCHOP方案治疗的弥漫大B细胞淋巴瘤患者间质性肺炎发生的多因素logistic回归分析结果
| 因素 | β | SE | Wald | P值 | OR | 95%CI |
|---|---|---|---|---|---|---|
| RCDOP方案 | 0.882 | 0.421 | 4.399 | 0.036 | 2.416 | 1.059~5.509 |
| 年龄≥60岁 | 0.918 | 0.407 | 5.079 | 0.024 | 2.505 | 1.127~5.567 |
注:RCDOP为利妥昔单抗联合环磷酰胺、脂质体多柔比星、长春新碱、泼尼松;RCHOP为利妥昔单抗联合环磷酰胺、吡柔比星或多柔比星或表柔比星、长春新碱、泼尼松
DLBCL是最常见的B细胞淋巴瘤亚型,占NHL新发病例的30%~40%,RCHOP方案作为其治疗的一线标准方案,在提高疾病缓解率的同时也会增加相关不良反应。针对高龄且合并心脏基础疾病不能耐受RCHOP方案化疗的患者,RCDOP方案是其另一个优选方案。RCDOP方案和RCHOP方案的不同之处在于RCDOP方案使用PLD替代了多柔比星或表柔比星,其余化疗药物相同。PLD是多柔比星的一种新剂型,系将多柔比星包封于表面结合有甲氧基聚乙二醇的脂质体微球中,可以保护脂质体免受单核巨噬细胞系统(MPS)识别,血浆半衰期更长。包括NHL在内的肿瘤组织因血管渗透性高,对PLD摄取更多。邵奕等[13]在针对以上两组方案治疗大包块和(或)结外多部位累及的DLBCL患者的安全性观察中发现,RCDOP组的IP发生率高于RCHOP组(24.24%比11.11%,P<0.05),而心脏不良反应发生率明显低于RCHOP组(12.12%比24.44%,P<0.05)。该结论与文献[14,15,16,17]报道一致。两种治疗方案虽疗效相当,但脂质体多柔比星因其心脏毒性小、不良反应少、安全性更高,而被广泛用于老年DLBCL患者的联合化疗中,并可改善老年患者的长期生存。
IP在淋巴瘤的化疗中是一种罕见但严重的潜在致命不良反应。已有研究表明IP的发生与应用利妥昔单抗、细胞毒性药物(多柔比星或表柔比星、环磷酰胺)、疾病中晚期、中性粒细胞减少均相关[18,19,20,21,22]。我国研究者开展的一项研究发现,接受RCDOP和CDOP方案的NHL患者IP的发生率高于RCHOP和CHOP方案,接受RCDOP方案化疗的NHL患者IP较CDOP方案化疗严重[23]。本研究就RCDOP方案组与RCHOP方案组的IP发生率进行了比较,145例患者中34例(23.4%)发生IP,RCDOP方案和RCHOP方案治疗DLBCL后IP发生率分别为31.5%和15.3%,差异有统计学意义(P<0.05)。与Zhou等[23]的研究相比,本研究入组患者病理类型均为DLBCL,在研究过程中忽略了其他病理类型的患者,可能导致IP发生数量及发生率出现偏差,结果也正是如此反映的。多因素回归分析显示,应用RCDOP方案、年龄≥60岁是患者治疗后发生IP的独立危险因素。
有研究表明,PLD与环磷酰胺、长春碱类、抗CD20单抗或抗CD30单抗联合应用时,可能会加重其他药物所造成的肺损伤[5],该研究将不含利妥昔单抗的CDOP方案组和CHOP方案组进行了比较,但由于两组病例数太少,各组仅有1例发生IP,未能得出有说服力的结论。本研究入组2013年至2020年的患者,早些年使用脂质体多柔比星的患者较少,导致病例数不足,可通过增加近几年的病例来弥补这一不足。
综上所述,对于年龄≥60岁且接受含PLD的RCDOP方案化疗的患者,在行4个周期化疗后,应警惕有无呼吸道症状、有无肺部CT呈磨玻璃样改变、有无粒细胞缺乏伴感染,应高度重视IP的发生。本研究的不足之处在于:(1)未行支气管肺泡灌洗检查,IP的诊断完全依赖于临床表现及肺部影像学改变,可能存在肺部感染与肺部间质性病变鉴别不清的情况,今后仍需完善肺泡灌洗检查以明确诊断;(2)本研究是一项小样本回顾性研究,需要大规模的前瞻性研究明确PLD与IP发生的相关性,了解如何对IP进行早期预防和干预。
所有作者均声明不存在利益冲突



























