
探讨自噬相关基因Beclin-1、LC3和p62在食管鳞状细胞癌(ESCC)中的表达及意义。
回顾性分析2015年1月至2016年12月解放军陆军第八十一集团军医院接受手术治疗的112例原发性ESCC患者的临床资料。免疫组织化学法检测112例ESCC组织及31例癌旁正常食管黏膜组织中Beclin-1、p62和LC3蛋白的表达情况,分析3种自噬相关标志物在ESCC中的表达及其与患者临床病理特征的关系。
112例ESCC组织中Beclin-1、LC3和p62阳性表达率分别为32.14%(36/112)、37.50%(42/112)和63.39%(71/112),31例癌旁正常食管黏膜阳性表达率分别为61.29%(19/31)、64.52%(20/31)和32.26%(10/31),差异均有统计学意义(χ2值分别为8.715、7.216、9.584,均P<0.01)。Beclin-1、LC3在ESCC中的阳性表达率均低于癌旁正常食管黏膜,p62在ESCC中的阳性表达率则高于癌旁正常食管黏膜。Beclin-1表达与ESCC患者组织学分级、肿瘤浸润深度、TNM分期、是否存在淋巴结转移均有关(均P<0.05);LC3表达与ESCC患者肿瘤浸润深度、TNM分期均有关(均P<0.01);p62表达与ESCC患者是否存在淋巴结转移有关(P<0.01)。在ESCC中,LC3与Beclin-1的表达呈正相关(r=0.731,P=0.001),而与p62的表达呈负相关(r=-0.215,P=0.023)。
自噬在ESCC的发生、发展中发挥一定作用,联合检测自噬相关基因Beclin-1、p62和LC3可辅助临床诊断并指导后续综合治疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
食管癌在我国高发,其死亡率在恶性肿瘤中居第4位[1]。食管鳞状细胞癌(ESCC)是食管癌最常见的组织学类型。自噬是一种借助溶酶体降解细胞器及自身受损的大分子物质,进而维持细胞内环境稳态、正常发育、分化及适应不利环境的自我保护途径。自噬在机体的生理、病理过程中均可见到,除了参与细胞发育、分化、成熟及死亡的调控外,还与肿瘤的发生、发展及演变存在密切关系[2]。本研究采用免疫组织化学法检测ESCC中自噬相关基因Beclin-1、p62和LC3的蛋白表达情况,分析其与患者临床病理特征的关系,进一步探讨自噬在ESCC发生、发展中的意义。
纳入标准:(1)行食管癌根治性切除术;(2)经术后病理诊断为ESCC;(3)术前未见明显远处转移。排除标准:(1)术前接受放疗、化疗、生物治疗或免疫治疗;(2)存在多发病灶,病理无法证实;(3)伴有心、肝、肾等衰竭;(4)临床资料不完整。根据以上标准,选取我院病理科2015年1月至2016年12月手术切除的112例原发性ESCC及31例癌旁正常食管黏膜(距肿瘤组织>5 cm)标本。112例ESCC患者中,男性75例,女性37例;中位年龄61岁(28~79岁)。癌旁正常食管黏膜标本经病理证实无肿瘤细胞浸润,且无明显细胞增生及炎症等病变。本研究符合2013年修订的《赫尔辛基宣言》的要求,通过解放军陆军第八十一集团军医院医学伦理委员会批准,豁免知情同意。
将标本4 μm厚连续切片,进行免疫组织化学SP法检测。兔抗人Beclin-1多克隆抗体(货号:PD017)、兔抗人p62多克隆抗体(货号:PM045)、兔抗人LC3多克隆抗体(货号:PM036)均购自日本MBL公司。磷酸盐缓冲液(PBS)、柠檬酸抗原修复缓冲液、SP试剂盒、二氨基联苯胺(DAB)显色剂等均购自勃盛化学试剂有限公司。以PBS代替一抗作阴性对照。
Beclin-1、LC3及p62蛋白阳性信号主要定位于细胞质。分别由两位病理医师双盲阅片,以细胞质出现均匀一致的棕黄色颗粒为阳性表达。依据着色强度及阳性细胞比例综合计分,高倍镜下随机选取5个视野,阳性细胞比例:<25%为1分,25%~49%为2分,≥50%为3分;着色程度:无着色为0分,灰黄色为1分,金黄色为2分,棕黄色为3分;上述两项指标评分相加,0~2分为阴性,≥3分为阳性[3]。
采用SPSS 19.0统计分析软件。计数资料比较采用χ2检验或Fisher确切概率法;相关性分析采用Spearman等级相关。P<0.05为差异有统计学意义。
112例ESCC组织中Beclin-1、LC3和p62阳性表达率分别为32.14%(36/112)、37.50%(42/112)和63.39%(71/112)(图1),31例癌旁正常食管黏膜组织中阳性表达率分别为61.29%(19/31)、64.52%(20/31)和32.26%(10/31),差异均有统计学意义(χ2值分别为8.715、7.216、9.584,均P<0.01)。Beclin-1、LC3在ESCC中的阳性表达率均低于癌旁正常食管黏膜,p62在ESCC中的阳性表达率则高于癌旁正常食管黏膜。
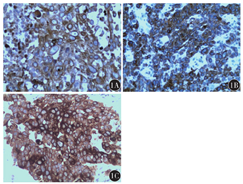

Beclin-1表达与ESCC患者组织学分级、肿瘤浸润深度、TNM分期、是否存在淋巴结转移均有关(均P<0.05);LC3表达与ESCC患者肿瘤浸润深度、TNM分期均有关(均P<0.01);p62表达与ESCC患者是否存在淋巴结转移有关(P<0.01)(表1)。

不同临床病理特征的食管鳞状细胞癌患者自噬相关基因Beclin-1、p62和LC3的表达情况(例)
不同临床病理特征的食管鳞状细胞癌患者自噬相关基因Beclin-1、p62和LC3的表达情况(例)
| 临床特征 | Beclin-1 | χ2值 | P值 | LC3 | χ2值 | P值 | p62 | χ2值 | P值 | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||||||||
| 性别 | |||||||||||||
| 男性 | 24 | 51 | 0.002 | 0.963 | 29 | 46 | 0.132 | 0.717 | 45 | 30 | 1.126 | 0.289 | |
| 女性 | 12 | 25 | 13 | 24 | 26 | 11 | |||||||
| 年龄(岁) | |||||||||||||
| ≤30 | 0 | 1 | - | 0.656 | 1 | 0 | - | 0.210 | 0 | 1 | - | 0.253 | |
| >30且≤60 | 19 | 35 | 23 | 31 | 32 | 22 | |||||||
| >60 | 17 | 40 | 18 | 39 | 39 | 18 | |||||||
| 组织学分级 | |||||||||||||
| Ⅰ级 | 30 | 16 | 13.363 | <0.01 | 19 | 17 | 5.285 | 0.071 | 28 | 8 | 4.897 | 0.086 | |
| Ⅱ级 | 13 | 50 | 19 | 44 | 35 | 28 | |||||||
| Ⅲ级 | 3 | 10 | 4 | 9 | 8 | 5 | |||||||
| 浸润深度 | |||||||||||||
| 黏膜下层以内 | 9 | 2 | 21.098 | <0.01 | 8 | 3 | 30.713 | <0.01 | 9 | 2 | 1.800 | 0.407 | |
| 肌层 | 16 | 19 | 24 | 13 | 23 | 14 | |||||||
| 全层 | 11 | 42 | 10 | 54 | 39 | 25 | |||||||
| TNM分期 | |||||||||||||
| Ⅰ期 | 9 | 2 | - | <0.01 | 8 | 3 | 29.945 | <0.01 | 9 | 2 | 3.291 | 0.349 | |
| Ⅱ期 | 16 | 19 | 23 | 12 | 22 | 13 | |||||||
| Ⅲ期 | 11 | 42 | 9 | 44 | 34 | 19 | |||||||
| Ⅳ期 | 0 | 13 | 2 | 11 | 6 | 7 | |||||||
| 淋巴结转移 | |||||||||||||
| 有 | 29 | 44 | 5.527 | 0.019 | 32 | 41 | 3.590 | 0.058 | 55 | 18 | 12.900 | <0.01 | |
| 无 | 7 | 32 | 10 | 29 | 16 | 23 | |||||||
注:-为Fisher确切概率法
在ESCC中,LC3与Beclin-1表达呈正相关(r=0.731,P=0.001),与p62的表达呈负相关(r=-0.215,P=0.023)。
关于自噬在肿瘤发生、发展过程中发挥的作用目前仍存在很多争议,一方面自噬可通过抑制细胞增殖或DNA突变,进而诱导细胞发生凋亡,进一步抑制肿瘤的形成;另一方面自噬可通过更新细胞器、维持细胞内代谢稳定,进而保护癌细胞免受化疗药物的破坏,最终促进肿瘤的发展。因此认为自噬在肿瘤的形成、发展及转归过程中具有双向作用[4,5,6,7,8,9]。考虑到自噬作用的双重性,如何通过调节自噬来增加肿瘤细胞对化疗药物的敏感性,需要研究者对肿瘤细胞中自噬的调控机制有更深入和全面的认识。
Beclin-1是哺乳动物中发现的首个与自噬相关的抑癌基因,在多种肿瘤发生、发展的不同时期和不同内环境中,其表达存在一定的差异[10,11,12,13],即Beclin-1不仅参与自噬体形成进而维持细胞内代谢稳定,还可通过调节自噬活性起到抑制肿瘤的效果。特别是定位于胞质内质网的Beclin-1,是诱导肿瘤细胞死亡的重要因素[10]。有研究报道,在乳腺癌、卵巢癌、前列腺癌等多种实体瘤中可观察到Beclin-1基因缺失[14,15,16];将基因功能缺失的乳腺癌细胞恢复Beclin-1功能后再接种至裸鼠,其增殖和形成肿瘤的能力降低[17]。本研究结果显示,Beclin-1在ESCC中阳性表达率低于癌旁正常食管黏膜,差异有统计学意义。Beclin-1的异常表达与ESCC患者的TNM分期、肿瘤的浸润深度、组织学分级以及患者是否存在淋巴结转移等均相关。肿瘤分化程度越低、侵及食管壁越深、患者TNM分期越高、伴有淋巴结转移时,Beclin-1阳性表达率越低。与王颖[18]的研究结果相一致。
LC3是自噬发生最重要的标志物,是一种泛素样蛋白,分为LC3Ⅰ和LC3Ⅱ。LC3前体被Atg4切割,产生胞质LC3Ⅰ,其在脂化后转化为LC3Ⅱ,并结合到自噬囊泡中具有高亲和力的自噬体膜上[19],故LC3的含量在一定程度上可以体现自噬活性,可作为检测自噬的可靠标志物。由原癌基因c-myc编码的p62(也称SQSTM1)亦是一种自噬相关蛋白。作为自噬过程中的底物,p62在泛素化蛋白和LC3间起连接作用并形成复合体。p62会随着自噬活性的抑制而表达增多。本研究结果显示,LC3和p62在ESCC和癌旁正常食管黏膜组织中的表达差异均有统计学意义。LC3的异常表达与ESCC患者的TNM分期以及肿瘤的浸润深度相关。p62在ESCC中的异常表达与患者是否存在淋巴结转移相关。这些结果提示自噬相关标志物LC3和p62在ESCC的发生、发展中亦具有一定的作用。此外在ESCC中,LC3与Beclin-1的表达呈正相关,而与p62的表达呈负相关,这与孙文凯等[11]的研究结果相一致。此外,杨燕和张毓[20]的研究结果显示,LC3、Beclin-1在乳腺癌中表达均降低,且与乳腺癌的预后相关。因此联合检测自噬相关基因Beclin-1、p62和LC3可辅助ESCC临床诊断并指导后续综合治疗。相关机制还需要进一步研究来深入探讨。
所有作者均声明不存在利益冲突



























