
探讨谷胱甘肽硫转移酶M1(GSTM1)和谷胱甘肽硫转移酶M2(GSTM2)在甲状腺滤泡癌(FTC)中的表达及其临床意义。
收集基因表达综合(GEO)数据库中甲状腺滤泡性肿瘤基因芯片GSE82208数据,共52例样本,包括FTC 27例,甲状腺滤泡性腺瘤(FA)25例。提取基因矩阵数据并整理,利用R语言Limma包筛选出FTC和FA间差异表达基因。收集2000年1月至2020年12月辽宁省丹东市第一医院手术切除的FTC及FA标本各56例。采用免疫组织化学SABC法检测FTC和FA标本中GSTM1、GSTM2蛋白的表达水平,分析二者与FTC患者临床病理因素间的关系及二者间的相互关系。
基于GEO数据库数据,共获得40个FTC和FA间差异表达基因;其中FTC中表达上调9个,分别为GSTM1、GSTM2、COL6A2、CUX2、CLUH、TSC2、OGDHL、ACADVL、SDHA;表达下调31个。免疫组织化学法检测显示,在手术切除FTC标本中,GSTM1、GSTM2阳性率分别为71.4%(40/56)、80.4%(45/56),在FA中阳性率分别为23.2%(13/56)、14.3%(8/56),差异均有统计学意义(χ2值分别为26.11、49.03,均P<0.01)。FTC中GSTM1和GSTM2蛋白表达与临床分期、浸润程度及远处转移均有关(均P<0.05),与性别、年龄和肿瘤长径均无关(均P>0.05)。FTC中GSTM1和GSTM2表达呈正相关(r=0.384,P=0.004)。
FTC中GSTM1和GSTM2表达水平升高,二者可能相互作用,参与FTC的发生、发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
甲状腺滤泡性肿瘤是常见的甲状腺肿瘤类型,主要分为甲状腺滤泡性腺瘤(FA)及甲状腺滤泡癌(FTC)。大多数FTC和FA在形态上很难区分,两者最主要的区别是有无明确的包膜或血管侵犯。临床工作中有20% FTC被误认为FA[1]。谷胱甘肽硫转移酶(GST)能够催化还原性谷胱甘肽,参与肿瘤化疗药物的代谢[2]。本研究基于基因表达综合(GEO)数据库资料和手术切除标本,分析谷胱甘肽硫转移酶M1(GSTM1)和谷胱甘肽硫转移酶M2(GSTM2)在FTC中的表达,探讨二者与患者临床病理因素的关系,为FTC诊断及治疗提供新的思路。
从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)下载甲状腺滤泡性肿瘤基因芯片GSE82208数据,共52例样本,包括FTC 27例,FA 25例。将基因表达谱的原始数据利用Perl工具对ID和基因名转化,提取基因矩阵相关数据,将整理后的数据用R语言Limma包进行分析,按照以下条件筛选出FTC与FA之间差异表达的基因:(1)采用t检验,差异倍数校正后P<0.05;(2)log2差异倍数≥1,或log2差异倍数<-1。绘制差异基因火山图,根据差异基因在每个样本中的表达量绘制52例样本中差异基因表达热图。
收集2000年1月至2020年12月辽宁省丹东市第一医院手术切除FTC及FA标本各56例。FTC患者中,男性20例,女性36例,年龄(56±10)岁,范围22~76岁;所有FTC患者术前均未行放疗、化疗、内分泌及其他任何针对肿瘤的治疗,无甲状腺功能亢进、慢性淋巴细胞性甲状腺炎等甲状腺相关疾病。按照2017年美国癌症联合会(AJCC)分期标准进行临床分期。本研究经辽宁省丹东市第一医院医学伦理委员会批准(批准文号:202012069),所有患者均签署知情同意书。
一抗兔抗人GSTM1和GSTM2抗体及二抗均购自英国Abcam公司,即用型SABC免疫组织化学染色试剂盒、二氨基联苯胺(DAB)显色剂购自武汉博士德生物工程有限公司。所有组织标本经10%甲醛溶液固定后,脱水、包埋,4 μm厚切片。微波修复,3%过氧化氢封闭内源性过氧化物酶,血清封闭;依次加入一抗(1∶200稀释)、二抗及SABC,DAB显色,苏木精对比染色,常规脱水,透明,中性树胶封片。以磷酸盐缓冲液(PBS)取代一抗作为阴性对照。
镜下GSTM1和GSTM2蛋白主要定位于细胞质或细胞膜,呈黄色或棕黄色颗粒。由两位经验丰富的病理科医生双盲法独立阅片。结果采用半定量计分法判断。阳性细胞比例评分:随机选取5个高倍(200倍)视野,每张切片中的阳性细胞比例<5%为0分,≥5%且<25%为1分,≥25%且<50%为2分,≥50%为3分;着色强度评分:无着色为0分,淡黄色为1分,黄色或棕黄色为2分,褐色或棕褐色为3分。两评分相乘≥4分为阳性,<4分为阴性。
采用SPSS 22.0统计学软件进行数据分析。计数资料比较用χ2检验,条件不足者进行连续性修正。计量资料符合正态分布,以均数±标准差( ±s)表示,两组间比较采用t检验。FTC组织中GSTM1和GSTM2蛋白表达的等级相关性采用Spearman法进行分析。P<0.05为差异有统计学意义。
±s)表示,两组间比较采用t检验。FTC组织中GSTM1和GSTM2蛋白表达的等级相关性采用Spearman法进行分析。P<0.05为差异有统计学意义。
按照筛选条件,从GEO数据库中获得40个FTC和FA间差异表达的基因,其中表达上调9个,分别为GSTM1、GSTM2、COL6A2、CUX2、CLUH、TSC2、OGDHL、ACADVL、SDHA;表达下调31个(图1)。52例样本中40个差异表达基因热图见图2。
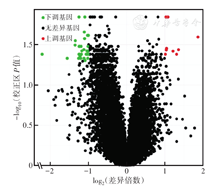

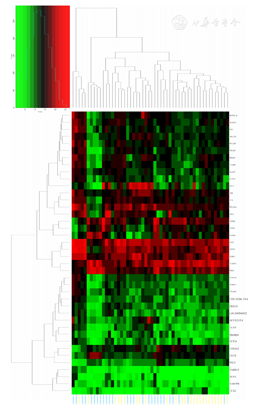

注:FTC为甲状腺滤泡癌;FA为甲状腺滤泡性腺癌;GEO为基因表达综合;红色为组织样本中基因的相对表达水平高,绿色为组织样本中基因的相对表达水平低;蓝色序号病例为FTC,黄色序号病例为FA
免疫组织化学检测显示,GSTM1和GSTM2蛋白在FA中不表达或局灶表达,二者在FTC中呈弥漫性强阳性表达(图3)。GSTM1、GSTM2在FTC中的阳性率分别为71.4%(40/56)、80.4%(45/56),在FA中的阳性率分别为23.2%(13/56)、14.3%(8/56),差异均有统计学意义(χ2值分别为26.11、49.03,均P<0.01)。
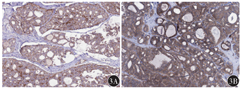

GSTM1和GSTM2蛋白在FTC中表达均与患者临床分期、浸润程度及是否远处转移有关(均P<0.05),与年龄、性别、肿瘤长径无关(均P>0.05)(表1)。
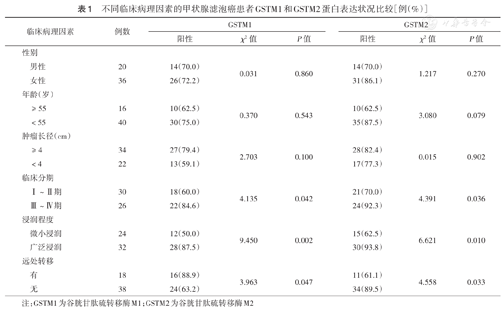
不同临床病理因素的甲状腺滤泡癌患者GSTM1和GSTM2蛋白表达状况比较[例(%)]
不同临床病理因素的甲状腺滤泡癌患者GSTM1和GSTM2蛋白表达状况比较[例(%)]
| 临床病理因素 | 例数 | GSTM1 | GSTM2 | |||||
|---|---|---|---|---|---|---|---|---|
| 阳性 | χ2值 | P值 | 阳性 | χ2值 | P值 | |||
| 性别 | ||||||||
| 男性 | 20 | 14(70.0) | 0.031 | 0.860 | 14(70.0) | 1.217 | 0.270 | |
| 女性 | 36 | 26(72.2) | 31(86.1) | |||||
| 年龄(岁) | ||||||||
| ≥ 55 | 16 | 10(62.5) | 0.370 | 0.543 | 10(62.5) | 3.080 | 0.079 | |
| <55 | 40 | 30(75.0) | 35(87.5) | |||||
| 肿瘤长径(cm) | ||||||||
| ≥ 4 | 34 | 27(79.4) | 2.703 | 0.100 | 28(82.4) | 0.015 | 0.902 | |
| <4 | 22 | 13(59.1) | 17(77.3) | |||||
| 临床分期 | ||||||||
| Ⅰ~Ⅱ期 | 30 | 18(60.0) | 4.135 | 0.042 | 21(70.0) | 4.391 | 0.036 | |
| Ⅲ~Ⅳ期 | 26 | 22(84.6) | 24(92.3) | |||||
| 浸润程度 | ||||||||
| 微小浸润 | 24 | 12(50.0) | 9.450 | 0.002 | 15(62.5) | 6.621 | 0.010 | |
| 广泛浸润 | 32 | 28(87.5) | 30(93.8) | |||||
| 远处转移 | ||||||||
| 有 | 18 | 16(88.9) | 3.963 | 0.047 | 11(61.1) | 4.558 | 0.033 | |
| 无 | 38 | 24(63.2) | 34(89.5) | |||||
注:GSTM1为谷胱甘肽硫转移酶M1;GSTM2为谷胱甘肽硫转移酶M2
Spearman分析显示,FTC中GSTM1和GSTM2蛋白表达呈正相关(r=0.384,P=0.004)(表2)。
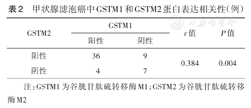
甲状腺滤泡癌中GSTM1和GSTM2蛋白表达相关性(例)
甲状腺滤泡癌中GSTM1和GSTM2蛋白表达相关性(例)
| GSTM2 | GSTM1 | r值 | P值 | |
|---|---|---|---|---|
| 阳性 | 阴性 | |||
| 阳性 | 36 | 9 | 0.384 | 0.004 |
| 阴性 | 4 | 7 | ||
注:GSTM1为谷胱甘肽硫转移酶M1;GSTM2为谷胱甘肽硫转移酶M2
近年来甲状腺癌的发病率呈增高趋势。FTC是继甲状腺癌乳头状癌(PTC)的第二常见甲状腺恶性肿瘤,其侵袭性远高于PTC,以血运转移为主,淋巴转移少见[3],根据浸润程度分为微小浸润FTC和广泛浸润FTC,两者预后差异明显[4]。FTC会通过血运转移至肺、骨及肝[5],致使患者复发,生存期缩短,预后差[6,7],因此积极探讨其发病机制具有重要意义。
随着高通量基因芯片技术的发展,生物信息学已成为探索生物学底层机制和研究人类复杂疾病诊断、治疗及预后的重要工具[8]。本研究从GEO数据库中下载52例(25例FA、27例FTC)人甲状腺滤泡性肿瘤基因表达谱数据,进行生物信息学分析后,共筛选出40个差异表达基因,包括上调基因9个,下调基因31个,上调基因中包括GSTM1和GSTM2。GST基因家族由多个基因型组成,与多种肿瘤发生存在关联。我们用免疫组织化学法检测GSTM1和GSTM2蛋白在FTC及FA组织中的表达情况,结果发现二者在FTC中表达均高于FA,与数据库分析结果一致。GSTM1基因位于1p13染色体,含有3种等位基因(a、b、null)。刘小涵等[9]对21篇文献进行Meta分析,发现GSTM1基因多态性与中国人群头颈部恶性肿瘤发病风险增加具有相关性。目前研究发现,肝癌、前列腺癌及乳腺癌均与GSTM1基因多态性相关[10,11,12]。本研究分析GSTM1和GSTM2蛋白与患者临床病理因素间关系时发现,在FTC中二者表达均与临床分期、浸润程度及远处转移有关,与年龄、性别、肿瘤大小均无关;FTC中GSTM1和GSTM2蛋白表达呈正相关。由此推测二者相互作用共同参与了FTC的发生与发展。既往研究发现畸胎瘤中过表达GSTM2与p38 MAPK的下调和AKT的激活有关[13]。而GSTM1和GSTM2在FTC中的促肿瘤作用及在信号通路中的具体机制尚待进一步研究。
综上所述,GSTM1和GSTM2可能共同作用参与了FTC的发生、发展,为FTC的靶向治疗及诊断提供了新的思路,同时为后期细胞水平和动物模型实验提供了依据。
所有作者均声明不存在利益冲突































