
基于生物信息学探讨结肠腺癌中胶原三股螺旋重复蛋白1(CTHRC1)基因表达的意义。
采用GEPIA2分析工具分析癌症基因组图谱(TCGA)数据库和GTEx数据库中结肠腺癌CTHRC1基因的表达及其与患者生存预后之间的关系;采用ULACAN分析工具分析TCGA数据库中CTHRC1基因在结肠腺癌组织和正常结肠组织中的甲基化水平。采用cBioportal网络分析工具分析CTHRC1基因突变。采用TIMER分析工具分析基因表达与免疫细胞浸润、肿瘤相关成纤维细胞浸润以及功能性免疫细胞之间的关系。采用STRING数据库分析与CTHRC1相互作用的蛋白,并进行富集分析。
在结肠腺癌组织中,CTHRC1基因和蛋白的表达水平均高于正常结肠组织,差异均有统计学意义(均P<0.01),且CTHRC1基因在正常结肠组织中呈现高甲基化水平,在肿瘤组织中为低甲基化水平(P<0.01)。2 480份结直肠腺癌和结肠腺癌样本中共检出19例突变,其中结肠腺癌标本CTHRC1突变3例,突变位点为R235H、A124V和R193C,突变类型均为错义突变。CTHRC1基因表达与CD8+ T细胞、CD4+ T细胞、巨噬细胞、中性粒细胞、树突细胞、肿瘤相关成纤维细胞浸润均呈正相关(均P<0.01)。CTHRC1基因高表达患者的总生存、无病生存均差于CTHRC1基因低表达患者(均P<0.05)。
CTHRC1基因甲基化、肿瘤相关免疫细胞的浸润可能在结肠腺癌的发病过程中具有重要意义,CTHRC1基因表达和免疫细胞浸润可以作为结肠腺癌患者生存预后的预测指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是一种常见的消化道肿瘤,在所有恶性肿瘤中致死率排第5位[1]。外科手术治疗和生物治疗靶点的确定使得结直肠癌患者5年总生存(OS)率有了明显提高,但仍有约40%患者复发或转移,导致治疗失败[2]。结肠腺癌是结肠癌常见的临床病理类型,其预后不良的主要原因之一为就诊时绝大部分患者已属中晚期,因此对于结肠腺癌选择合适的早期筛查指标进行筛查十分重要[3]。胶原三股螺旋重复蛋白1(CTHRC1)是一种编码蛋白,参与血管损伤后的重塑,与多种实体肿瘤的发生、发展密切相关,如前列腺癌、子宫颈癌、胃癌和乳腺癌等[4,5,6,7]。CTHRC1与结肠腺癌关系的研究较少,我们基于生物信息学分析CTHRC1基因在结肠腺癌发病过程中的可能作用,旨在为肿瘤的治疗和预后标志物选择提供新的依据。
采用GEPIA2分析工具对癌症基因组图谱(TCGA)数据库和GTEx数据库中CTHRC1基因的表达进行分析,"Box Plot"模块得出结肠腺癌组织和正常结肠组织中CTHRC1基因表达的箱式图;采用ULACAN分析工具中的"TCGA analysis"模块分析得出TCGA数据库中结肠腺癌组织和正常结肠组织中CTHRC1基因的表达;采用ULACAN分析工具中的"CPTAC analysis"模块分析结肠腺癌组织和正常结肠组织中CTHRC1蛋白的表达。
采用ULACAN分析工具中的"TCGA analysis"模块分析TCGA数据库中CTHRC1基因在结肠腺癌组织和正常结肠组织中的甲基化水平。
采用cBioportal网络分析工具分析CTHRC1基因突变。"Query"模块输入"COAD"进行查询,选择包含"COAD"的数据库,输入"CTHRC1"进行突变分析。
采用TIMER分析工具"Gene"模块,输入"CTHRC1"和"COAD"进行免疫细胞浸润分析;"Immune"模块输入"CTHRC1"和"COAD"进行肿瘤相关成纤维细胞(CAF)浸润分析;TIMER分析工具"Correlation"模块分析CTHRC1基因表达与不同免疫细胞表面标志物之间的相关性;GEPIA2工具"Correlation Analysis"模块分析CTHRC1基因表达与不同免疫细胞表面标志物之间的相关性。
采用GEPIA2分析工具对结肠腺癌中不同CTHRC1基因水平患者的生存预后进行分析。"Surival Analysis"模块输入"CTHRC1"和"COAD"进行OS和无病生存(DFS)分析。
采用STRING数据库分析与CTHRC1相互作用的蛋白,构建蛋白互作图,并进行基因本体(GO)及京都基因与基因组百科全书(KEGG)富集分析。
采用SPSS 22.0软件进行统计学分析,计量资料满足正态分布,以均数±标准差( ±s)表示,组间比较采用两独立样本t检验;生存分析采用Kaplan-Meier法,并进行log-rank检验;相关性分析采用Pearson相关性分析法。以P<0.05为差异有统计学意义。
±s)表示,组间比较采用两独立样本t检验;生存分析采用Kaplan-Meier法,并进行log-rank检验;相关性分析采用Pearson相关性分析法。以P<0.05为差异有统计学意义。
在结肠腺癌组织中,CTHRC1基因和蛋白的表达水平均高于正常结肠组织,差异均有统计学意义(均P<0.01)。分析CTHRC1基因启动子的甲基化水平显示,CTHRC1基因在正常结肠组织中呈高甲基化水平,结肠腺癌组织中呈低甲基化水平,差异具有统计学意义(P<0.01)(图1)。
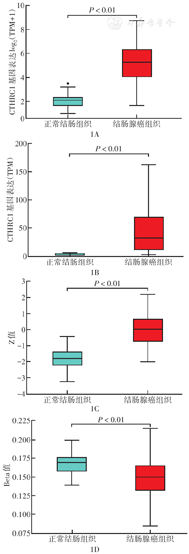

注:CTHRC1为胶原三股螺旋重复蛋白1;TPM为每百万reads中转录本;Z值为样本中位数的标准差;Beta值为从0(未甲基化)到1(完全甲基化)的DNA甲基化水平
TCGA数据库共检索出2 407例患者的2 480份结直肠腺癌和结肠腺癌样本。共检出19例突变,突变频率0.77%(19/2 480),其中结肠腺癌样标中CTHRC1突变3例,突变位点为R235H、A124V和R193C,突变类型均为错义突变(表1)。
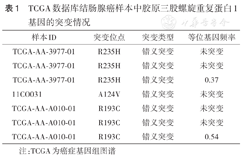
TCGA数据库结肠腺癌样本中胶原三股螺旋重复蛋白1基因的突变情况
TCGA数据库结肠腺癌样本中胶原三股螺旋重复蛋白1基因的突变情况
| 样本ID | 突变位点 | 突变类型 | 等位基因频率 |
|---|---|---|---|
| TCGA-AA-3977-01 | R235H | 错义突变 | 未突变 |
| TCGA-AA-3977-01 | R235H | 错义突变 | 未突变 |
| TCGA-AA-3977-01 | R235H | 错义突变 | 0.37 |
| 11CO031 | A124V | 错义突变 | 未突变 |
| TCGA-AA-A010-01 | R193C | 错义突变 | 未突变 |
| TCGA-AA-A010-01 | R193C | 错义突变 | 未突变 |
| TCGA-AA-A010-01 | R193C | 错义突变 | 0.54 |
注:TCGA为癌症基因组图谱
分析CTHRC1基因表达与免疫细胞(B细胞、CD8+ T细胞、CD4+ T细胞、巨噬细胞、中性粒细胞、树突细胞)、CAF浸润间的相关性,结果显示CTHRC1基因表达与B细胞浸润无相关性(r=0.092,P=0.06),而与CD8+ T细胞、CD4+ T细胞、巨噬细胞、中性粒细胞和树突细胞浸润均呈正相关(r值分别为0.31、0.32、0.61、0.51、0.50,均P<0.01);用TIMER分析工具中EPIC、MCPCOUNT、TIDE、XCELL软件分析发现,CTHRC1基因表达与CAF浸润也呈正相关(r值分别为0.89、0.89、0.85、0.69,均P<0.01)。
为进一步分析CTHRC1表达和免疫细胞浸润在结肠腺癌中的关系,我们通过TIMER和GEPIA2工具分析了其他功能性免疫细胞Tfh(bcl-6、ICOS、CXCR5)、Th1(T-bet、STAT4、IL12RB2、STAT1)、Th2(GATA3、CCR3、STAT5A)、巨噬细胞(CD68、CD11B)、M1(INOS、IRF5、COX2)、M2(MRC1、MS4A4A)、肿瘤相关巨噬细胞(CCL2、CD80、CD86、CCR5)等标志物与CTHRC1表达的相关性。结果显示除INOS外,其他免疫细胞标志物与CTHRC1表达均呈正相关(均P<0.05)(表2、图2)。
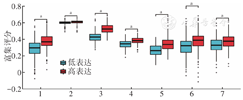

注:1为树突细胞;2为CD8+ T细胞;3为巨噬细胞;4为Th1细胞;5为中性粒细胞;6为调节性T细胞;7为T细胞;aP<0.01
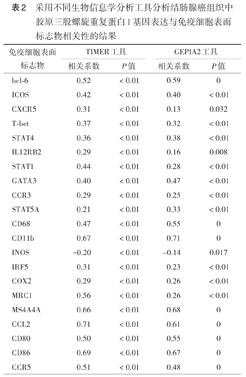
采用不同生物信息学分析工具分析结肠腺癌组织中胶原三股螺旋重复蛋白1基因表达与免疫细胞表面标志物相关性的结果
采用不同生物信息学分析工具分析结肠腺癌组织中胶原三股螺旋重复蛋白1基因表达与免疫细胞表面标志物相关性的结果
| 免疫细胞表面标志物 | TIMER工具 | GEPIA2工具 | ||
|---|---|---|---|---|
| 相关系数 | P值 | 相关系数 | P值 | |
| bcl-6 | 0.52 | <0.01 | 0.59 | 0 |
| ICOS | 0.42 | <0.01 | 0.40 | <0.01 |
| CXCR5 | 0.31 | <0.01 | 0.13 | 0.032 |
| T-bet | 0.37 | <0.01 | 0.32 | <0.01 |
| STAT4 | 0.36 | <0.01 | 0.38 | <0.01 |
| IL12RB2 | 0.29 | <0.01 | 0.16 | 0.008 |
| STAT1 | 0.44 | <0.01 | 0.28 | <0.01 |
| GATA3 | 0.40 | <0.01 | 0.47 | <0.01 |
| CCR3 | 0.29 | <0.01 | 0.25 | <0.01 |
| STAT5A | 0.21 | <0.01 | 0.33 | <0.01 |
| CD68 | 0.47 | <0.01 | 0.55 | 0 |
| CD11b | 0.67 | <0.01 | 0.71 | 0 |
| INOS | -0.20 | <0.01 | -0.14 | 0.017 |
| IRF5 | 0.31 | <0.01 | 0.23 | <0.01 |
| COX2 | 0.29 | <0.01 | 0.26 | <0.01 |
| MRC1 | 0.56 | <0.01 | 0.26 | <0.01 |
| MS4A4A | 0.66 | <0.01 | 0.68 | 0 |
| CCL2 | 0.71 | <0.01 | 0.61 | 0 |
| CD80 | 0.50 | <0.01 | 0.55 | 0 |
| CD86 | 0.69 | <0.01 | 0.67 | 0 |
| CCR5 | 0.51 | <0.01 | 0.48 | 0 |
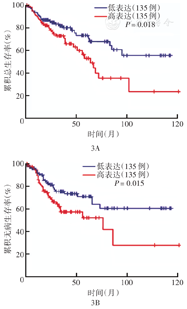
根据CTHRC1基因表达将结肠腺癌患者分为高表达组和低表达组,通过GEPIA2工具分析CTHRC1基因表达对患者OS、DFS的影响,结果显示CTHRC1基因高表达患者的OS、DFS均差于CTHRC1基因低表达患者,差异均有统计学意义(均P<0.05)(图3)。

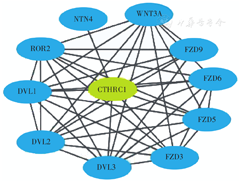
采用STRING数据库分析得出与CTHRC1相互作用的蛋白主要包括FZD3、FZD5、FZD6、FZD9、DVL1、DVL2、DVL3、ROR2、WNT3A和NTN4(图4)。对上述蛋白进行GO及KEGG富集分析发现,分子功能主要在Wnt蛋白结合、Wnt激活受体活性、卷曲蛋白结合等富集;通路方面主要在基底细胞癌、黑色素生成、Notch信号通路和Wnt信号通路等富集(表3)。

CTHRC1相关蛋白富集分析结果
CTHRC1相关蛋白富集分析结果
| ID信息 | 富集类别 | 功能描述 | 丰度 | 校正后P值 |
|---|---|---|---|---|
| GO:1904693 | 生物途径 | 中脑形态发生 | 3.07 | <0.01 |
| GO:0033278 | 生物途径 | 中脑细胞增殖 | 2.95 | <0.01 |
| GO:0045334 | 细胞组成 | 网格蛋白包被胞吞囊泡 | 2.00 | <0.01 |
| GO:0016328 | 细胞组成 | 外侧脂膜 | 1.81 | <0.01 |
| GO:0030136 | 细胞组成 | 网格蛋白包被小泡 | 1.62 | <0.01 |
| GO:0017147 | 分子功能 | Wnt蛋白结合 | 2.54 | <0.01 |
| GO:0042813 | 分子功能 | Wnt激活的受体活性 | 2.53 | <0.01 |
| GO:0005109 | 分子功能 | 卷曲蛋白结合 | 2.46 | <0.01 |
| GO:0048365 | 分子功能 | Rac GTPase酶结合 | 1.95 | <0.01 |
| hsa05217 | KEGG富集 | 基底细胞癌 | 2.35 | <0.01 |
| hsa04916 | KEGG富集 | 黑色素生成 | 2.16 | <0.01 |
| hsa04330 | KEGG富集 | Notch信号通路 | 2.05 | <0.01 |
| hsa04310 | KEGG富集 | Wnt信号通路 | 2.00 | <0.01 |
注:CTHRC1为胶原三股螺旋重复蛋白1;GO为基因本体;KEGG为京都基因与基因组百科全书
结肠腺癌的发病过程受多种基因和蛋白的调控,CTHRC1是一种分泌性糖蛋白,主要功能是参与血管损伤后的重塑以及抑制胶原沉积[8],CTHRC1的异常表达与多种实体瘤的发生、发展密切相关[4,5,6,7],本研究通过生物信息学分析也验证了这一点。首先我们采用不同分析工具对CTHRC1基因在结肠腺癌中的表达进行分析,发现结肠腺癌组织中CTHRC1基因及蛋白均为高表达状态。同时我们还分析了结肠腺癌组织中CTHRC1基因甲基化的情况,发现在肿瘤组织中,CTHRC1基因呈低甲基化状态,表明CTHRC1基因启动子低甲基化导致的基因高表达可能是结肠腺癌发病的一种潜在机制。由于甲基化是一种不涉及基因序列改变的化学修饰,甲基化的改变往往发生在肿瘤的早期阶段,这也为CTHRC1可能成为结肠腺癌早期诊断的指标提供了理论基础。
基因突变在肿瘤的发生、发展过程中扮演着重要的角色,CTHRC1基因突变在胃腺癌和食管腺癌中也有报道[9,10]。本研究分析了结肠腺癌中CTHRC1基因的遗传突变情况,TCGA数据库中结直肠腺癌的突变频率为0.77%(19/2 480),均为错义突变;在发生突变的结肠腺癌样本中,有2例发生了等位基因突变,频率分别为0.37和0.54,并且在这些突变的样本中,基因突变与患者OS、DFS无相关性,表明CTHRC1基因突变可能不是结肠腺癌发生、发展的主要原因。
恶性肿瘤的发展过程中,免疫细胞以多种形式存在,淋巴细胞是免疫浸润的主要组成部分,也称为肿瘤浸润淋巴细胞(TIL)。TIL可以产生不同的免疫应答,直接反映免疫系统对肿瘤局部的免疫应答[11,12]。肿瘤的发生离不开肿瘤细胞与肿瘤微环境(TME)细胞间的相互作用,TME由基质细胞(包括巨噬细胞、调节性T细胞、成纤维细胞等)和细胞外基质组成[13]。所以研究肿瘤相关免疫细胞对了解肿瘤的发生、发展、转移及预后有着重要作用。有研究表明TIL丰度、类型以及在TME中的位置对结直肠癌的发生、发展有着直接影响[14],结直肠癌的不良预后与高密度的CAF浸润密切相关[15]。本研究中也发现了CTHRC1基因表达与肿瘤中免疫细胞(除B细胞外)和CAF的浸润水平呈正相关,提示CTHRC1转录水平的分析可能反映机体免疫状态,但究竟是CTHRC1高表达导致免疫细胞浸润还是免疫细胞浸润导致CTHRC1基因高表达,进而影响预后,还需要进一步研究证实。
本研究还同时分析了CTHRC1表达与结肠腺癌患者生存预后之间的关系,发现CTHRC1基因高表达的患者OS、DFS均差于低表达患者,提示CTHRC1可能是评估结肠腺癌预后的指标。
研究表明CTHRC1的过表达可以诱导结肠癌细胞上皮-间质转化,并促进细胞运动,导致患者预后不良[16]。CTHRC1在体外促进肿瘤细胞迁徙的能力可能与激活Wnt-PCP通路有关[17]。通过蛋白相互作用分析发现,与CTHRC1相关的蛋白主要为DVL家族(DVL1、DVL2、DVL3)和FZD家族(FZD3、FZD5、FZD6、FZD9),这些蛋白都可以直接和间接通过Wnt-PCP信号通路参与人类实体瘤的进程[18],而CTHRC1也可以通过激活Wnt-PCP信号通路促进结直肠癌细胞的侵袭和增殖[19],这与GO和KEGG富集结果大致一致,也验证了CTHRC1可能在结肠腺癌发病及促进侵袭、转移过程中起重要作用。
综上所述,通过生物信息学分析可以较为系统地了解CTHRC1基因表达与甲基化、免疫细胞浸润以及生存预后之间的相关性,对CTHRC1基因在结肠腺癌中的致病机制有一定了解,为后续研究提供了一定的理论依据。
所有作者均声明不存在利益冲突



























