
初步观察信迪利单抗在晚期胰腺癌多线治疗中的临床疗效及安全性。
回顾性分析2020年4月至2021年4月于南京医科大学附属无锡第二医院接受信迪利单抗治疗的8例晚期胰腺癌患者的临床资料,患者病理类型均为腺癌。治疗方案为信迪利单抗单药或联合其他药物三线及以上治疗。按实体瘤疗效评价标准(RECIST)1.1评价临床疗效,统计客观缓解、疾病控制情况,采用Kaplan-Meier法分析无进展生存(PFS)、总生存(OS),采用常用不良事件术语标准(CTCAE)5.0评估不良反应并分级。
8例患者中男性5例,女性3例。8例患者中,1例部分缓解(PR),1例疾病稳定(SD),6例疾病进展(PD);客观缓解1例,疾病控制2例。中位PFS时间为2.0个月(95% CI 0.6~3.4个月),中位OS时间为3.5个月(95% CI 2.2~4.8个月)。主要不良反应为乏力(3例),皮疹、甲状腺功能亢进、甲状腺功能减退、尿路感染、高尿酸、高血糖、肾功能不全各1例。患者的不良反应主要为1~2级,未发生3~4级不良反应,经对症治疗好转。
多线治疗后进展的晚期胰腺癌患者有可能从信迪利单抗治疗中获益,且不良反应多可耐受。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2018年我国国家癌症中心发布的数据显示,在所有恶性肿瘤中,胰腺癌发病率位于第10位,死亡率位于第7位[1]。2019年我国胰腺癌患者5年生存率为7%~8%,晚期胰腺癌的中位生存期仅为3~6个月[2,3]。约60%的患者首诊时已转移,约30%的患者首诊时处于局部进展期,这是胰腺癌患者整体预后差的主要原因之一,且药物疗效有限[4]。近年来多项临床试验研究证明,以程序性死亡受体1(PD-1)为代表的免疫检查点抑制剂(ICI)在恶性黑色素瘤和肺癌等多个肿瘤中有显著的疗效[5,6],但抗PD-1单抗在胰腺癌中的初步探索结果不佳。本研究回顾性分析8例晚期胰腺癌患者多线治疗中应用信迪利单抗的临床疗效及安全性,以临床数据充实抗PD-1单抗对晚期胰腺癌治疗效果的证据。
纳入标准:(1)经组织病理学确诊的晚期胰腺导管腺癌;(2)信迪利单抗治疗前经影像学证实远处转移;(3)应用信迪利单抗进行单药或联合治疗。排除标准:(1)合并其他部位肿瘤;(2)合并其他严重内科疾病,如严重心肺疾病、肝肾功能不全、重症感染等。从2020年4月至2021年4月南京医科大学附属无锡第二医院收治的患者中,纳入符合条件患者8例,其中年龄>60岁者7例;男性5例,女性3例。本研究获得我院伦理委员会批准(批准文号:WX2H202012),所有患者均签署知情同意书。
8例患者均接受三线及三线以上抗PD-1单抗单药或联合其他药物治疗。信迪利单抗注射液(国药准字:S20180016)由信达生物制药(苏州)有限公司生产,剂量为200 mg,每3周1次,直至疾病进展(PD)、不良反应不可耐受或患者自行终止治疗;其中1例患者因经济原因减半量(100 mg)静脉输注。
收集患者的临床资料,包括美国东部肿瘤协作组(ECOG)评分、是否伴有疼痛、肝转移情况及手术史。同时收集患者治疗前的血液学资料,包括C反应蛋白(CRP)、中性粒细胞、淋巴细胞、D-二聚体、血清清蛋白、糖类抗原199(CA199)、癌胚抗原(CEA)以及血清总胆红素水平资料。以CT、磁共振成像(MRI)测量病灶大小,根据实体瘤疗效评价标准(RECIST)1.1,自首次应用信迪利单抗开始,每2~4个周期进行1次疗效评估。客观缓解为完全缓解(CR)+部分缓解(PR),疾病控制为CR+PR+疾病稳定(SD)。采用门诊或电话随访,随访至2021年4月或患者死亡。无进展生存(PFS)时间为从信迪利单抗治疗开始至复查发现肿瘤进展或死亡或末次随访的时间。总生存(OS)时间为从信迪利单抗治疗开始至患者死亡或末次随访的时间。采用常用不良事件术语标准(CTCAE)5.0评估不良反应并分级。
应用SPSS 25.0软件,采用Kaplan-Meier法进行生存分析。
8例患者中,年龄>60岁7例;男性5例,女性3例;ECOG评分>1分3例;6例曾接受过手术切除,其中3例在接受信迪利单抗前伴有肝转移;6例伴有疼痛。血液学检测结果示,CRP升高者5例,中性粒细胞升高2例,淋巴细胞减少5例,D-二聚体升高7例,血清清蛋白减少4例,血清总胆红素升高1例。
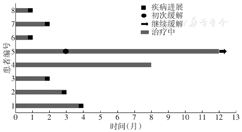
8例患者接受了至少1次信迪利单抗治疗,最多者治疗达8次。所有患者均接受了疗效评估,1例达PR,1例SD,6例患者PD(其中2例仅接受1次免疫治疗,因PD而死亡);客观缓解1例,疾病控制2例。8例患者应用信迪利单抗三线及以上治疗后疗效变化见图1。

8例患者信迪利单抗治疗期间出现的主要不良反应为乏力(3例),皮疹、甲状腺功能亢进、甲状腺功能减退、尿路感染、高尿酸、高血糖、肾功能不全各1例;不良反应皆为1~2级,无3~4级不良反应发生。所有不良反应经对症治疗后均好转。
随访至2021年4月,随访1~12个月。8例患者中,获得PR的1例和SD的1例均生存,其余6例PD患者均死亡。中位PFS时间为2.0个月(95%CI 0.6~3.4个月),中位OS时间为3.5个月(95%CI 2.2~4.8个月)。
(1)获得SD的患者为女性,64岁,2019年9月行胰腺癌手术,术后行放疗,后复查未见复发。2020年7月确诊为胰腺癌术后肠系膜上动脉周围转移,8月开始予信迪利单抗治疗。经信迪利单抗联合白蛋白结合型紫杉醇规律用药6个周期,疗效评价为SD,后予信迪利单抗单药维持治疗2个周期。至末次治疗(2021年4月2日),仍处于SD状态;不良反应主要为1级乏力,未影响治疗。(2)获得PR的患者为女性,74岁,2019年4月确诊为胰腺癌伴肺、淋巴结转移,无手术适应证,予局部姑息放疗后经多线化疗后进展。2020年4月开始予信迪利单抗治疗,治疗不规律,经信迪利单抗治疗2个周期后,腹泻症状明显好转,肿瘤指标CA199从645.0 U/ml降至80.2 U/ml,病灶缩小47.6%,疗效评价为PR。应用信迪利单抗治疗至末次治疗(2021年4月30日)期间,出现一系列不良反应,包括皮疹、甲状腺功能亢进、甲状腺功能减退、尿路感染、高尿酸、高血糖、肾功能不全,皆为1~2级,经对症治疗后好转。患者处于持续缓解中。该患者信迪利单抗治疗期间肿瘤相关指标及不良反应变化情况见表1,信迪利单抗治疗前后胸部及腹部病灶影像学变化见图2。
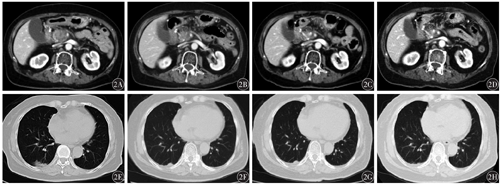

1例信迪利单抗多线治疗获得部分缓解的晚期胰腺癌伴肺、淋巴结转移患者治疗期间肿瘤指标、病灶大小变化及不良反应发生情况
1例信迪利单抗多线治疗获得部分缓解的晚期胰腺癌伴肺、淋巴结转移患者治疗期间肿瘤指标、病灶大小变化及不良反应发生情况
| 日期 | CA199(U/ml) | CEA(ng/ml) | 右肺下叶病灶 | 胰头区病灶 | 不良反应 |
|---|---|---|---|---|---|
| 2020年4月20日a | 645.0 | 10.25 | 2.4 cm×1.5 cm | 3.9 cm×3.2 cm | - |
| 2020年6月3日 | 80.2 | 4.04 | - | - | 甲状腺功能亢进 |
| 2020年7月16日 | 99.3 | 5.16 | 0.8 cm×1.6 cm | 2.5 cm×2.3 cm | 甲状腺功能减退 |
| 2020年9月11日 | 2.28 | 39.3 | 0.8 cm×1.6 cm | 2.5 cm×2.3 cm | 甲状腺功能减退、尿路感染 |
| 2020年11月13日 | 2.75 | 66.1 | - | - | 甲状腺功能减退、高尿酸、肾功能不全 |
| 2021年1月2日 | 1.60 | 62.7 | - | - | 甲状腺功能减退、皮疹、高尿酸、肾功能不全 |
| 2021年3月11日 | 1.35 | 44.2 | 0.9 cm×1.5 cm | 2.5 cm×2.3 cm | 甲状腺功能减退、高尿酸、肾功能不全 |
| 2021年4月28日 | 1.79 | 42.6 | - | - | 甲状腺功能减退、高尿酸、肾功能不全 |
注:CA199为糖类抗原199;CEA为癌胚抗原;-为无数据;a开始应用信迪利单抗治疗
胰腺癌发病隐匿且容易发生早期转移,诊断时约80%的患者已无手术机会[7]。化疗是晚期转移性胰腺癌的标准治疗方案,一线两药联合方案(吉西他滨、白蛋白结合型紫杉醇)中位OS时间仅为8.7个月[8],多药联合的FOLFIRINOX(由奥沙利铂、伊立替康、氟尿嘧啶、亚叶酸钙)方案中位OS时间为10.1个月[9]。二线两药联合方案(纳米脂质体伊立替康、氟尿嘧啶)中位OS时间仅为6.1个月[10]。二线化疗后并无循证医学数据证明有明确的可延长生存的有效药物。胰腺癌的诊治一直是临床工作的难点。近年来,以抗PD-1单抗为代表的ICI是肿瘤治疗的研究热点。一项泛肿瘤的临床试验研究发现,存在错配修复功能缺陷(dMMR)、微卫星高度不稳定(MSI)-H的肿瘤患者可能从抗PD-1单抗治疗中获益[11],但目前尚无充分证据,胰腺癌的免疫治疗策略尚在不断探索中。
本研究回顾性分析了信迪利单抗治疗晚期转移性胰腺癌的初步疗效及不良反应,结果不尽如人意,仅有1例患者获得疾病缓解,1例患者SD,多数不良反应可耐受,具有良好的安全性。大部分患者因经济原因并未检测相关程序性死亡受体配体1(PD-L1)表达以及肿瘤突变负荷(TMB)、MSI等指标。目前对免疫治疗有效的标志物尚无定论,如何以有效的预测指标筛选人群是未来胰腺癌免疫治疗的研究方向之一。有研究显示dMMR或MSI-H阳性的晚期转移性胰腺癌患者经抗PD-1单抗治疗的疾病控制率达75%,可作为免疫治疗获益的有效预测指标[11]。期待开展更多的临床研究检测相关免疫治疗预测指标,为临床诊治提供更多的循证医学证据。
有研究发现化疗可以通过杀死癌细胞释放肿瘤相关抗原,改变肿瘤免疫微环境,提高ICI引发的抗肿瘤免疫反应,从而起到协同抗肿瘤作用[12]。吉西他滨不仅可以通过诱导CD8+ T细胞的表达引发有效的抗肿瘤免疫反应,而且可以通过增加Ⅰ类人类淋巴细胞抗原(HLA)的表达,增强肿瘤抗原的递呈能力,从而起到协同免疫抗肿瘤作用[13,14]。一项ⅠB~Ⅱ期临床试验应用帕博丽珠单抗与化疗联合治疗17例转移性胰腺癌患者,疾病控制率达100%[13]。而本研究可能由于信迪利单抗治疗在三线及三线以上,且联合治疗病例较少,因此并未在免疫联合化疗的治疗方案中发现优势。
不可忽视的是,ICI在给患者带来疗效的同时也带来了自身炎症等不良反应。有研究显示,经PD-1及其配体PD-L1抑制剂治疗后,66%的患者出现过至少一种不良反应,而14%的患者出现过严重不良反应[15]。抗PD-1单抗通过与PD-1结合来刺激T细胞增殖和活化,这些激活的T细胞在识别肿瘤特异性抗原的同时也可能识别表达类似抗原的正常细胞,杀伤性CD8+ T细胞导致的细胞裂解会释放大量的肿瘤新生抗原以及自身抗原,从而激活了自身免疫反应[16,17]。本研究中获得PR的患者在免疫治疗的过程中出现了相关的不良反应,主要包括内分泌功能异常、皮疹、感染等,但均在可控范围;获得SD的患者和其中1例PD患者出现乏力,其余患者未出现不良反应,可能与治疗时间短有关。有研究显示,出现免疫不良反应的患者疗效可能会更好,且一些特定的免疫不良反应可能与疗效有一定的关系[18],但这还有待更多数据加以验证。
与传统化疗和靶向治疗相比,肿瘤免疫治疗的优势还在于其特有的生存拖尾效应,即部分患者经过免疫治疗后,随着时间的推移,生存曲线下降变得非常平缓,甚至变为水平。CheckMate-649研究发现免疫治疗一旦起效后,部分肿瘤患者可获得长期、持续的缓解,也就是所谓的长生存[19],这正是研究者关注的热点。本研究中经信迪利单抗治疗获得PR的患者同样获得相对长期、持续的缓解,随访至2021年4月底,该患者已获得了12个月的OS,仍处于持续缓解中,且不良反应多为1~2级,可耐受,不影响生命质量。有基础研究发现,即使停止免疫治疗,被激活的T细胞仍然可以通过持续杀伤肿瘤细胞、控制肿瘤细胞生长使患者获得更长的缓解期[20]。本研究结果显示,获得PR的晚期胰腺癌患者即使在因个人意愿减半量使用信迪利单抗治疗、延长治疗间期的情况下,仍未影响生存获益。可能的原因是,对免疫治疗敏感的患者在使用ICI后5%~10%的效应T细胞会在抵抗肿瘤的过程中存活下来,从而进一步发展成功能性记忆CD8+ T细胞,随着免疫应答的扩大,有更多的CD8+ T细胞发育成记忆性CD8+ T细胞,后者随着每次抗原刺激的累积产生记忆性扩张,即使原始刺激不再存在,仍然可以继续提供长期的免疫保护[20]。免疫治疗一旦起效,药物治疗周期可适当延长,如何调整药物剂量及治疗周期还有待开展更多的临床试验进行研究。
综上所述,本研究基于临床数据发现,对于少部分晚期胰腺癌患者,信迪利单抗具有较好、较持久的临床获益和安全性,但因本研究为回顾性研究、样本量较小、检测的免疫相关指标较少,尚需更多的临床试验来探索信迪利单抗在晚期胰腺癌治疗中的前景。
所有作者均声明不存在利益冲突



























