
探讨前哨淋巴结(SLN)阳性早期浸润性乳腺癌的脉管浸润与非前哨淋巴结(NSLN)转移的相关性及意义。
回顾性分析2015年1月至2021年2月武汉市中心医院活组织检查显示SLN阳性并行腋窝淋巴结清扫(ALND)的79例cT1~2N0M0期浸润性乳腺癌患者的临床病理资料。分析患者临床病理特征与NSLN转移的相关性。
79例患者中,58例(73.4%)行全乳切除术,61例(77.2%)为Luminal型,38例(48.1%)脉管浸润,64例(81.0%)1~2枚SLN阳性,行ALND后发现42例(53.2%)NSLN转移。单因素分析显示,脉管浸润组免疫组织化学诊断脉管浸润[86.8%(33/38)比51.2%(21/41)]、Ki-67阳性指数>30%[60.5%(23/38)比36.6%(15/41)]、人表皮生长因子受体2阳性[36.8%(14/38)比14.6%(6/41)]、淋巴结病理分期升期患者所占比例[57.9%(22/38)比31.7%(13/41)]较非脉管浸润组高(均P<0.05)。多因素logistic回归分析示,脉管浸润是NSLN转移的独立危险因素(OR=2.935,95% CI 1.081~7.970,P=0.035)。
脉管浸润是SLN阳性cT1~2N0M0期浸润性乳腺癌患者NSLN转移的独立危险因素,有助于指导腋窝局部处理决策的制订,避免治疗过度或不足。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乳腺癌全身综合治疗的进展促使外科治疗不断做"减法"[1],前哨淋巴结(SLN)活组织检查逐步取代腋窝淋巴结清扫(ALND)成为SLN阴性患者腋窝治疗的标准模式[2]。对于保乳术后且有放疗计划的1~2枚SLN宏转移或微转移者,单纯SLN活组织检查与ALND患者生存无差异,可免除ALND[3,4,5]。但在实际临床工作中,如何准确评估SLN阳性者非前哨淋巴结(NSLN)残余肿瘤负荷仍是亟需解决的难题。脉管浸润是乳腺癌的独立预后影响因素[6],根据肿瘤转移级联理论,肿瘤细胞浸润脉管并进入循环是肿瘤转移的早期关键事件[7]。国内外不同研究中心相继提出了NSLN转移预测模型[8],其中纳入脉管浸润的模型有纪念Sloan-Kettering癌症中心(MSKCC)、MD Anderson癌症中心及Stanford大学模型,MSKCC模型最早被提出并被广泛验证[9,10,11]。我们分析79例SLN阳性早期乳腺癌患者资料,探讨脉管浸润与NSLN转移的关系,并验证MSKCC模型预测本研究人群NSLN转移效果。
纳入标准:(1)cT1~2N0M0期(淋巴结临床分期通过乳腺体检、影像学检查或细针穿刺活组织检查明确);(2)依次接受全乳切除或保乳手术、SLN活组织检查及ALND。排除标准:(1)炎性乳腺癌、导管内原位癌或小叶内原位癌、妊娠期或哺乳期妇女;(2)cT3~4N1~3期、复发或转移性癌、其他肿瘤史、腋窝手术或治疗史;(3)接受任何新辅助治疗;(4)临床病理资料不完整。回顾性分析2015年1月至2021年2月武汉市中心医院活组织检查显示SLN阳性并行ALND的79例cT1~2N0M0期浸润性乳腺癌患者的临床病理资料。所有患者术前均签署了手术等相关知情同意书。本研究获得武汉大学人民医院临床研究伦理委员会批准(批准文号:WDRY2019-K088)。
SLN活组织检查术中示踪剂有亚甲基蓝、纳米炭、吲哚菁绿;经单示踪或双示踪后,切除可疑SLN,进行术中快速冷冻病理检查。
SLN活组织检查和ALND术后制备甲醛固定石蜡包埋的组织块(FFPE),并行连续性切片。冷冻切片经苏木精-伊红(HE)染色或FFPE切片经HE染色及免疫组织化学(IHC)染色评估淋巴结是否转移。根据淋巴结中转移病灶直径将转移分为宏转移(长径>2 mm)、微转移(长径0.2~2.0 mm)及孤立肿瘤细胞(ITC)(长径≤0.2 mm)。将宏转移或微转移定义为淋巴结阳性,ITC定义为淋巴结阴性。
所有HE及IHC切片均经两位病理医生双盲评估。病理分型参考2012年世界卫生组织(WHO)第4版乳腺肿瘤分类标准,组织学分级参考Elston-Ellis改良版Scarff-Bloom-Richardson分级系统,Ki-67判定参照2011年乳腺癌Ki-67国际工作组推荐评估指南,雌激素受体(ER)及孕激素受体(PR)判定参考2015版乳腺癌ER、PR IHC检测指南,人表皮生长因子受体2(HER2)判定参考乳腺癌HER2检测指南2014版。切片HE染色图像中脉管浸润定义为梭形血管或淋巴管内皮细胞围成的腔隙内有瘤细胞或瘤栓;IHC检测中脉管浸润的评估依据D2-40和CD31、CD34标记淋巴管或血管内皮细胞进行判断,相关试剂盒购自福州迈新生物技术开发公司,按试剂盒说明书进行操作。
登录MSKCC网站(http://nomograms.mskcc.org/Breast/BreastAdditionalNonSLNMetastases Page.aspx),输入患者相应信息(是否接受冷冻病理检查、原发肿瘤大小、病理类型及组织学分级、阳性及阴性SLN数、SLN检测方式、是否脉管浸润、是否肿瘤多中心、ER状态),获得每例患者NSLN的转移风险。
采用SPSS 19.0软件进行统计学分析。计量资料非正态分布,用中位数(范围)表示,组间比较采用非参数双侧Mann-Whitney U检验;计数资料组间比较采用χ2检验;采用多因素logistic回归模型分析NSLN转移影响因素;采用受试者工作特征(ROC)曲线对NSKCC模型预测NSLN转移的效果进行验证。以双侧P<0.05为差异有统计学意义。
79例患者中位诊断年龄54岁(32~81岁),中位肿瘤长径2.5 cm(0.4~5.0 cm);58例(73.4%)全乳切除,21例(26.6%)行保乳手术。SLN显影以单示踪为主,占62.2%(46/74),包括38例(51.4%)亚基蓝,6例(8.1%)纳米碳,2例(2.7%)吲哚菁绿;37.8%(28/74)为双示踪,包括19例(25.7%)亚基蓝联合吲哚菁绿,6例(8.1%)纳米碳联合吲哚菁绿,3例(4.1%)纳米碳联合亚甲基蓝。中位SLN阳性数为1枚(1~6枚),81.0%(64/79)患者为1~2枚SLN阳性,60.8%(48/79)为1枚SLN阳性。79例患者中,74例(93.7%)为非特殊类型浸润性癌,61例(77.2%)为Luminal型。脉管浸润38例(48.1%),其中33例经IHC诊断(1例为CD34染色,14例为CD34、D2-40染色,5例为CD31、D2-40染色,13例为CD31、CD34及D2-40染色)。
相比非脉管浸润组,脉管浸润组IHC诊断脉管浸润、Ki-67阳性指数>30%、HER2阳性、淋巴结病理分期升期患者比例均高(均P<0.05);其他临床病理特征分层间差异均无统计学意义(均P>0.05)(表1)。
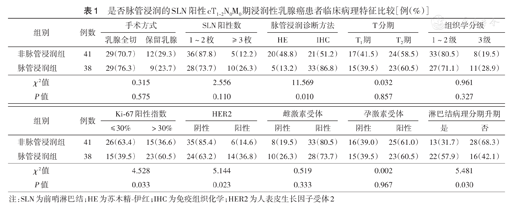
是否脉管浸润的SLN阳性cT1~2N0M0期浸润性乳腺癌患者临床病理特征比较[例(%)]
是否脉管浸润的SLN阳性cT1~2N0M0期浸润性乳腺癌患者临床病理特征比较[例(%)]
| 组别 | 例数 | 手术方式 | SLN阳性数 | 脉管浸润诊断方法 | T分期 | 组织学分级 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 乳腺全切 | 保留乳腺 | 1~2枚 | ≥ 3枚 | HE | IHC | T1期 | T2期 | 1~2级 | 3级 | ||
| 非脉管浸润组 | 41 | 29(70.7) | 12(29.3) | 36(87.8) | 5(12.2) | 20(48.8) | 21(51.2) | 17(41.5) | 24(58.5) | 33(80.5) | 8(19.5) |
| 脉管浸润组 | 38 | 29(76.3) | 9(23.7) | 28(73.7) | 10(26.3) | 5(13.2) | 33(86.8) | 15(39.5) | 23(60.5) | 27(71.1) | 11(28.9) |
| χ2值 | 0.315 | 2.556 | 11.569 | 0.032 | 0.961 | ||||||
| P值 | 0.575 | 0.110 | 0.010 | 0.857 | 0.327 | ||||||
| 组别 | 例数 | Ki-67阳性指数 | HER2 | 雌激素受体 | 孕激素受体 | 淋巴结病理分期升期 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ≤ 30% | >30% | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 是 | 否 | ||
| 非脉管浸润组 | 41 | 26(63.4) | 15(36.6) | 35(85.4) | 6(14.6) | 8(19.5) | 33(80.5) | 16(39.0) | 25(61.0) | 13(31.7) | 28(68.3) |
| 脉管浸润组 | 38 | 15(39.5) | 23(60.5) | 24(63.2) | 14(36.8) | 10(26.3) | 28(73.7) | 15(39.5) | 23(60.5) | 22(57.9) | 16(42.1) |
| χ2值 | 4.528 | 5.144 | 0.519 | 0.002 | 5.481 | ||||||
| P值 | 0.033 | 0.023 | 0.333 | 0.967 | 0.030 | ||||||
注:SLN为前哨淋巴结;HE为苏木精-伊红;IHC为免疫组织化学;HER2为人表皮生长因子受体2
行ALND后检测示53.2%(42/79)患者NSLN转移,1~2枚SLN阳性患者中NSLN转移率为50.0%(32/64),≥3枚SLN阳性患者中NSLN转移率为66.7%(10/15)。NSLN转移组脉管浸润患者比例高于非NSLN转移组(P<0.05),两组间其他临床病理特征差异均无统计学意义(P>0.05)(表2)。
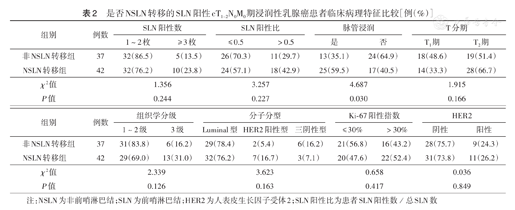
是否NSLN转移的SLN阳性cT1~2N0M0期浸润性乳腺癌患者临床病理特征比较[例(%)]
是否NSLN转移的SLN阳性cT1~2N0M0期浸润性乳腺癌患者临床病理特征比较[例(%)]
| 组别 | 例数 | SLN阳性数 | SLN阳性比 | 脉管浸润 | T分期 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 1~2枚 | ≥3枚 | ≤ 0.5 | >0.5 | 是 | 否 | T1期 | T2期 | ||
| 非NSLN转移组 | 37 | 32(86.5) | 5(13.5) | 26(70.3) | 11(29.7) | 13(35.1) | 24(64.9) | 18(48.6) | 19(51.4) |
| NSLN转移组 | 42 | 32(76.2) | 10(23.8) | 24(57.1) | 18(42.9) | 25(59.5) | 17(40.5) | 14(33.3) | 28(66.7) |
| χ2值 | 1.356 | 3.257 | 4.687 | 1.915 | |||||
| P值 | 0.244 | 0.227 | 0.030 | 0.166 | |||||
| 组别 | 例数 | 组织学分级 | 分子分型 | Ki-67阳性指数 | HER2 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1~2级 | 3级 | Luminal型 | HER2阳性型 | 三阴性型 | ≤ 30% | >30% | 阴性 | 阳性 | ||
| 非NSLN转移组 | 37 | 31(83.8) | 6(16.2) | 29(78.4) | 2(5.4) | 6(16.2) | 21(56.8) | 16(43.2) | 28(75.7) | 9(24.3) |
| NSLN转移组 | 42 | 29(69.0) | 13(31.0) | 32(76.2) | 7(16.7) | 3(7.1) | 20(47.6) | 22(52.4) | 31(73.8) | 11(26.2) |
| χ2值 | 2.339 | 3.623 | 0.658 | 0.036 | ||||||
| P值 | 0.126 | 0.163 | 0.417 | 0.849 | ||||||
注:NSLN为非前哨淋巴结;SLN为前哨淋巴结;HER2为人表皮生长因子受体2;SLN阳性比为患者SLN阳性数/总SLN数
多因素logistic回归分析显示,脉管浸润是NSLN转移的独立危险因素(P<0.05)(表3)。
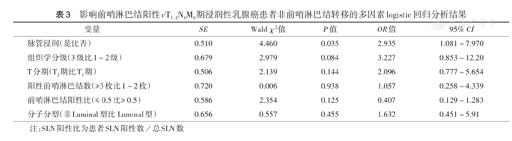
影响前哨淋巴结阳性cT1~2N0M0期浸润性乳腺癌患者非前哨淋巴结转移的多因素logistic回归分析结果
影响前哨淋巴结阳性cT1~2N0M0期浸润性乳腺癌患者非前哨淋巴结转移的多因素logistic回归分析结果
| 变量 | SE | Wald χ2值 | P值 | OR值 | 95% CI |
|---|---|---|---|---|---|
| 脉管浸润(是比否) | 0.510 | 4.460 | 0.035 | 2.935 | 1.081~7.970 |
| 组织学分级(3级比1~2级) | 0.679 | 2.979 | 0.084 | 3.227 | 0.853~12.20 |
| T分期(T2期比T1期) | 0.506 | 2.139 | 0.144 | 2.096 | 0.777~5.654 |
| 阳性前哨淋巴结数(≥3枚比1~2枚) | 0.720 | 0.006 | 0.938 | 1.057 | 0.258~4.339 |
| 前哨淋巴结阳性比(≤ 0.5比> 0.5) | 0.586 | 2.354 | 0.125 | 0.407 | 0.129~1.283 |
| 分子分型(非Luminal型比Luminal型) | 0.656 | 0.557 | 0.455 | 1.632 | 0.451~5.91 |
注:SLN阳性比为患者SLN阳性数/总SLN数
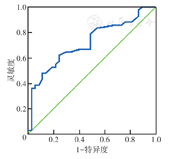
ROC曲线分析显示,MSKCC模型预测NSLN转移的曲线下面积(AUC)为0.718(95% CI 0.606~0.831)(图1)。

ACOSOG Z0011及IBCSG 23-01研究结果究表明接受全乳切除术的患者需行ALND,而大多数1~2枚SLN转移且准备接受保乳术及全乳放疗患者可不行ALND[2,3,4]。但上述研究绝大多数入组患者肿瘤负荷小且具有较好的生物学特征,保乳率高,NSLN转移率分别为27.3%和13%[4]。AMAROS研究显示对于SLN宏转移(不限定阳性SLN数)cT1~2N0M0患者,可尝试腋-锁联合放疗替代ALND[5],但该研究入组患者与上述研究相似,NSLN转移率为33%。
由于不同地区医疗环境差异和资源分配不均等,导致临床中保乳术、SLN活组织检查的开展及其术后腋窝淋巴结处理方式不一致。我国2020年一项多中心回顾性研究显示,在11 942例早期乳腺癌中30.2%行保乳手术,63.6%行全乳切除术,仅43.5%接受SLN活组织检查,而1~2枚SLN阳性患者中,83.0%接受进一步的ALND[12]。在我国保乳率较低的现状下,全乳切除术后SLN阳性患者的腋窝淋巴结处理方式存在争议。越来越多的研究表明肿瘤在各阶段均可出现转移,甚至在原位癌阶段即可能出现超早期播散,并影响后期转移的发生[13]。部分早期乳腺癌患者在经过积极治疗后仍出现复发转移。肿瘤原位淋巴管及血管新生、脉管浸润等是肿瘤转移的先决条件[14],与淋巴结转移相关[15]。但在病理检测中,受取材、制片、染色及判读方法不同的影响,文献报道的脉管浸润阳性率不同,为21.2%~47%[6],在一定程度上影响了脉管浸润对NSLN转移的预测价值。如基于HE染色图像判读脉管浸润时存在显著的观察者差异[16],基于IHC检测图像可进一步探索血管和(或)脉管浸润,如瘤周或瘤中心等不同类型脉管浸润与预后的相关性有所不同[17,18,19]。
目前,NSLN转移预测模型的构建基于不同人群、不一致的危险因素,在临床验证中预测准确性存在一定差异[8]。MSKCC模型预测NSLN转移的AUC波动在0.58~0.84,在本研究中为0.718,提示其预测性能较好。MSKCC建模人群为浸润性导管癌、小叶癌,脉管浸润率为40.5%。而本组患者脉管浸润发生率为48.1%,与MSKCC建模人群相近,本组86.8%脉管浸润经IHC确诊。其他模型纳入的危险因素有SLN转移灶直径、SLN阳性比、阳性或阴性SLN数及原发肿瘤信息,如T分期、组织学分级、ER状态等[8]。本研究中SLN相关参数未显示出对NSLN转移的预测意义,可能与样本量较少有关,或存在SLN假阴性及假阳性的可能。研究显示联合应用荧光染料等双示踪法较单示踪法SLN活组织检查成功率高[20],而本研究62.2%以单示踪为主,并且示踪剂多样。另外,本研究中单因素分析时脉管浸润组Ki-67阳性指数>30%及HER2阳性患者比例均较非脉管浸润组高,但多因素分析中上述因素未见独立预测意义,可能与样本量较少有关。
综上,实际临床工作中,SLN阳性cT1~2N0M0期浸润性乳腺癌腋窝淋巴结的处理需结合患者临床病理特征及后续全身治疗计划来制订个体化策略。脉管浸润是SLN阳性cT1~2N0M0期浸润性乳腺癌NSLN转移的危险因素。临床在借鉴相关研究成果时,一方面需筛选出中低危SLN阳性患者免除ALND,避免过度治疗带来的并发症,并减轻患者的经济负担,另一方面需甄别NSLN转移相关高危因素,指导腋窝局部治疗策略,避免治疗不足。
所有作者均声明不存在利益冲突



























