
探讨注射用核糖核酸Ⅱ(简称:核糖核酸Ⅱ)与化疗药物环磷酰胺(CTX)联合对肉瘤细胞S180荷瘤小鼠肿瘤抑制作用及对小鼠生存的影响。
分别建立肉瘤细胞S180实体移植瘤小鼠模型和腹腔积液瘤小鼠模型。将CTX(25 mg/kg,1次/2 d)单独或联合低剂量(25 mg/kg,1次/d)、中剂量(50 mg/kg,1次/d)核糖核酸Ⅱ腹腔注射实体移植瘤小鼠10 d,将CTX(25 mg/kg,1次/2 d)单独、中剂量(50 mg/kg,1次/d)或高剂量(100 mg/kg,1次/d)核糖核酸Ⅱ单独或联合CTX(25 mg/kg,1次/2 d)腹腔注射腹腔积液瘤小鼠至全部死亡,两模型均设未经药物处理的模型组,各组小鼠均为8只。对于实体移植瘤小鼠,给药后称量体质量,测量活体肿瘤体积,处死小鼠后取肿瘤组织并称量其质量,计算抑瘤率。对于腹腔积液瘤小鼠,给药后称量体质量,计算体质量增长率,绘制各组生存曲线,计算生命延长率。
(1)实体移植瘤小鼠:给药后各给药组小鼠体质量均低于模型组。给药期间,模型组活体肿瘤体积均远超各给药组;给药第8天起,CTX组活体肿瘤体积开始大于两个联合给药组。给药结束处死小鼠后称量显示,各给药组肿瘤质量均低于模型组(均P<0.01),CTX+核糖核酸Ⅱ低剂量组和CTX+核糖核酸Ⅱ中剂量组的肿瘤质量均低于CTX组(均P<0.05),两组抑瘤率均高于CTX组(83.6%、77.2%比58.5%)。(2)腹腔积液瘤小鼠:给药12 d后,CTX组小鼠体质量增长率迅速增加,达最高,两个联合给药组小鼠体质量增长率较其他各组均低。核糖核酸Ⅱ高剂量组与CTX组小鼠生命延长率分别为48.2%、53.2%,对生命延长作用相当;核糖核酸Ⅱ中剂量组小鼠生命延长率仅20.9%;CTX+核糖核酸Ⅱ中剂量组和CTX+核糖核酸Ⅱ高剂量组小鼠生命延长率分别达到94.2%、105.0%。
核糖核酸Ⅱ联合CTX可明显延长肉瘤细胞S180荷瘤小鼠生存时间,提高抑瘤率,改善小鼠生命质量,二者具有协同增效作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
注射用核糖核酸Ⅱ(简称:核糖核酸Ⅱ)是一种核酸类药物,主要成分为从健康的牛胰脏组织中提取后冷冻干燥的小分子RNA,被广泛用于治疗胰腺癌、肝癌、胃癌、软组织肉瘤和乳腺癌等,还用于提高机体的免疫功能[1]。环磷酰胺(CTX)是临床常用的一线肿瘤化疗药物,具有很强的细胞毒作用,但其对肿瘤细胞和正常细胞的杀伤选择性不高,易引起机体免疫抑制、消化道反应及骨髓抑制等不良反应,严重影响其治疗效果及患者的生命质量。本课题组前期的实验显示,单用核糖核酸Ⅱ对移植肉瘤模型小鼠的抑瘤作用并不明显,因此本研究将核糖核酸Ⅱ与CTX联合用于我们建立的肉瘤细胞S180腹腔积液瘤小鼠模型和实体移植瘤模型,观察荷瘤小鼠的肿瘤抑制效果及生存情况,为核糖核酸Ⅱ的临床合理应用提供参考。
雄性ICR小鼠:无特定病原体(SPF)级,体质量16~18 g,购自北京大学医学部实验动物科学部,实验动物许可证号为SCXK(京)2016-0010。小鼠饲养在SPF级屏障环境中,12 h昼夜交替,温度(25±1)℃,湿度(55±5)%,自由进食和饮水。所有动物实验均遵循北京协和医学院动物伦理委员会的相关章程。小鼠肉瘤细胞株S180购自中国医学科学院基础医学研究所细胞资源中心。
核糖核酸Ⅱ由吉林敖东药业集团公司提供。注射用CTX(批号:7H183A)购自德国Baxter Oncology GmbH公司。RPMI 1640培养液、磷酸盐缓冲液(PBS)、100×青霉素-链霉素混合物购自北京索莱宝生物科技有限公司。胎牛血清购自北京元亨圣马生物科技公司。CO2细胞培养箱购自日本Panasonic公司,二级生物安全柜购自苏州安泰空气技术有限公司,台式低速离心机购自安徽中科中佳公司,电子分析天平购自瑞士METTLER Toledo公司,制冰机购自日本Sanyo公司,IX71型荧光倒置显微镜购自日本Olympus公司,压力蒸汽灭菌器购自上海博迅实业有限公司。
雄性ICR小鼠饲养3~4 d以适应环境,采用皮下注射的方式建立S180实体移植瘤小鼠模型,采用腹腔注射的方式建立S180腹腔积液瘤小鼠模型;另设未经任何处理的小鼠为正常组(空白对照)。复苏冻存的S180细胞株,体外培养,取对数生长期细胞,用无菌0.9% NaCl溶液清洗3次,调整细胞密度为2.5×106/ml,腹腔注射小鼠,0.2 ml/只。连续传代2~3代,无菌吸取小鼠腹腔积液,用0.9% NaCl溶液洗涤1次,离心弃上清,加入0.9% NaCl溶液重悬细胞,用于构建模型。(1)构建实体移植瘤模型时,调整细胞密度至5.0×106/ml,颠倒混匀,用75%医用乙醇擦拭小鼠右侧前肢背部,除正常组外,其余各组无菌接种0.2 ml细胞悬液。接种部位可观察到明显的皮丘,后可逐渐发展为实体肉瘤。(2)构建腹腔积液瘤模型时,调整细胞密度至2.5×106/ml,无菌吸取0.2 ml细胞悬液,除正常组外,其余各组经由小鼠左下腹部接种于腹腔,2~3 d内手触小鼠腹部有明显凸起即为模型成功。
两模型小鼠在接种24 h后,均按体质量分层,采用随机数字表法将实体移植瘤小鼠分为模型组(阴性对照)、CTX组(阳性对照)、CTX+核糖核酸Ⅱ低剂量组、CTX+核糖核酸Ⅱ中剂量组,每组8只;将腹腔积液瘤小鼠分为模型组(阴性对照)、CTX组(阳性对照)、核糖核酸Ⅱ中剂量组、核糖核酸Ⅱ高剂量组、CTX+核糖核酸Ⅱ中剂量组、CTX+核糖核酸Ⅱ高剂量组,每组8只。
参考抗肿瘤药物药效学实验方法及指导原则和文献[2,3]的给药方案和给药途径,于接种肿瘤细胞24 h后即开始腹腔注射核糖核酸Ⅱ,接种肿瘤细胞48 h后腹腔注射CTX,两种模型各组均按照总药量0.1 ml/10 g小鼠体质量给药。(1)实体移植瘤小鼠:CTX剂量为25 mg/kg,1次/2 d;核糖核酸Ⅱ低剂量、中剂量分别为25、50 mg/kg,1次/d;正常组和模型组均腹腔注射等体积0.9% NaCl溶液,1次/d;连续给药10 d,观察小鼠生存状态。(2)腹腔积液瘤小鼠:CTX剂量为25 mg/kg,1次/2 d;核糖核酸Ⅱ中剂量、高剂量分别为50、100 mg/kg,1次/d;正常组和模型组均腹腔注射等体积0.9% NaCl溶液,1次/d;观察小鼠进食、饮水和活动状态等情况。
于给药当天开始称量小鼠体质量,1次/2 d。给药第5天起,每天用电子游标卡尺测量肿瘤的长、短径,计算活体肿瘤体积,绘制活体肿瘤体积增长曲线。末次给药24 h后称量小鼠体质量,脱颈椎处死小鼠,小心剥离肿瘤,称量肿瘤质量,计算抑瘤率;各组剥离的肿瘤按体积大小顺序摆放,拍照。
肿瘤体积(mm3)=ab2/2(a:长径;b:短径)
抑瘤率(%)=(模型组平均瘤质量-给药组平均瘤质量)/模型组平均瘤质量×100%
开始给药当天起称量小鼠体质量,1次/2 d,至该组剩余小鼠少于6只时停止称量。计算小鼠体质量增长率。给药至小鼠全部死亡,记录各组小鼠死亡日期,待实验结束后计算生命延长率并绘制生存曲线。治疗效果的判断依据抗肿瘤药物药效学实验方法及指导原则:生命延长率<75%为无效;生命延长率≥75%,并与模型组比较,差异有统计学意义(P<0.05),且模型组20%动物生存时间未超过4周时为有效。
体质量增长率(%)=(测量当日体质量-上一测量日体质量)/上一测量日体质量×100%
生命延长率(%)=(给药组平均生存天数-模型组平均生存天数)/模型组平均生存天数×100%
采用SPSS 21.0软件进行统计学分析。计量资料符合正态分布,以 ±s表示,多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。采用GraphPad Prism 5.0软件作图。
±s表示,多组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。采用GraphPad Prism 5.0软件作图。
模型组小鼠在接种肿瘤细胞后体质量迅速增加,并在给药8 d后超过正常组;各给药组小鼠体质量一直低于模型组(图1)。
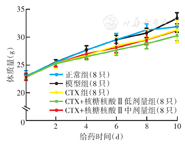

注:CTX为环磷酰胺;核糖核酸Ⅱ为注射用核糖核酸Ⅱ的简称;正常组为未接种肿瘤细胞的小鼠;模型组为接种肿瘤细胞但未经药物干预的小鼠;各给药组相应地于接种肿瘤细胞24 h后开始腹腔注射低剂量(25 mg/kg,1次/d)或中剂量(50 mg/kg,1次/d)核糖核酸Ⅱ,于接种肿瘤细胞48 h后开始腹腔注射CTX(25 mg/kg,1次/2 d),共给药10 d;正常组和模型组均腹腔注射等体积0.9% NaCl溶液
活体肿瘤体积增长曲线显示,模型组肿瘤体积一直远超各给药组,表明短期内CTX无论是单用还是与核糖核酸Ⅱ联用均能够在一定程度上控制肿瘤的发展;给药第8天起,CTX组肿瘤体积开始明显大于两个联合给药组(图2),表明在肿瘤生长的后期,核糖核酸Ⅱ能够使CTX更好地抑制肿瘤增长。处死小鼠后称量剖离的肿瘤质量,各给药组肿瘤质量均低于模型组(均P<0.01);CTX+核糖核酸Ⅱ低剂量组和CTX+核糖核酸Ⅱ中剂量组的肿瘤质量均低于CTX组(图3),差异均有统计学意义(均P<0.05),两组抑瘤率均高于CTX组(表1),进一步表明核糖核酸Ⅱ与CTX联用能够更好地发挥抑瘤作用。
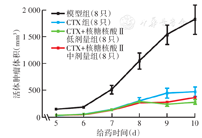

注:CTX为环磷酰胺;核糖核酸Ⅱ为注射用核糖核酸Ⅱ的简称;模型组为接种肿瘤细胞但未经药物干预的小鼠;各给药组相应地于接种肿瘤细胞24 h后开始腹腔注射低剂量(25 mg/kg,1次/d)或中剂量(50 mg/kg,1次/d)核糖核酸Ⅱ,于接种肿瘤细胞48 h后开始腹腔注射CTX(25 mg/kg,1次/2 d),共给药10 d;模型组腹腔注射等体积0.9% NaCl溶液


注:CTX为环磷酰胺;核糖核酸Ⅱ为注射用核糖核酸Ⅱ的简称;1为模型组;2为CTX组;3为CTX+核糖核酸Ⅱ低剂量组;4为CTX+核糖核酸Ⅱ中剂量组;模型组为接种肿瘤但未经药物干预的小鼠;各给药组相应地于接种肿瘤24 h后开始腹腔注射低剂量(25 mg/kg,1次/d)或中剂量(50 mg/kg,1次/d)核糖核酸Ⅱ,于接种肿瘤48 h后开始腹腔注射CTX(25 mg/kg,1次/2 d),共给药10 d;模型组腹腔注射等体积0.9% NaCl溶液
CTX是否联合核糖核酸Ⅱ给药的肉瘤细胞S180实体移植瘤小鼠给药10 d后剥离的肿瘤质量及抑瘤率比较
CTX是否联合核糖核酸Ⅱ给药的肉瘤细胞S180实体移植瘤小鼠给药10 d后剥离的肿瘤质量及抑瘤率比较
| 组别 | 只数 | 肿瘤质量(g, ±s) ±s) | F值 | P值 | 抑瘤率(%) |
|---|---|---|---|---|---|
| 模型组 | 8 | 1.87±0.38 | 39.49 | <0.001 | - |
| CTX组 | 8 | 0.78±0.39a | 58.5 | ||
| CTX+核糖核酸Ⅱ低剂量组 | 8 | 0.31±0.20ab | 83.6 | ||
| CTX+核糖核酸Ⅱ高剂量组 | 8 | 0.43±0.17ac | 77.2 |
注:CTX为环磷酰胺;核糖核酸Ⅱ为注射用核糖核酸Ⅱ的简称;模型组为接种肿瘤细胞但未经药物干预的小鼠;各给药组相应地于接种肿瘤细胞24 h后开始腹腔注射低剂量(25 mg/kg,1次/d)或中剂量(50 mg/kg,1次/d)核糖核酸Ⅱ,于接种肿瘤细胞48 h后开始腹腔注射CTX(25 mg/kg,1次/2 d);模型组腹腔注射等体积0.9% NaCl溶液;-为无此项;与模型组比较,aP<0.001;与CTX组比较,bP<0.001,cP<0.05
给药的前10 d中,随着给药时间的延长,模型组小鼠体质量均高于各给药组,但生存状态尚可;CTX组小鼠虽体质量增长率低于模型组,肿瘤的生长得到一定的控制,但生存状态不佳,表现为活动减少、皮毛发暗、精神萎靡;核糖核酸Ⅱ单用的两组及联合给药的两组小鼠生存状态良好。给药12 d后,CTX组小鼠体质量增长率迅速增加,失去控制,超过模型组,其余各组体质量增长率均匀增加,中、高剂量核糖核酸Ⅱ单用及联合CTX均能够控制小鼠肿瘤的增长速度,其中联合给药两组小鼠体质量增长率较其他各给药组均低(图4),可见联合用药对肿瘤的控制作用最好。


注:CTX为环磷酰胺;核糖核酸Ⅱ为注射用核糖核酸Ⅱ的简称;1为正常组;2为模型组;3为CTX组;4为核糖核酸Ⅱ中剂量组;5为核糖核酸Ⅱ高剂量组;6为CTX+核糖核酸Ⅱ中剂量组;7为CTX+核糖核酸Ⅱ高剂量组;正常组为未接种肿瘤小鼠;模型组为接种肿瘤细胞但未经药物干预小鼠;各给药组相应地于接种肿瘤细胞24 h后开始腹腔注射中剂量(50 mg/kg,1次/d)或高剂量(100 mg/kg,1次/d)核糖核酸Ⅱ,于接种肿瘤细胞48 h后开始腹腔注射CTX(25 mg/kg,1次/2 d),直至小鼠全部死亡;正常组和模型组均腹腔注射等体积0.9% NaCl溶液
给药12 d后,模型组小鼠首先出现死亡,随后核糖核酸Ⅱ中剂量组小鼠开始死亡,模型组在给药第16天全部死亡(图5)。CTX组与核糖核酸Ⅱ高剂量组小鼠生存时间相近,但CTX组小鼠生命质量较其他给药组差,CTX组给药7 d后小鼠进食困难,体温降低,活动频率减少,精神萎靡。联合给药的两组小鼠均较活泼,生命质量较高,两组小鼠均最后死亡(图5)。与模型组相比,CTX组和核糖核酸Ⅱ高剂量组小鼠带瘤生存时间均延长(均P<0.01);联合给药的两组小鼠生存时间较CTX组均延长(均P<0.01);与模型组相比,联合给药的两组小鼠生命延长率均>75%(表2)。表明CTX与核糖核酸Ⅱ联用能够明显延长腹腔积液瘤小鼠生存时间,二者联用达到协同增效的效果。
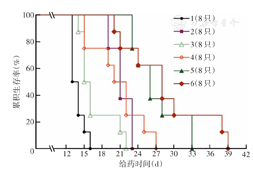

注:CTX为环磷酰胺;核糖核酸Ⅱ为注射用核糖核酸Ⅱ的简称;1为模型组;2为CTX组;3为核糖核酸Ⅱ中剂量组;4为核糖核酸Ⅱ高剂量组;5为CTX+核糖核酸Ⅱ中剂量组;6为CTX+核糖核酸Ⅱ高剂量组;模型组为接种肿瘤细胞但未经药物干预的小鼠;各给药组相应地于接种肿瘤细胞24 h后开始腹腔注射中剂量(50 mg/kg,1次/d)或高剂量(100 mg/kg,1次/d)核糖核酸Ⅱ,于接种肿瘤细胞48 h后开始腹腔注射CTX(25 mg/kg,1次/2 d),直至小鼠全部死亡;模型组腹腔注射等体积0.9% NaCl溶液

核糖核酸Ⅱ是否联合CTX给药的肉瘤细胞S180腹腔积液瘤小鼠生存时间及生命延长率比较
核糖核酸Ⅱ是否联合CTX给药的肉瘤细胞S180腹腔积液瘤小鼠生存时间及生命延长率比较
| 组别 | 只数 | 生存时间(d, ±s) ±s) | F值 | P值 | 生命延长率(%) |
|---|---|---|---|---|---|
| 模型组 | 8 | 13.9±1.1 | 15.65 | <0.001 | - |
| CTX组 | 8 | 21.3±1.7a | 53.2 | ||
| 核糖核酸Ⅱ中剂量组 | 8 | 16.8±3.0 | 20.9 | ||
| 核糖核酸Ⅱ高剂量组 | 8 | 20.6±4.3b | 48.2 | ||
| CTX+核糖核酸Ⅱ中剂量组 | 8 | 27.0±4.1ac | 94.2 | ||
| CTX+核糖核酸Ⅱ高剂量组 | 8 | 28.5±7.1ad | 105.0 |
注:CTX为环磷酰胺;核糖核酸Ⅱ为注射用核糖核酸Ⅱ的简称;模型组为接种肿瘤细胞但未经药物干预的小鼠;各给药组相应地于接种肿瘤细胞24 h后开始腹腔注射中剂量(50 mg/kg,1次/d)或高剂量(100 mg/kg,1次/d)核糖核酸Ⅱ,于接种肿瘤细胞48 h后开始腹腔注射CTX(25 mg/kg,1次/2 d),直至小鼠全部死亡;模型组腹腔注射等体积0.9% NaCl溶液;-为无此项;与模型组相比,aP<0.001,bP<0.01;与CTX组相比,cP<0.01,dP<0.001
恶性肿瘤发病率逐年增加,死亡率极高,严重威胁人们的身心健康[4]。目前,肿瘤的临床治疗方法有手术、放疗、化疗、免疫治疗、癌症疫苗接种等[5]。由于肿瘤大小、生长位置的特殊性等,很多肿瘤患者没有手术的机会,靶向药物和免疫治疗虽然取得了非常好的效果,但由于研究有限且价格昂贵,仅有少部分患者有应用机会,因此大部分肿瘤患者仍然依靠传统的化疗药物进行抗肿瘤治疗。由于化疗药物大多本身具有很强的细胞毒性,在抗肿瘤的同时,会产生很多的毒性作用和不良反应,因此临床化疗过程中几乎均采用联合给药的方式,协同用药往往能够达到"1+1>2"的效果[6,7,8,9]。
CTX是一种氮芥类化疗药物,在体外无抗癌活性,在体内经由肝脏代谢,被肝细胞色素P450氧化生成醛磷酰胺,在肿瘤细胞内进一步分解成一种DNA烷化剂,即磷酰胺氮芥,从而抑制细胞的增殖、诱导细胞死亡[10]。CTX在临床上主要用于治疗白血病、恶性淋巴瘤、转移性和非转移性恶性实体瘤、进行性自身免疫性疾病以及用于器官移植时的免疫抑制[11,12],因其广泛的抗瘤谱,CTX在临床上被大量使用。但CTX在抑制肿瘤细胞生长的同时,也影响人体正常细胞的生长和发育,会产生很多的不良反应,如遗传毒性及肝、肠黏膜和免疫系统损伤等[12,13,14,15,16]。据报道,核糖核酸Ⅱ单用可显著降低晚期肝癌患者血清血管内皮生长因子(VEGF)水平,抑制肿瘤的转移[17];还能提高晚期胰腺癌患者外周T细胞和自然杀伤细胞数量,减小肿瘤体积[18]。核糖核酸Ⅱ联合化疗药物可明显改善中晚期肝癌、肺癌、胃癌、卵巢癌、消化道肿瘤等患者的生命质量[19,20,21,22,23],提高外周血CD3、CD4、CD56阳性细胞水平和CD4/CD8比值,进而提高患者自身免疫力,增强化疗药物的抑瘤效果,并减轻化疗药物的不良反应[24,25]。临床上核糖核酸Ⅱ单独或与其他化疗药物联合用于多种肿瘤时,可改善患者生命质量,减轻由于放化疗导致的不良反应及免疫细胞数量下降[26],减轻顺铂造成的外周血白细胞数量减少,提升脾脏T细胞的增殖能力,与顺铂协同抑制小鼠S180腹腔积液瘤的增殖[27],并通过抑制VEGF而抑制肿瘤血管新生[28]。本研究对S180实体移植瘤小鼠模型研究发现,核糖核酸Ⅱ联合CTX后,能在单用CTX抗肉瘤作用不佳的剂量下,大幅提升CTX的抑瘤效果,发挥协同增效的作用。此外,该结果提示临床上在使用CTX治疗肿瘤时,可通过联用核糖核酸Ⅱ减少CTX的用量,或可直接减轻由于大剂量CTX的应用给患者带来的不良反应。
抗肿瘤治疗的最终目的是延长患者的生存时间、提高患者的生命质量,因此在抗肿瘤药物的药效评价中,生命延长率的提高和抑瘤率的提高同等重要。本实验研究了核糖核酸Ⅱ单用以及与CTX联用后对S180腹腔积液瘤小鼠生命延长的作用,结果发现核糖核酸Ⅱ单用时与CTX单用均能够延长小鼠生存时间,但都未达到指南要求的标准(生命延长率达75%以上);二者联用后,效果显著提升,CTX联合中、高剂量核糖核酸Ⅱ的小鼠生命延长率分别达到了94.2%和105.0%。同时我们还注意到,CTX与核糖核酸Ⅱ联用后,小鼠的一般状态明显改善。
本研究的不足在于未对核糖核酸Ⅱ与CTX联用后的安全性进行评价。化疗药物临床使用过程中所产生的不良反应也是一大治疗难题。核糖核酸Ⅱ与CTX联用在增强抗肿瘤效果的同时是否也能降低CTX的不良反应(肝损伤、免疫系统损伤等)还有待进一步研究。另一方面,核糖核酸Ⅱ联合CTX发挥协同增效作用的具体机制尚未明确,后续应开展更深入的研究对联合用药后肿瘤相关细胞通路的变化进行探索,为核糖核酸Ⅱ的临床应用提供更多理论基础。
综上,核糖核酸Ⅱ联合CTX可显著延长肉瘤细胞S180荷瘤小鼠生存时间,提高抑瘤率,改善生命质量,二者发挥协同增效作用,这对核糖核酸Ⅱ在临床抗肿瘤治疗中的应用具有指导意义。
所有作者均声明不存在利益冲突



























