
提高对乳腺产生基质的化生性癌(MPC)的认识。
回顾性分析扬州大学附属医院2例MPC患者的临床病理资料及免疫表型特征等,并复习相关文献。
2例患者年龄分别为53岁和50岁,肿瘤长径分别为2.5 cm和1.8 cm。2例MPC浸润性癌成分(浸润性导管癌Ⅲ级形态)直接转化为黏液软骨样基质,无介于中间的梭形细胞肉瘤样化生区过渡,基质中的细胞与浸润性癌细胞形态较一致并见有移行。例1呈周边型分布模式,例2呈弥漫型分布模式。2例肿瘤细胞均呈三阴性免疫表型(雌激素受体、孕激素受体、人表皮生长因子2均阴性)、基底样标志CK5/6、CK14及表皮生长因子受体(EGFR)阳性,Vimentin和S-100弥漫阳性。
MPC是一种罕见的乳腺化生性癌亚型,具有独特的组织形态学和免疫表型特征,治疗一般是手术联合放化疗,也可行新辅助化疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乳腺产生基质的化生性癌(MPC)由Wargotz和Norris[1]于1989年首次描述并命名,其组织形态学特征是浸润性癌直接转变为黏液软骨或骨样基质,中间缺乏梭形细胞区域或破骨样细胞区域。MPC罕见其发生率约占所有原发性乳腺癌的1%[2],目前国内外文献多为个案或小宗报道。我们报道2例MPC,探讨其临床病理特征、免疫表型、诊断及鉴别诊断,并复习相关文献,以期进一步提高病理医师对MPC的认识及诊断水平。
回顾性分析扬州大学附属医院病理科2020年1月至2021年7月明确诊断的2例MPC患者。例1,女性,53岁,乳腺彩色超声示:右侧乳头后方软组织肿块伴簇状分布多形性钙化,乳腺影像报告和数据系统(BI-RADS)4B类。术中见肿块大小约3.0 cm×2.5 cm×2.0 cm,质硬,边界不清,无包膜,为囊实性,剖示中央内陷。例2,女性,50岁,乳腺彩色超声示:左乳低回声结节,BI-RADS 3类。术中见肿块大小约1.8 cm×1.5 cm×1.5 cm,质硬,边界不清,无包膜。2例均行单纯乳房切除术+腋窝前哨淋巴结活组织检查。所有组织切片均经2名高年资病理医师复核确认。
手术标本经10%中性甲醛溶液固定,常规取材,脱水处理,石蜡包埋,4 μm厚连续切片,行HE染色及免疫组织化学检查。免疫组织化学染色采用SP法,DAB显色。所用一抗包括CKpan、雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)、Ki-67、p63、34βE12、Calponin、CK5/6、CK14、表皮生长因子受体(EGFR)、E-cadherin、Vimentin及S-100均购自北京中杉金桥公司,常规设阳性和阴性对照。
例1灰白灰黄色结节1枚,大小2.5 cm×2.0 cm×2.0 cm,无包膜,边界尚清,切面实性,质中,部分区域有胶样感。例2灰黄结节1枚,大小1.8 cm×1.5 cm×1.5 cm,无包膜,边界尚清,切面实性,质中,部分区域见灰黄坏死。
2例肿瘤均呈结节状、膨胀性生长,边界呈推挤性,部分边界呈浸润性生长(图1A)。2例浸润性癌成分直接转化为黏液软骨样基质,无介于中间的梭形细胞肉瘤样化生成分过渡,基质中的细胞与浸润性癌细胞形态较一致并见有移行。例1呈周边型分布模式,结节周边肿瘤细胞丰富,由外向内肿瘤细胞逐渐减少,黏液软骨样基质逐渐增多,中央伴有大片凋亡及坏死区(图1B)。肿瘤细胞呈巢团状、梁索状、簇状排列,可见单个分布,细胞核大而不规则,染色质粗糙,可见核仁,核分裂象易见(浸润性导管癌Ⅲ级形态)(图1C)。例2呈弥漫型分布模式,浸润性癌成分丰富,也呈浸润性导管癌Ⅲ级形态,黏液软骨样基质散在多灶分布于浸润性癌成分中,由外向内肿瘤细胞密度未见明显改变(图1D)。
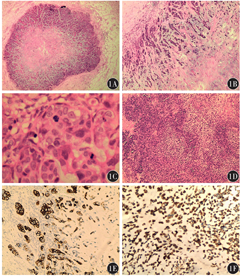

乳腺化生性癌(MBC)包括了一组罕见的、具有较强异质性的癌,其特征是肿瘤性上皮向鳞状细胞和(或)间叶成分分化。2019年第5版乳腺肿瘤世界卫生组织(WHO)分类中提到伴间叶分化的癌如上皮成分突然转化为间叶成分,不存在过渡性梭形细胞肉瘤样成分时,命名为"产生基质的癌"[3]。
MPC呈多结节状、膨胀性生长,边界多较清楚,呈推挤性边缘,部分边界呈浸润性,多伴有坏死,部分可有黏液感。肿瘤由排列成巢片状、梁索状和管状结构的恶性上皮细胞组成,混合有黏液软骨样或骨样基质,有时还有透明软骨病灶甚至骨成分[4]。依据肿瘤细胞和基质的分布,MPC分为周边型分布模式和弥漫型分布模式[1]。本组例1为周边型分布模式,例2为弥漫型分布模式。Downs-Kelly等[4]将癌成分分为低、中和高级,基质成分分为低级与高级。本组2例均为高级癌成分(浸润性导管癌Ⅲ级形态)+低级基质成分。基质成分可占肿瘤成分的10%~80%[5]。本组2例基质成分分别约占60%和10%,与文献报道相符。
本组2例呈三阴性免疫表型,Vimentin及S-100弥漫阳性,基底样标志CK5/6、CK14及EGFR部分或者局灶阳性,Ki-67阳性指数分别约为30%和70%,与国内其他研究结果较一致[5,6,7]。黏液软骨样基质成分形态上类似骺板区增生期软骨基质,HE染色呈嗜碱性,阿辛蓝染色呈蓝色[5]。MPC的组织起源和发病机制至今仍未明确,主要包括上皮起源、多潜能干细胞的肿瘤转化、微腺病的进展和上皮间质转化[8,9,10,11]。
(1)中央坏死型癌:和周边型MPC都具有中央无细胞区,区别在于其缺乏嗜碱性黏液软骨样基质,为嗜酸性玻璃样变的胶原和(或)肿瘤性坏死,并且癌区和无细胞区之间的过渡是突然的,缺乏移行[12]。(2)黏液癌:MPC的基质成分较多时,易误诊为黏液癌,特别是穿刺活组织检查标本,此时可以加做免疫组织化学(ER、PR、HER2、CK5/6、CK14及S-100)和阿辛蓝染色(黏液软骨样基质呈蓝色),必要时完整切除肿块。(3)细胞外黏蛋白产生的浸润性小叶癌:其黏液成分可能与MPC基质相混淆,但其显示浸润性小叶癌形态,ER、PR和HER2表达,缺乏E-cadherin表达[13]。(4)乳腺多形性腺瘤:多形性腺瘤也有黏液软骨样基质,但是多形性腺瘤细胞异型性小,形态温和,缺乏浸润性癌成分[14]。
MPC几乎全部为三阴性乳腺癌,对内分泌治疗及靶向HER2治疗反应有限,其治疗手段一般是手术联合放化疗。近年来,新辅助化疗也应用于MBC的治疗,与其他类型MBC相比,MPC获得了更高的病理完全缓解率[15]。并且,新辅助化疗后的病理学完全缓解已被证明是生存的独立预测因素[16]。肿瘤直径>5 cm、淋巴结转移和高级别基质与较差的预后相关[9],低级别基质所占比例越多的肿瘤有更好的预后[4]。本组2例肿瘤长径均<5 cm,淋巴结均未转移,基质(均为低级别)约占60%和10%,随访14个月和6个月,肿瘤均无复发、无转移。但是,本组MPC病例少,随着对该疾病的进一步认识,相信对其治疗与预后的研究也将更加深入与完善。
综上所述,MPC是一种罕见的MBC亚型,其浸润性癌成分直接转化为黏液软骨样基质,无介于中间的梭形细胞肉瘤样化生成分过渡,呈三阴性免疫表型,Vimentin及S-100弥漫阳性,基底样标志CK5/6、CK14及EGFR部分或者局灶阳性。治疗一般是手术联合放化疗,也可行新辅助化疗。
所有作者均声明不存在利益冲突



























