
探讨DOS(多西他赛联合奥沙利铂、替吉奥)方案在进展期胃腺癌D2根治术后辅助化疗中的疗效。
回顾性分析晋城市人民医院2017年1月至2019年1月130例进展期胃腺癌行D2根治术后辅助化疗患者的临床资料,依据治疗方案分为DOS方案化疗组(DOS组,63例)和SOX(奥沙利铂、替吉奥)方案化疗组(SOX组,67例)。比较两组患者近期疗效及不良反应。
因治疗时间不规律原因两组中各脱组2例,最终DOS组61例,SOX组65例。DOS组1、2、3年无病生存(DFS)率分别为80.33%、73.77%、62.30%,SOX组分别为73.85%、55.38%、43.54%,两组间DFS差异有统计学意义(χ2=5.43,P=0.022);DOS组1、2、3年总生存(OS)率分别为93.44%、80.33%、70.50%,SOX组分别为96.92%、73.85%、52.31%,两组间OS差异有统计学意义(χ2=4.38,P=0.045)。两组间Ⅰ~Ⅱ级恶心呕吐、腹泻、骨髓抑制、乏力发生率差异均无统计学意义(均P>0.05);Ⅲ~Ⅳ级恶心呕吐、乏力发生率差异均无统计学意义(均P>0.05),而Ⅲ~Ⅳ级腹泻、骨髓抑制发生率差异均有统计学意义(均P<0.05)。
DOS方案辅助治疗进展期胃腺癌D2根治术后患者疗效好,可延长生存期,不良反应可耐受。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是我国癌症相关死亡的主要原因之一,我国是胃癌发病率最高的国家之一,每年新增胃癌患者约40万例,占全球的40%以上[1]。目前进展期胃癌患者术后5年的总生存(OS)率在40%左右[2,3]。术后辅助化疗能否改善患者预后一直在探索中,INT-0116、ACTS-GC、CLASSIC等大型随机对照试验研究结果显示,进展期胃癌术后患者可从氟尿嘧啶联合铂类辅助治疗方案中获益[4,5,6]。第5版日本胃癌规约推荐进展期胃癌D2根治术后一线辅助治疗方案为SOX、XELOX或FOLFOX,但患者治疗后5年OS率仍较低[7]。Al-Batran等[8]研究结果显示多西他赛在胃癌新辅助化疗中能较好抑制肿瘤生长,且不良反应可控。本研究观察了多西他赛联合奥沙利铂、替吉奥(DOS)方案和奥沙利铂、替吉奥(SOX)方案治疗进展期胃癌D2根治术后患者的临床疗效及不良反应,现报道如下。
回顾性分析我院2017年1月至2019年1月130例进展期胃腺癌行D2根治术后辅助化疗患者的临床资料,按治疗方案分为DOS方案化疗组(DOS组,63例)和SOX方案化疗组(SOX组,67例)。纳入标准:(1)术后病理证实为胃腺癌;(2)临床分期为T2~4N+M0;(3)能够完成足疗程辅助化疗;(4)接受胃癌D2根治术;(5)生命体征、各项脏器功能及化验结果正常;(6)Karnofsky评分≥70分;(7)患者签署知情同意书。排除标准:(1)合并其他恶性肿瘤;(2)辅助化疗无法完成或拒绝完成足疗程辅助化疗;(3)存在远处转移;(4)有肿瘤残留或接受D1根治术或清扫淋巴结<16枚;(5)有精神障碍;(6)同时接受其他治疗;(7)失访、临床资料不全;(8)病理诊断存在错配修复功能缺陷(dMMR)、微卫星高度不稳定(MSI-H)、人表皮生长因子受体2(HER2)阳性及胃印戒细胞癌。本研究经我院伦理委员会批准(批准文号:JCPH.No.20210104001)。
DOS方案:多西他赛40 mg/m2,静脉滴注,第1天;奥沙利铂100 mg/m2,静脉滴注,第1天;替吉奥40 mg/m2,口服,2次/d,第1天至第14天;21 d为1个周期。SOX方案:奥沙利铂130 mg/m2,静脉滴注,第1天;替吉奥40 mg/m2,口服,2次/d,第1天至第14天;21 d为1个周期。两组患者均完成8个疗程化疗,每3个周期评价疗效。化疗期间出现Ⅲ、Ⅳ级不良反应者均给予营养支持,对症治疗至消化道不良反应<Ⅰ级、体温<38 ℃、白细胞计数>3.0×109/L、血红蛋白>80 g/L、血小板计数>75×109/L、肝肾功能正常。不耐受化疗、减量后仍出现Ⅲ级以上不良反应、间歇期超过4周以及用药期间临床影像学诊断疾病进展者停止化疗。
观察患者术后1、2、3年无进展生存(DFS)和OS。根据美国国家癌症研究所常见不良反应评价标准(CTCAE)评估不良反应并分级,对比两组患者恶心呕吐、腹泻、乏力、骨髓抑制的发生情况。采用门诊和电话方式进行随访,随访截至2022年1月1日。
采用SPSS 25.0软件进行统计分析。计量资料服从正态分布者用 ±s表示,组间比较采用独立样本t检验;不服从正态分布者用M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验。计数资料用频数(%)表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier法,行log-rank检验。以P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本t检验;不服从正态分布者用M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验。计数资料用频数(%)表示,组间比较采用χ2检验。生存分析采用Kaplan-Meier法,行log-rank检验。以P<0.05为差异有统计学意义。
DOS组由于治疗时间不规律原因脱组2例,最终入组61例;SOX组由于治疗时间不规律原因脱组2例,最终入组65例。两组间患者性别、年龄、肿瘤原发部位、病理分期、病理分型、淋巴结清扫数比较,差异均无统计学意义(均P>0.05)(表1),具有可比性。
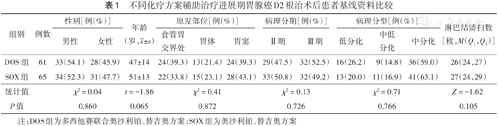
不同化疗方案辅助治疗进展期胃腺癌D2根治术后患者基线资料比较
不同化疗方案辅助治疗进展期胃腺癌D2根治术后患者基线资料比较
| 组别 | 例数 | 性别[例(%)] | 年龄(岁, ±s) ±s) | 原发部位[例(%)] | 病理分期[例(%)] | 病理分型[例(%)] | 淋巴结清扫数[枚,M(Q1,Q3)] | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | 食管胃交界处 | 胃体 | 胃窦 | Ⅱ期 | Ⅲ期 | 低分化 | 中低分化 | 中分化 | ||||
| DOS组 | 61 | 33(54.1) | 28(45.9) | 47±14 | 24(39.3) | 13(21.4) | 24(39.3) | 29(47.5) | 32(52.5) | 16(26.2) | 9(14.8) | 36(59.0) | 26(24,27) |
| SOX组 | 65 | 34(52.3) | 31(47.7) | 51±13 | 22(33.8) | 15(23.1) | 28(43.1) | 33(50.8) | 32(49.2) | 13(20.0) | 11(16.9) | 41(63.1) | 27(24,29) |
| 统计值 | χ2=0.04 | t=-1.86 | χ2=0.41 | χ2=0.13 | χ2=0.71 | Z=-1.62 | |||||||
| P值 | 0.860 | 0.065 | 0.872 | 0.726 | 0.766 | 0.105 | |||||||
注:DOS组为多西他赛联合奥沙利铂、替吉奥方案;SOX组为奥沙利铂、替吉奥方案
DOS组1、2、3年无病生存(DFS)率分别为80.33%、73.77%、62.30%,SOX组分别为73.85%、55.38%、43.54%,两组间DFS差异有统计学意义(χ2=5.43,P=0.022);DOS组1、2、3年OS率分别为93.44%、80.33%、70.50%,SOX组分别为96.92%、73.85%、52.31%,两组间OS差异有统计学意义(χ2=4.38,P=0.045)。
两组间Ⅰ~Ⅱ级恶心呕吐、腹泻、骨髓抑制、乏力发生率比较,差异均无统计学意义(均P>0.05);Ⅲ~Ⅳ级恶心呕吐、乏力发生率比较,差异均无统计学意义(均P>0.05),Ⅲ~Ⅳ级腹泻、骨髓抑制发生率比较,差异均有统计学意义(均P<0.05)(表2)。
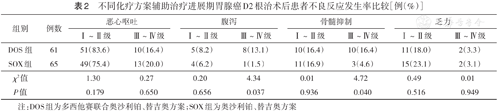
不同化疗方案辅助治疗进展期胃腺癌D2根治术后患者不良反应发生率比较[例(%)]
不同化疗方案辅助治疗进展期胃腺癌D2根治术后患者不良反应发生率比较[例(%)]
| 组别 | 例数 | 恶心呕吐 | 腹泻 | 骨髓抑制 | 乏力 | ||||
|---|---|---|---|---|---|---|---|---|---|
| Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | Ⅰ~Ⅱ级 | Ⅲ~Ⅳ级 | ||
| DOS组 | 61 | 51(83.6) | 10(16.4) | 5(8.2) | 8(13.1) | 10(16.4) | 10(16.4) | 11(18.0) | 2(3.3) |
| SOX组 | 65 | 49(75.4) | 13(20.0) | 4(6.2) | 1(1.5) | 11(16.9) | 3(4.6) | 15(23.1) | 2(3.1) |
| χ2值 | 1.30 | 0.27 | 0.20 | 4.34 | 0.01 | 4.72 | 0.49 | 0.01 | |
| P值 | 0.179 | 0.650 | 0.656 | 0.037 | 0.936 | 0.040 | 0.516 | 0.949 | |
注:DOS组为多西他赛联合奥沙利铂、替吉奥方案;SOX组为奥沙利铂、替吉奥方案
目前进展期胃癌患者预后仍然较差,虽然D2根治术后全身辅助化疗能够改善一部分患者的3年OS[9,10,11],但目前以铂类联合5-氟尿嘧啶为主的化疗方案并未带来令人满意的效果[12,13,14]。Al-Batran等[8]研究证实了紫杉醇类药物多西他赛在胃癌新辅助化疗中的高效性,因此探讨其在进展期胃癌术后辅助化疗中的作用十分必要。多西他赛的作用机制是加强微管蛋白聚合和抑制微管解聚,因而能破坏肿瘤细胞的有丝分裂,为M期周期特异性药物,这对不典型的细胞周期特异性药物5-氟尿嘧啶和奥沙利铂是一个有效补充。作为第二代紫杉醇类药物,多西他赛在细胞内浓度比紫杉醇高3倍,并在细胞内滞留时间更长,这也是其抗肿瘤活性较强的重要原因。
Park等[15]研究比较了546例进展期胃癌D2淋巴结清扫术后替吉奥单药辅助化疗与SOX方案以及SOX方案联合放疗的辅助治疗效果,结果显示三组3年DFS率分别为64.8%、74.3%和72.8%,与辅助化疗相比加入放疗并未使患者获益(P= 0.074,P=0.879),而SOX方案联合化疗组疗效优于联合放疗组,这也再次证明了SOX方案在进展期胃癌术后辅助治疗中的效果。但分层分析发现,与替吉奥单药相比SOX方案并未使ⅢB和ⅢC期患者获益,因此对于复发转移风险较高的Ⅲ期胃癌患者,两药联合方案有效率仍然较低。Zhang等[16]报道在进展期胃癌新辅助治疗方面,DOS方案比SOX方案反应率和疾病控制率更高,且患者术后5年OS率也更高(51.6%比25.8%,P<0.001)。本研究结果显示,进展期胃腺癌D2根治术后行DOS方案辅助治疗的1、2、3年DFS率、OS率均高于SOX方案辅助治疗(均P<0.05),提示多西他赛对5-氟尿嘧啶联合奥沙利铂是一个有效的补充,与以上研究结果相似。
在不良反应方面,本研究结果显示,DOS组Ⅲ~Ⅳ级骨髓抑制和腹泻发生率均较SOX组高(均P<0.05),两组不良反应经对症治疗后均缓解,无化疗相关死亡病例。本研究SOX组的Ⅲ~Ⅳ级乏力和骨髓抑制发生率分别为3.1%和4.6%,与王风华等[17]、Sasako等[18]研究中Ⅲ~Ⅳ级不良反应发生率5%~10%接近;本研究DOS组Ⅲ~Ⅳ级恶心呕吐和骨髓抑制发生率与Zhang等[16]报道的相似,这可能与多西他赛对有丝分裂期发挥特异性抑制作用有关。此外,多西他赛具有高蛋白结合率和低肾排泄率,在肝脏中代谢,主要经胆道从粪便排出,对肝功能影响较大,使用时应重点关注患者肝功能的变化。
目前研究已证实分子病理dMMR、MSI-H或者HER2阳性的患者均会从免疫治疗、赫赛汀等个体化治疗中获益,但对于术后辅助治疗如何进行尚未达成共识,因此本研究剔除了这部分患者,在以往研究的基础上进一步明确了加入多西他赛的DOS方案会使无特殊标志物表达的胃癌患者更加获益,但其导致的骨髓抑制和腹泻等不良反应亦需受到足够的重视,在一些年老体弱的群体中使用应该谨慎并予以足够的关注。
总之,本研究表明DOS方案在进展期胃腺癌D2根治术后患者中进行辅助化疗疗效好,不良反应均可耐受,但本研究病例数较少,随访时间短,且为单中心数据,仍需要多中心、大样本的随机对照试验研究来进一步验证DOS方案的疗效及安全性。
所有作者均声明不存在利益冲突



























