
鉴定并筛选胆管癌差异性甲基化基因以预测胆管癌患者的预后。
选择2019年10月至2020年5月福建省立医院8例胆管癌患者胆管癌组织及癌旁组织进行850K甲基化测序分析,获取差异性甲基化基因。从癌症基因组图谱(TCGA)数据库中下载2018年36例患者胆管癌全基因组甲基化数据及临床信息,从基因表达综合(GEO)数据库下载2012年胆管癌甲基化数据(GSE32879),从GEPIA2数据库下载2018年TCGA数据库胆管癌总生存(OS)及无病生存(DFS)差异生存基因组数据。联合送检样本850K甲基化测序分析的差异甲基化位点(DMP)和差异甲基化区域(DMR)结果、TCGA和GEO数据库中甲基化基因以及胆管癌生存基因,在Sangerbox VENN工具中进行多数据集合分析,交集筛选得出共同差异性甲基化基因。在Sangerbox中运用最小P值法确定基因表达的临界值,分为差异性甲基化基因高、低表达组,比较两组胆管癌患者OS、DFS、疾病特异性生存(DSS)、无病间隔(DFI)、无进展间隔(PFI)。进行基因本体(GO)和京都基因与基因组百科全书(KEGG)富集分析。
8例患者的胆管癌组织与癌旁组织850K甲基化测序共鉴定出121 954个DMP,DMR中共鉴定出差异性甲基化基因1 399个;交集鉴定得出共同预后相关基因氨基葡萄糖(N-乙酰)转移酶1(GCNT1)和神经营养受体酪氨酸激酶3(NTRK3)。GCNT1在胆管癌组织中表达高于癌旁组织,差异有统计学意义(P=0.040);NTRK3在胆管癌组织中表达高于癌旁组织,差异无统计学意义(P=0.790)。采用最小P值法,以GCNT1及NTRK3联合表达情况预测胆管癌患者预后,按两基因表达量总和排序,以排序的30%为临界值时,胆管癌高表达组及低表达组间DFS差异最为显著(P<0.001);两组间OS差异无统计学意义(P=0.065)。GO功能分析结果显示,GCNT1与蛋白质糖基化、大分子糖基化、糖化、糖蛋白生物合成过程、糖蛋白代谢过程、转移酶活性和转移糖基、蛋白质O-聚糖基化、O-聚糖加工等有关;NTRK3与神经营养素信号通路、Ras信号通路、EGFR酪氨酸激酶抑制、ErbB信号通路、磷脂酶D信号通路、癌症中枢碳代谢、自然杀伤细胞介导的细胞毒性等有关。KEGG分析结果显示,GCNT1主要与黏蛋白型O-聚糖生物合成、代谢途径等系统功能相关联,NTRK3主要与细胞表面受体通路、细胞内信号转导、刺激反应的正向调节、跨膜受体蛋白酪氨酸激酶信号通路、酶联受体蛋白信号通路、MAPK信号通路级联及调节、蛋白质磷酸化信号转导等系统功能相关联。
胆管癌差异性甲基化基因GCTNT1、NTRK3表达对胆管癌患者预后有一定预测作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆管癌是发生于胆道上皮的恶性肿瘤,其发病率和病死率逐年上升[1],根据解剖位置分为肝内胆管癌、肝门部胆管癌和远端胆管癌。由于其临床隐匿性,且缺乏早期诊断的生物标志物,使得早期诊断困难,大多数患者确诊时已是晚期[2]。近年来胆管癌的5年总生存(OS)率和有效治疗水平并未有较大提高[3],术后复发率及转移率仍较高[4],目前识别复发高危患者和预测患者预后的能力仍较差。DNA甲基化是一种核心的表观遗传修饰,在基因组调控、疾病发生和机体发育等过程中起着关键作用[5]。抑癌基因中常发生CpG岛启动子的异常DNA甲基化,这种对正常甲基化模式的破坏可导致基因组稳定性和表达的改变,诱导肿瘤的发生和发展[6]。DNA甲基化的改变加速肿瘤进展,导致临床结局不良。本研究对胆管癌组织及癌旁正常组织进行850K甲基化测序分析,并联合癌症基因组图谱(TCGA)数据库胆管癌甲基化数据及基因表达综合(GEO)数据库数据进行综合分析,筛选与胆管癌生存相关的甲基化基因并进行验证,评估差异性甲基化基因作为胆管癌生物标志物的可能性。
选择2019年10月至2020年5月福建省立医院收治的8例肝内胆管癌患者,男性4例,女性4例;中位年龄63.5岁(34~75岁);Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别为3、1、2、2例;中位癌胚抗原(CEA)12.67 ng/ml(1.53~143.2 ng/ml),中位糖类抗原199(CA199)328.65 U/ml(25.96 U/ml至>10 000 U/ml)。术后均经病理组织学确诊为胆管癌。取无坏死的肿瘤组织作为胆管癌组织标本,距肿瘤边缘>3 cm无癌细胞残留的肝脏或胆管组织作为癌旁正常组织标本,分别放入装有组织保存液的试管中,暂存于-86 ℃冰箱,送至北京诺禾致源科技股份有限公司行850K甲基化测序分析。本研究符合2013年修订的《赫尔辛基宣言》的要求,患者均知情同意。
在TCGA数据库下载2018年36例患者胆管癌全基因组甲基化数据及临床信息,患者中位年龄65岁(29~82岁);Ⅰ期19例,Ⅱ期9例,Ⅲ期1例,Ⅳ期7例;在GEO数据库下载2012年胆管癌甲基化数据(GSE32879);在GEPIA2(http://gepia2.cancer-pku.cn/)下载2018年TCGA数据库胆管癌OS及无病生存(DFS)差异生存基因组数据,联合送检样本的差异性甲基化基因结果、TCGA和GEO数据库甲基化基因以及胆管癌生存基因,在Sangerbox VENN工具中(http://www.sangerbox.com/tool)进行多数据集合分析,交集筛选得出共同差异性甲基化基因。
甲基化芯片Infinium Methylation EPIC BeadChip(简称850K甲基化芯片)(美国Illumina公司)既包含原450K甲基化芯片91%位点,又增加了413 745个位点,总共853 307个CpG位点。850K甲基化芯片全面覆盖基因启动子区、基因编码区、CpG岛以及ENCODE和FANTOM5计划中发现的增强子区。
首先对原始数据进行质控和探针过滤,确保后续分析数据有效准确。之后使用BMIQ方法对β值矩阵归一化;根据分组信息和筛选标准筛选差异甲基化位点(DMP)和差异甲基化区域(DMR)。DMP分析为比对肿瘤组织与癌旁组织的β值,获得Δβ值,从而得到肿瘤组织DMP。DMR在基因印记调节中起重要作用,基因组中DMP常会成簇出现,形成一段差异性甲基化区域,区段的范围数百bp至Mb。用DMRcate分析普通项目获得DMR时,选择的相关阈值为:该区域包含>7个CpG位点,相邻位点在1 000 bp以内,校正P值(FDR)<0.05。
OS定义为从随机化开始至任何原因引起死亡的时间;DFS定义为从随机化开始至疾病复发或由于疾病进展导致患者死亡的时间;疾病特异性生存(DSS)定义为从随机化开始至因胆管癌导致死亡的时间;无病间隔(DFI)定义为从疾病治疗后至再次出现肿瘤为终点事件的间隔时间;无进展间隔(PFI)定义为从疾病治疗后至恶化或死亡为终点事件的间隔时间。
采用R语言4.0.2分析数据。在TCGA甲基化数据中,根据基因表达水平将胆管癌患者分为高表达组与低表达组。在Sangerbox中运用最小P值法确定基因在各预后类型中的表达临界值。基因间相关性采用Pearson相关分析。采用Kaplan-Meier法进行生存分析,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC)。以P<0.05为差异有统计学意义。
对8例胆管癌组织与癌旁组织进行DMP分析,共鉴定出121 954个DMP。其中97 510个DMP在胆管癌组织中高甲基化,对应15 052个基因;24 444个DMP低甲基化,对应5 926个基因。在DMR中共鉴定出差异性甲基化基因1 399个。通过韦恩图交集鉴定得出共同预后基因氨基葡萄糖(N-乙酰)转移酶1(GCNT1)和神经营养受体酪氨酸激酶3(NTRK3)。
在GEPIA2中通过TCGA数据对比分析胆管癌组织及癌旁组织GCNT1及NTRK3基因表达量。GCNT1在胆管癌组织中表达高于癌旁组织,差异有统计学意义(P=0.040);NTRK3在胆管癌组织中表达高于癌旁组织,差异无统计学意义(P=0.790)(图1)。
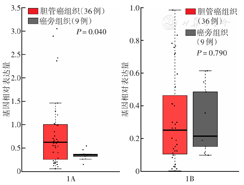

注:TCGA为癌症基因组图谱;GCNT1为氨基葡萄糖(N-乙酰)转移酶1;NTRK3为神经营养受体酪氨酸激酶3;基因相对表达量以-log2(TPM+1)表示;TPM为每百万条reads的转录本
采用最小P值法,按GCNT1基因表达量排序,以排序的60%为临界值分为高、低表达组,高表达组与低表达组间OS、DSS、PFI差异最为显著(图2A、图2B、图2C),1、3年OS率AUC为0.57、0.51;1、3年DSS率AUC为0.52、0.52;1、3年PFI率AUC为0.74、0.90。当以排序的55%为高、低表达临界值时,高表达组与低表达组间DFI差异最为显著(图2D),1、3、5年OS率AUC为0.46、0.36、0.60。
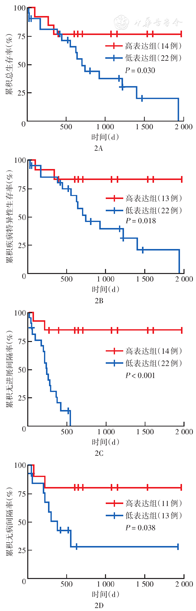

注:TCGA为癌症基因组图谱;GCNT1为氨基葡萄糖(N-乙酰)转移酶1;采用最小P值法,按GCNT1基因表达量排序,以排序的60%为临界值(图2A、2B、2C)或以排序的55%为临界值(图2D)分为高、低表达组
同样采用最小P值法,根据NTRK3基因表达量排序,以排序的73%为高、低表达临界值时,高表达组与低表达组间OS、PFI差异最为显著(图3A、图3B),1、3年OS率AUC为0.57、0.56;1、3年PFI率AUC为0.67、0.86。当以排序的55%为高、低表达临界值时,高表达组与低表达组间DFI差异最为显著(图3C),1、3、5年OS率AUC为0.70、0.76、0.55。
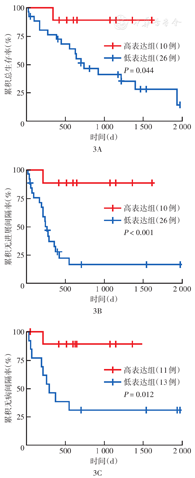

注:TCGA为癌症基因组图谱;NTRK3为神经营养受体酪氨酸激酶3;采用最小P值法,按NTRK3基因表达量排序,以排序的73%为临界值(图3A、3B)或以排序的55%为临界值(图3C)分为高、低表达组
GCNT1及NTRK3基因的相关性分析结果显示,二者无相关性(R=-0.019,P=0.910)。以GCNT1及NTRK3联合表达情况预测胆管癌患者预后,按两基因表达量总和排序,以排序的30%为临界值分为两基因高、低表达组时,胆管癌高表达组及低表达组间DFS差异最为显著(图4A),两组间OS差异无统计学意义(图4B)。
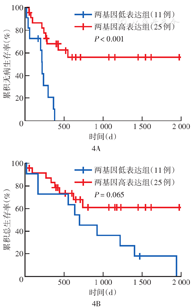

注:TCGA为癌症基因组图谱;GCNT1为氨基葡萄糖(N-乙酰)转移酶1;NTRK3为神经营养受体酪氨酸激酶3;按两基因表达量总和排序,以排序的30%为临界值分为两基因高、低表达组
GO分析结果显示,GCNT1富集在蛋白质糖基化、大分子糖基化、糖化、糖蛋白生物合成过程、糖蛋白代谢过程、转移酶活性和转移糖基、蛋白质O-聚糖基化、O-聚糖加工等方面。KEGG分析结果显示GCNT1主要与黏蛋白型O-聚糖生物合成、代谢途径等系统功能相关联(图5)。
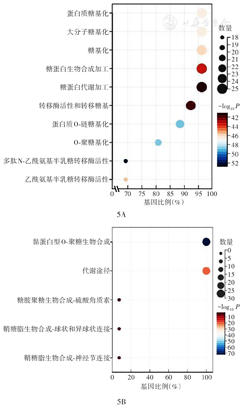

注:TCGA为癌症基因组图谱;GCNT1为氨基葡萄糖(N-乙酰)转移酶1;GO为基因本体;KEGG为京都基因与基因组百科全书
GO分析结果显示,NTRK3基因富集在神经营养素信号通路、Ras信号通路、EGFR酪氨酸激酶抑制、ErbB信号通路、磷脂酶D信号通路、癌症中枢碳代谢、自然杀伤细胞介导的细胞毒性等方面。KEGG分析结果显示,NTRK3主要与细胞表面受体通路、细胞内信号转导、刺激反应的正向调节、跨膜受体蛋白酪氨酸激酶信号通路、酶联受体蛋白信号通路、MAPK信号通路级联及调节、蛋白质磷酸化信号转导等系统功能相关联(图6)。
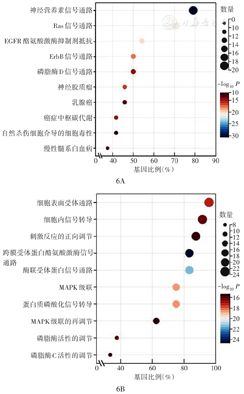

注:TCGA为癌症基因组图谱;NTRK3为神经营养受体酪氨酸激酶3;GO为基因本体;KEGG为京都基因与基因组百科全书
DNA甲基化表达的改变是肿瘤发生的致病因素,在众多肿瘤中均很常见。通过分析DNA甲基化区域显示,一些基因组区域具有非常高的高甲基化或低甲基化频率,这与基因组位点编码的基因表达相关。DNA甲基化模式的失调被认为是肿瘤发生的起始阶段和晚期的一个重要基因事件[7]。DNA甲基化在胆管癌细胞周期、细胞凋亡、DNA修复、细胞黏附和分子通路等过程中发挥重要作用。并且基因的异常甲基化可以沉默肿瘤抑制基因的表达,从而促进肿瘤的形成。从分子层面,DNA甲基化通过引起DNA分子构象的改变影响特定蛋白及其黏附能力,从而直接干扰特异转录因子和各种启动子识别位点的结合,引起转录抑制。这是因为甲基-CpG结合域蛋白选择性地与甲基化启动子结合形成复合物,阻断了转录因子结合部位[8]。
本研究对DNA甲基化基因表达进行了相关分析,联合多数据库进行差异性基因对比分析,筛选出共同差异基因GCNT1及NTRK3;胆管癌GCNT1高、低表达组OS、DSS、DFI、PFI差异均有统计学意义,表明GCNT1表达水平对胆管癌预后有一定预测性;胆管癌NTRK3高、低表达组OS、DFI、PFI差异均有统计学意义;并且在明确两基因无明显相关性后,联合两基因表达总量对胆管癌OS及DFS进行分析,确定以基因排序的30%为高、低表达的临界值时,两基因不同表达组的DFS比较差异有统计学意义,OS差异无统计学意义。
GCNT1基因是β-1,6-N-乙酰氨基葡萄糖转移酶基因家族的成员,对Galβ1-3(GlcNAcβ1-6)GalNAc结构和核心二分支O-聚糖的形成至关重要,是形成核心二分支O-聚糖的关键酶。通过GO功能注释分析了其功能主要集中在蛋白质糖基化、大分子糖基化、糖化、糖蛋白生物合成过程、糖蛋白代谢过程、转移酶活性和转移糖基、蛋白质O-聚糖基化、O-聚糖加工等方面。已有文献表明在前列腺癌中GCNT1表达的免疫组织化学状态与前列腺癌的侵袭、淋巴结转移密切相关[9],并可能为前列腺癌特异性糖蛋白生物标志物[10],而该基因是否在胆管癌中有相类似的作用尚不清楚。表达GCNT1的癌细胞可以逃离宿主的免疫防御系统,半乳糖凝聚素3与癌细胞表面表达的核心二分支O-聚糖结合是干扰宿主自然杀伤细胞与癌细胞接触的关键步骤[11]。推测GCNT1可能是预测胆管癌恶性程度的因素,但仍需进一步基础实验验证。
NTRK3是一种膜结合受体,在与神经营养素结合后,可磷酸化自身和MAPK通路的成员。通过这种激酶发出的信号可导致细胞分化,并可能在感觉身体位置的本体感觉神经元发育中发挥作用。该基因突变与髓母细胞瘤、分泌性乳腺癌和其他癌症有关。NTRK3富集在神经营养素信号通路、Ras信号通路、EGFR酪氨酸激酶抑制、ErbB信号通路、磷脂酶D信号通路、神经胶质瘤、乳腺癌、癌症中枢碳代谢、自然杀伤细胞介导的细胞毒性、脉络膜髓样白血病等方面。NTRK3影响多种信号通路,包括MAPK和PI3K通路,进一步促进细胞分化,影响肿瘤进展[12,13]。NTRK3在60%结肠腺瘤和67%结肠腺癌中甲基化,NTRK3突变体促进了肿瘤的形成和进展,并且NTRK3可以在没有其配体神经营养素3的情况下,触发细胞凋亡并抑制肿瘤生长,而通过添加神经营养素3可逆转这些作用[14]。但关于NTRK3在胆管癌中的具体作用仍需进一步深入研究。
综上所述,本研究通过对胆管癌组织及正常组织的甲基化分析,鉴定其差异性甲基化基因,利用生物学信息数据库鉴定共同胆管癌差异性甲基化基因,发现GCNT1及NTRK3基因对胆管癌预后有一定预测作用,联合两基因建立生物标志物模型能较好地预测胆管癌患者DFS。
所有作者均声明不存在利益冲突



























