
探讨结直肠癌患者KRAS、NRAS、BRAF V600E基因突变与临床病理特征的相关性。
选取山西省肿瘤医院2020年1月至2021年12月手术切除并经病理证实为结直肠癌217例患者标本,回顾性分析患者临床资料。采用直接测序法检测手术切除组织的石蜡标本中KRAS、NRAS、BRAF V600E基因突变情况。比较不同临床病理特征患者的KRAS、NRAS、BRAF V600E突变率。
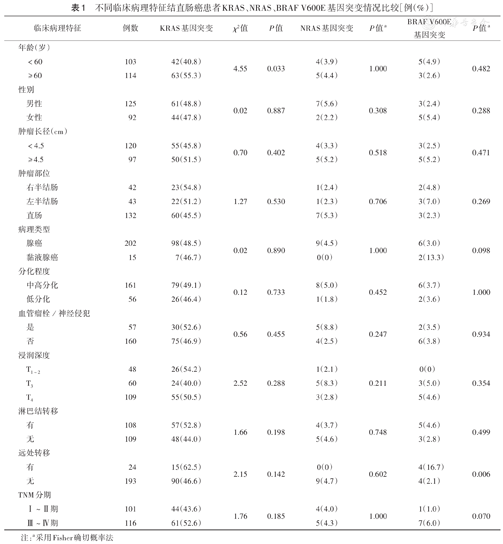
217例结直肠癌患者中KRAS、NRAS、BRAF V600E基因突变率分别为48.4%(105/217)、4.1%(9/217)、3.7%(8/217),其中1例(0.5%)患者同时存在KRAS和NRAS突变。NRAS基因突变与性别、年龄、肿瘤大小、肿瘤部位、病理类型、分化程度、浸润深度、淋巴结转移、远处转移、TNM分期、血管瘤栓/神经侵犯均无相关性(均P>0.05);年龄≥60岁患者KRAS基因突变率高于<60岁患者[55.3%(63/114)比40.8%(42/103),χ2=4.55,P=0.033],KRAS基因突变与其他临床病理特征均无相关性(均P>0.05);伴远处转移的患者BRAF V600E基因突变率高于无远处转移患者[16.7%(4/24)比2.1%(4/193),P=0.006],BRAF V600E基因突变与其他临床病理特征均无相关性(均P>0.05)。
结直肠癌患者年龄大可能易发生KRAS基因突变,伴远处转移者BRAF V600E基因突变率较高,NRAS基因突变与临床病理特征无相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是消化道常见的恶性肿瘤之一,据2018年全球癌症统计数据显示,结直肠癌的发病率和死亡率分别居全球第3位和第2位,已经成为严重威胁人类健康的疾病之一[1]。结直肠癌的发生、发展是一个多基因、多步骤调控的复杂过程,研究发现MAPK信号通路的异常激活在结直肠癌发生、发展过程中起着重要作用[2],位于MAPK信号转导通路上的RAS、BRAF基因已经成为结直肠癌靶向治疗的重要分子标志物[3],美国国立综合癌症网络(NCCN)指南推荐所有结直肠癌患者均应行KRAS、NRAS、BRAF基因检测[4]。目前RAS、BRAF V600E基因状态与结直肠癌临床病理特征之间的关系尚存在争议。本研究通过分析结直肠癌组织中KRAS、NRAS及BRAF V600E基因突变情况,探讨其与结直肠癌临床病理特征的关系,以期为结直肠癌患者制定个体化治疗方案提供参考。
纳入标准:(1)经术后病理检查确诊结直肠癌;(2)术前未行任何治疗;(3)临床病理资料完整。排除标准:(1)合并炎症性肠病或其他部位原发恶性肿瘤;(2)临床病理资料缺失。回顾性收集山西省肿瘤医院2020年1月至2021年12月经手术切除并经病理检查证实的217例结直肠癌患者资料,对其手术切除标本行KRAS、NRAS及BRAF V600E基因检测。患者年龄(60±12)岁,范围22~88岁;193例单纯行结直肠癌根治术,15例行结直肠癌根治术及同期肝转移灶切除术,6例在结直肠癌局部根治术后6个月内行肝转移灶切除术,3例在结直肠癌局部根治术后6个月内行肺转移灶胸腔镜切除术。本研究经我院医学伦理委员会批准(批准文号:201763),所有患者、家属均签署知情同意书。
所有病理标本均经10%甲醛溶液固定12~24 h,石蜡包埋。将石蜡包埋的肿瘤组织8 μm厚切片,取4~8张放入EP管中用于DNA提取。严格按照FFPE样品DNA分离试剂盒(德国Qiagen公司)说明书,经过脱蜡、裂解、消化、修复、吸附、洗脱等步骤,提取基因组DNA,用核酸蛋白测定仪测定DNA纯度和浓度,调整DNA浓度2~3 ng/μl,-20 ℃保存备用。
人类KRAS、NRAS、BRAF基因突变联合检测试剂盒购自北京鑫诺美迪基因公司。按照说明书,以提取的基因组DNA为模板,采用聚合酶链反应(PCR)方法进行基因扩增。取5 μl PCR扩增产物进行琼脂糖凝胶电泳,紫外线分析仪观察电泳结果。取PCR纯化产物0.5 μl,加入NaAc、乙醇,离心半径9.5 cm、13 500 r/min 4 ℃离心30 min,待乙醇挥发后加入Hi-Di,溶解DNA,应用PCR仪(新加坡ThermoFisher Scientific公司)进行变性翻译,于96孔板点样,使用ABI-3130xl基因测序仪(日本ABI公司)测序,检测包括KRAS、NRAS基因第2、3、4号外显子及BRAF基因的V600E位点的体细胞突变情况。
采用SPSS 22.0软件进行统计学分析。计量资料符合正态分布,以 ±s表示;计数资料以频数(%)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
±s表示;计数资料以频数(%)表示,组间比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
217例结直肠癌患者中,男性125例(57.6%),女性92例(42.4%);年龄<60岁103例(47.5%),≥60岁114例(52.5%);右半结肠癌42例(19.4%),左半结肠癌43例(19.8%),直肠癌132例(60.8%);肿瘤长径(4.7±1.7)cm,范围1~12 cm,肿瘤长径<4.5 cm者120例(55.3%),≥4.5 cm者97例(44.7%);腺癌202例(93.1%),黏液腺癌15例(6.9%);分化程度:中高分化161例(74.2%),低分化56例(25.8%);T1~2期48例(22.2%),T3期60例(27.6%),T4期109例(50.2%);淋巴结未转移109例(50.2%),淋巴结转移108例(49.8%);未远处转移193例(88.9%),远处转移24例(11.1%);无血管瘤栓/神经侵犯160例(73.7%),血管瘤栓/神经侵犯57例(26.3%);TNM分期:Ⅰ~Ⅱ期101例(46.5%),Ⅲ~Ⅳ期116例(53.5%)。
217例手术切除标本均进行了KRAS、NRAS、BRAF V600E基因检测。(1)KRAS基因突变105例,突变率48.4%,以第2号外显子突变最常见,其基因突变率为43. 8%(95/217)。第2号外显子中第12号密码子突变率为30.4%(66/217),分别为GGT>GAT突变28例,GGT>GTT突变15例,GGT>GCT突变3例,GGT>TGT突变12例,GGT>AGT突变6例,双突变(GGT>GTT和GGT>GAT)2例。第2号外显子第13号密码子突变率为13.4%(29/217),均为GGC>GAC。第3号外显子和第4号外显子基因突变率均为2.3%(5/217)。(2)NRAS基因突变9例,突变率4.1%,其中第2号外显子突变4例(1.84%),第3号外显子突变5例(2.3%),未发现第4号外显子突变。(3)BRAF V600E突变8例,突变率3.7%。(4)1例(0.5%)患者存在KRAS和NRAS联合突变。
(1)年龄≥60岁结直肠癌患者KRAS基因突变率高于<60岁患者,差异有统计学意义(P=0.033);其他临床病理特征亚组患者KRAS基因突变率差异均无统计学意义(均P>0.05)(表1)。(2)伴远处转移的结直肠癌患者BRAF V600E基因突变率高于无远处转移患者,差异有统计学意义(P=0.006);其他临床病理特征亚组患者BRAF V600E基因突变率差异均无统计学意义(均P>0.05)(表1)。(3)所有临床病理特征亚组患者NRAS基因突变率差异均无统计学意义(均P>0.05)(表1)。
不同临床病理特征结直肠癌患者KRAS、NRAS、BRAF V600E基因突变情况比较[例(%)]
不同临床病理特征结直肠癌患者KRAS、NRAS、BRAF V600E基因突变情况比较[例(%)]
| 临床病理特征 | 例数 | KRAS基因突变 | χ2值 | P值 | NRAS基因突变 | P值a | BRAF V600E基因突变 | P值a | |
|---|---|---|---|---|---|---|---|---|---|
| 年龄(岁) | |||||||||
| <60 | 103 | 42(40.8) | 4.55 | 0.033 | 4(3.9) | 1.000 | 5(4.9) | 0.482 | |
| ≥ 60 | 114 | 63(55.3) | 5(4.4) | 3(2.6) | |||||
| 性别 | |||||||||
| 男性 | 125 | 61(48.8) | 0.02 | 0.887 | 7(5.6) | 0.308 | 3(2.4) | 0.288 | |
| 女性 | 92 | 44(47.8) | 2(2.2) | 5(5.4) | |||||
| 肿瘤长径(cm) | |||||||||
| <4.5 | 120 | 55(45.8) | 0.70 | 0.402 | 4(3.3) | 0.518 | 3(2.5) | 0.471 | |
| ≥ 4.5 | 97 | 50(51.5) | 5(5.2) | 5(5.2) | |||||
| 肿瘤部位 | |||||||||
| 右半结肠 | 42 | 23(54.8) | 1.27 | 0.530 | 1(2.4) | 0.706 | 2(4.8) | 0.269 | |
| 左半结肠 | 43 | 22(51.2) | 1(2.3) | 3(7.0) | |||||
| 直肠 | 132 | 60(45.5) | 7(5.3) | 3(2.3) | |||||
| 病理类型 | |||||||||
| 腺癌 | 202 | 98(48.5) | 0.02 | 0.890 | 9(4.5) | 1.000 | 6(3.0) | 0.098 | |
| 黏液腺癌 | 15 | 7(46.7) | 0(0) | 2(13.3) | |||||
| 分化程度 | |||||||||
| 中高分化 | 161 | 79(49.1) | 0.12 | 0.733 | 8(5.0) | 0.452 | 6(3.7) | 1.000 | |
| 低分化 | 56 | 26(46.4) | 1(1.8) | 2(3.6) | |||||
| 血管瘤栓/神经侵犯 | |||||||||
| 是 | 57 | 30(52.6) | 0.56 | 0.455 | 5(8.8) | 0.247 | 2(3.5) | 0.934 | |
| 否 | 160 | 75(46.9) | 4(2.5) | 6(3.8) | |||||
| 浸润深度 | |||||||||
| T1~2 | 48 | 26(54.2) | 2.52 | 0.288 | 1(2.1) | 0.211 | 0(0) | 0.354 | |
| T3 | 60 | 24(40.0) | 5(8.3) | 3(5.0) | |||||
| T4 | 109 | 55(50.5) | 3(2.8) | 5(4.6) | |||||
| 淋巴结转移 | |||||||||
| 有 | 108 | 57(52.8) | 1.66 | 0.198 | 4(3.7) | 0.748 | 5(4.6) | 0.499 | |
| 无 | 109 | 48(44.0) | 5(4.6) | 3(2.8) | |||||
| 远处转移 | |||||||||
| 有 | 24 | 15(62.5) | 2.15 | 0.142 | 0(0) | 0.602 | 4(16.7) | 0.006 | |
| 无 | 193 | 90(46.6) | 9(4.7) | 4(2.1) | |||||
| TNM分期 | |||||||||
| Ⅰ~Ⅱ期 | 101 | 44(43.6) | 1.76 | 0.185 | 4(4.0) | 1.000 | 1(1.0) | 0.070 | |
| Ⅲ~Ⅳ期 | 116 | 61(52.6) | 5(4.3) | 7(6.0) | |||||
注:a采用Fisher确切概率法
KRAS和NRAS是由RAS家族成员基因编码的两种GTP酶蛋白,参与表皮生长因子受体(EGFR)的信号转导,调控细胞生长、分化、增殖和存活。BRAF基因为RAF原癌基因家族成员,位于RAS基因下游,是RAS-RAF-MEK激酶通路上的关键成员。结直肠癌患者基因突变率受检测方法、包含的基因位点、样本量的大小及人种的影响[5]。文献[6]报道40%~50%的结直肠癌患者存在KRAS基因点突变,3.8%~7.0%结直肠癌患者存在NRAS基因点突变。在亚洲结直肠癌患者中,BRAF突变率为5.4%~6.7%[7],其中V600E突变占80%以上,是最常见的BRAF基因激活突变[8]。本研究中KRAS基因突变率为48.4%,为结直肠癌主要的突变基因,其中第2号外显子突变率最高,占KRAF基因总突变的90.5%(95/105),突变位点主要发生在第2号外显子的第12、13位密码子上[9,10],GGT>GAT和GGC>GAC是最常见的突变类型。本研究中NRAS基因突变率为4.1%,与文献报道基本一致;BRAF V600E突变率为3.7%,略低于文献报道,可能与检测的基因位点类型不同有关。
文献报道中结直肠癌患者KRAS基因突变与临床病理特征的关系的结果差异较大,争议的焦点主要集中在肿瘤位置、性别和年龄上。左、右半结肠癌及直肠癌由于存在胚胎起源、解剖学供应、遗传学及细胞分子特征上的差异,导致二者流行病学和致癌机制不同、靶向治疗效果及预后各异[11,12]。有研究结果显示右半结肠癌KRAS基因突变率明显高于左半结肠癌[13],本研究中KRAS基因突变率在左、右半结肠癌及直肠癌中分别为51.2%、54.8%、45.5%,差异无统计学意义(P<0.05)。由于右半结肠管腔较宽、距肛缘较远,早期肿瘤不易被发现,导致右半结肠癌体积大、分化差、分期晚、预后差,而与基因状态无相关性[11,14]。本研究中年龄≥60岁结直肠癌患者KRAS基因突变率(55.3%)明显高于年龄<60岁患者(40.8%)(P<0.05),与多数研究一致[5,15,16],故年龄分层可考虑作为KRAS基因状态无法明确时靶向治疗选择的参考依据[16]。有研究者认为RAS-RAF-MAPK通路可能与性激素相关[17],KRAS基因突变更易发生于女性患者[18]。本研究KRAS基因突变率在不同性别患者中并无差异,可能与样本选择及人种、地域差异有关。
NCCN结直肠癌诊治指南2019.V1版将BRAF基因与KRAS、NRAS基因提到了同等地位。BRAF V600E突变可导致RAF-MAPK信号通路的持续性激活,引起肿瘤细胞分化、增殖、代谢、生长的改变[9]。研究证实BRAF V600E突变预示着患者不良预后和高复发风险[19];Margonis等[20]分析了849例患者数据发现,与KRAS基因突变相比,BRAF V600E突变对总生存和无病生存的影响至少增加3倍。本研究中BRAF V600E突变率较低,但伴随远处转移的结直肠癌患者BRAF V600E突变率(16.7%)明显高于无远处转移患者(2.1%)(P<0.05),Ⅲ~Ⅳ期结直肠癌患者BRAF V600E突变率(6.0%)高于Ⅰ~Ⅱ期患者(1.0%),但差异无统计学意义(P=0.070),提示BRAF V600E突变的患者肿瘤恶性程度可能更高,预后较差,与文献报道基本一致。
尽管关于NRAS基因突变的研究较少,但多中心临床试验证实了NRAS基因突变也是西妥昔单抗治疗产生耐药的一种分子标志物,NRAS基因突变的结直肠癌患者不能从抗EGFR药物中获益[21]。Pikoulis等[22]研究显示NRAS基因突变与患者性别相关,男性NRAS基因突变率高于女性,提示女性结直肠癌患者更容易从抗EGFR靶向治疗中获益,其具体分子机制仍有待进一步探讨。本研究中男性NRAS基因突变率为5.6%,女性为2.2%,差异无统计学意义(P>0.05),可能是NRAS基因的突变率较低、检测的病例数还不足以显示出统计学差异所致。本研究中NRAS基因状态与性别、年龄、肿瘤大小、肿瘤部位、病理类型、分化程度、浸润深度、淋巴结转移、远处转移、TNM分期、血管瘤栓/神经侵犯均无相关性,本课题组将继续增加病例,进一步研究NRAS基因状态与临床病理特征之间的关系。
总之,结直肠癌患者KRAS基因突变位点主要在第2号外显子,年龄与KRAS基因突变相关,伴远处转移与BRAF V600E基因突变相关。本研究为回顾性分析,且病例有限,结果仍有待多中心、大样本、前瞻性研究进一步验证。
所有作者均声明不存在利益冲突



























