目前,手术切除是治疗肾肿瘤的最主要方式。鉴于保留肾单位对患者的长期生存更有益,局限性肾肿瘤的手术切除逐步倾向于肾部分切除术。肾部分切除术的施行需要着重评估热缺血时间、术中失血量和术后肾功能等围术期相关指标。为评估手术复杂程度及预测术后疗效,国内外学者相继提出了一系列肾肿瘤评分系统。文章通过比较各评分系统与肾部分切除术围术期相关指标的相关性,评估其临床指导能力,为临床医师选用适合的肾肿瘤评分系统进行手术方案的决策提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾细胞癌简称肾癌,其发病率持续上升[1]。由于可保留更多肾单位,肾肿瘤的手术治疗逐步由根治切除转变为部分切除[2]。国际上,对于T1a期肾肿瘤的手术治疗推荐尽可能行部分切除,部分T1b或T2期肾肿瘤,依据肿瘤的解剖结构、患者情况及医师经验选择术式。对术式的选择尚缺乏统一的量化标准。
自Kutikov和Uzzo[3]提出第一个术前肾肿瘤评分系统RENAL以来,新的评分系统不断涌现,这些肾肿瘤评分系统作为描述肾脏肿瘤复杂程度的量化标准,是基于肾肿瘤的解剖学特征,如大小、与集合系统和肾窦的关系等,对多个变量进行量化评分可对患者进行术前的肾肿瘤综合评估,以期指导临床医师选择手术方式、预测围术期相关指标和预后。围绕评分系统进行的临床病例回顾研究亦逐渐开展,以检验其适用性及临床指导意义。文章介绍了新评分系统评价细则,比较各评分系统与肾部分切除术围术期相关指标(热缺血时间、术中失血量、术后肾功能)的相关性,分析其对临床指导意义,为临床医师选用适合的肾肿瘤评分系统进行手术方案的决策提供参考。
2014年之前提出的肾肿瘤评分系统的评价细则已有文献总结[4],文章不再赘述。
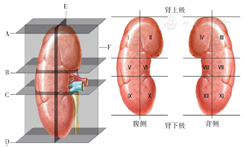
该评分系统基于肾肿瘤影像学解剖特征,包括肾肿瘤的最长径(D1)、肿瘤侵犯最深处与肾髓质或肾窦和集合系统的最小距离(D2)、肿瘤与主要血管的最小距离(D3)等3个方面,对每一方面进行量化评分,根据综合得分评估肾肿瘤复杂程度。具体方法见图1[5]。3项分数之和即为总分,总分3~4分代表复杂程度为低度,5~7分代表复杂程度为中度,>8分代表复杂程度为高度。

注:黑线为肾肿瘤的长径;蓝线为肿瘤侵犯最深处与肾髓质或肾窦和集合系统的最小距离;绿线为肿瘤与主要血管的最小距离
DDD肾肿瘤评分系统细则[6]:(1)根据肿瘤侵犯最深处与肾髓质或肾窦和集合系统的最小距离分别赋予1分(距离肾髓质>5 mm)、2分(距离肾髓质≤5 mm且距离集合系统>5 mm)、3分(距离集合系统≤5 mm);(2)根据肿瘤与主要血管的最小距离分别赋予1分(>10 mm)、2分(5~10 mm)、3分(≤5 mm);(3)根据肿瘤大小赋予相应分值[肿瘤位于肾轮廓内长径(cm)的四舍五入值即为该项评分]。
该评分系统依据肾肿瘤影像学解剖特征将肿瘤分为1、2、3s和3h 4个级别[7]。1级为仅涉及肾皮质的肿瘤,侵犯小叶间动脉和弓形动脉;2级为起源于肾髓质或延伸到肾髓质并到达连接肾乳头顶端的虚拟线的肿瘤,侵犯叶间动脉;3s级为肿瘤延伸到肾窦,向中央集合系统延伸,累及节段动脉及其分支;3h为靠近或累及肾门血管的肿瘤。
在肾部分切除术围术期相关指标中,热缺血时间是反映肿瘤切除难度的重要指标,当其超过20 min时可能导致不可逆的肾功能损伤[8]。肾肿瘤行肾部分切除术的难度主要取决于肿瘤解剖复杂性,因此,理论上,评分系统考量肿瘤解剖复杂性的变量越多,其与热缺血时间的相关性可能越大。
RENAL评分系统基于肾肿瘤影像学解剖特征,包括肿瘤最大径(R)、外凸率(E)、与肾窦或集合系统的距离(N)、位于肾背侧/腹侧(A)、与肾极线关系(L)进行评分,以评估解剖复杂程度,预估手术难度和风险。目前,RENAL评分系统与热缺血时间的关系已有较多研究。多项研究表明,N和L与肾部分切除术的热缺血时间具有较强的相关性(均P<0.05)[9,10,11,12,13,14,15]。但RENAL评分相同的肿瘤,其行肾部分切除术难度可能存在较大差异。例如,位于极线间的外凸≥50%且<4 cm的肿瘤(评分为1+1+1+a+3=6a),与位于极线外的完全内陷的<4 cm肿瘤(评分为1+3+1+a+1=6a)相比,前者手术难度更高,热缺血时间更长。在此例中,肿瘤与肾极线关系的重要性被低估。在RENAL评分系统与热缺血时间的关系研究中,上述病例的存在可能是导致一些研究认为两者不具相关性的原因[5,16]。
相比之下,PADUA评分系统与热缺血时间相关性的研究较少。虽然,该评分系统评分细则中的肿瘤纵向位置、内外侧、与肾窦关系、与集合系统关系均可描述肿瘤解剖的复杂性,较RENAL评分系统对肿瘤解剖复杂性的描述更为全面,但与现有部分研究的结论不一致[11,15]。因此,PADUA评分系统与热缺血时间的关系需要更多的研究证实。
C-Index评分系统是一种描述肾肿瘤中心性的评分系统,其为肾脏中心至肿瘤中心的距离与肿瘤半径之比(C/r),缺乏对肿瘤解剖复杂性的描述。在已有研究中,发现该评分系统与热缺血时间的相关性存有争议(P=0.06)[17,18]。
DAP评分系统通过肿瘤最大径平面上肿瘤距该横截面中心点的距离(A)和肿瘤与肾脏中心平面的距离(P)两项评价因子,对肿瘤进行全面而精准的解剖复杂性描述。诸多研究表明DAP评分与热缺血时间具有显著的相关性(均P<0.05),该评分系统能够较好地预测热缺血时间[9,19,20,21]。
Zonal NePhRO评分系统由RENAL评分系统改良而来,其评价细则中肿瘤与集合系统的接近度(Ne)和肿瘤的位置(Ph)两项可评估肿瘤解剖复杂性[22]。Kriegmair等[23]研究表明该评分系统中低、中、高危险组的热缺血时间差异均有统计学意义(均P<0.05)。DDD评分系统评分细则中,D2、D3均是对肿瘤解剖的具体描述,反映了肿瘤的解剖复杂性。Zhang等[5]研究认为该评分系统与热缺血时间具有很强的相关性(P<0.01),适于预测热缺血时间。但是目前对于DDD和Zonal NePhRO评分系统的研究十分欠缺,尚不能确定其与热缺血时间的相关性。
ABC评分系统根据肿瘤侵犯的血管大小将肿瘤分为不同的级别。通常,肿瘤侵犯的血管与侵犯的深度相关,故该评分系统评价细则亦间接地反映了肿瘤解剖的复杂性。Spaliviero等[6]和Gu等[24]的研究表明该评分系统与热缺血时间具有较好的相关性(P<0.05)。
通过以上总结和分析,发现评分系统中量化肿瘤解剖复杂性的评价因子越多,其与热缺血时间的相关性更强。RENAL、DAP和ABC 3个评分系统与热缺血时间的相关性较好。但是,尚缺乏进一步的研究筛选出预测热缺血时间的最为理想的评分系统。
术中失血量亦为行肾部分切除术的一项重要的考量指标。行肾部分切除术时,除完全内生的小肿瘤外,肿瘤与肾脏接触面积越大,术中破坏的血管趋于更多,因此,肿瘤与肾脏接触的面积直接影响术中失血量。完全内生的小肿瘤,虽然接触面积不大,但行肾部分切除术时需要切开部分肾脏进行肿瘤切除,其术中失血量往往较大。
在RENAL评分系统中,R和E评价因子可在一定程度上反映肿瘤与肾脏的接触面积。Simmons等[12]及Leslie等[25]的研究证明了R和E评价因子与术中失血量显著相关(均P<0.05),Leslie等[25]的研究发现在失血量>500 ml的肿瘤手术中,出现E评价因子>50%的肿瘤占比是E≤50%肿瘤的4.43倍。Zhang等[5]及Sugiura等[16]研究认为RENAL评分与术中失血量不存在明确联系(P>0.05),可能是由于纳入研究的部分病例R和E的评分在总评分中所占比重较小所致。
PADUA评分细则亦包括肿瘤大小和外凸率,但是,Yeon等[11](P=0.123)和Okhunov等[15](P>0.05)开展的两项研究均表明PADUA评分与术中失血量不具明显关联,这可能也因纳入研究的部分病例R和E的评分在总评分中所占比重较小所致。
C-Index评分系统评价细则未能反映肿瘤与肾脏接触面积,故理论上认为其与术中失血量无相关性。但是,现有研究的结论并不一致[17,18,19]。在CSA评分系统中,肾脏与肿瘤的接触面积即为其评分。已有的两项研究证实CSA评分系统与术中失血量具有非常强的相关性(P=0.0003、P=0.001)[25,26]。KS分段系统依据肿瘤侵犯的区域数进行评分[7],但肿瘤侵犯区域数量与肿瘤和肾脏接触面积并不完全相关。虽然,Thompson等[7]的初步研究认为该评分系统与术中失血量具有相关性(P=0.03),但因该评分系统提出晚,围绕其进行的相关研究较少,仍需更多研究验证。
ABC评分系统的分级虽未直接反映肿瘤与肾脏接触面积,但是其依据肿瘤侵犯血管的大小进行分级。Spaliviero等[6]和Gu等[24]的研究表明不同分级的肿瘤,其术中失血量差异均有统计学意义(均P<0.05)。DDD评分系统评价细则虽然不包含描述肿瘤内生率的评价因子,但髓质到肿瘤最深处的距离可在一定程度上反映肿瘤内生率,Zhang等[5]认为DDD评分不同组别间的术中失血量差异有统计学意义(P=0.017)。
综合以上研究,认为RENAL、DDD、ABC和CSA评分适于预测肾部分切除术中失血量,其中,CSA可能是预测术中失血量最可靠的评分系统,但仍需要更多的研究加以验证。
现已提出的十余种评分系统中,大多是为评估肾部分切除术复杂性。围绕肾部分切除术后肾功能进行评估的评分系统较少。患者术后肾功能的恢复与手术过程中肾脏受损的体积相关。因此,理论上推断,能够反映切除和缺血的肾组织体积的评分系统可较好预测肾部分切除术后肾功能。
目前,RENAL评分系统与术后肾功能的关系在诸多研究中结论并不一致[10,13,15,16,27]。虽然已有研究支持PADUA和C-Index评分与术后肾功能有相关性[15,16,17,28],但是这些研究所纳入病例数过少,所以仍需更多研究证实这两种评分系统是否适于预测术后肾功能。有研究发现DAP评分与术后肾功能保留率的相关性优于RENAL和C-Index评分,并认为DAP评分系统的评分每增加1分,术后肾功能下降1.7%[9,19,20,21]。Kriegmair等[23]研究发现Zonal NePhRO评分与术后肾功能不具明显关联(P=0.18)。RTII=I/PT(I指肿瘤的侵犯深度,PT指最靠近肿瘤的肾脏表面到肾窦脂肪的距离);该评分可间接反映手术受损肾实质体积。Nisen等[29]的研究表明RTII评分(P=0.003)在预测术后肾功能方面较RENAL(P=0.01)和PADUA(P=0.02)评分更可靠。此外,Hsieh等[26]研究认为,CSA和RENAL评分均可预测术后肾功能(下降>10%),且CSA评分的预测能力较RENAL评分更好(P<0.001)。
RAIV是专门计算术中切除肾实质体积和肾脏缝合后缺血肾组织体积的评分系统[30],前述两者体积之和即为RAIV评分。可直接反映肾实质受损体积,Shin等[30]的研究证实RAIV术后肾功能具有极强的相关性(P<0.01),并且与RENAL、PADUA、C-Index相比,RAIV更适于预测术后肾功能。
各肾肿瘤评分系统与肾部分切除术围术期相关指标的关系不尽相同。RENAL、ABC和DAP评分系统更适用于预测热缺血时间;RENAL、DDD、ABC和CSA评分系统均可预测术中失血量,尤其是CSA评分系统;RAIV、DAP、RTII和CSA评分系统均可预测术后肾功能,其中RAIV评分系统对术后肾功能的预测能力可能相对较好。未来仍需要大量的病例研究确定适合的评分系统,为临床决策提供更准确的指导。
所有作者均声明不存在利益冲突