
探讨卵巢上皮性癌铂耐药复发的相关影响因素。
回顾性分析2013年1月至2018年1月山西省肿瘤医院30例铂耐药复发性卵巢癌患者的临床病理资料,按照年龄1∶1匹配铂敏感复发性卵巢癌患者30例,比较两组国际妇产科联盟(FIGO)分期、病理分级、是否行新辅助化疗、手术彻底性、肿瘤负荷、初诊时血清HE4水平的差异,采用logistic回归分析法分析卵巢癌铂耐药复发的影响因素。
单因素分析结果显示,铂耐药组行不满意肿瘤细胞减灭术患者比例高于铂敏感组[76.7% (23/30)比26.7%(8/30),χ2=15.02,P<0.001],手术探查评分高于铂敏感组[6分(4分,8分)比4分(2分,6分),Z=-3.20,P=0.001],HE4水平高于铂敏感组[550.76 pmol/L(286.83 pmol/L,882.65 pmol/L)比264.92 pmol/L(170.33 pmol/L,557.23 pmol/L),Z=-2.50,P=0.012]。多因素分析结果显示,手术彻底性(OR=17.459,95% CI 3.667~83.119,P<0.001)、肿瘤负荷(OR=1.710,95% CI 1.175~2.489,P=0.005)是影响卵巢癌铂耐药复发的独立危险因素。
初诊时HE4水平可能是影响卵巢癌铂耐药复发的因素。手术彻底性、肿瘤负荷是影响卵巢癌铂耐药复发的独立危险因素。满意的肿瘤细胞减灭术对预防卵巢癌铂耐药复发是有必要的。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
卵巢癌是常见的女性恶性肿瘤之一[1],其中85%~90%为卵巢上皮性癌[2]。铂敏感复发性卵巢癌可考虑选择二次减瘤术或以铂类为主的化疗方案,铂耐药复发性卵巢癌不推荐使用含铂类或紫杉醇的化疗方案[3]。铂耐药复发性卵巢癌患者一般预后较差[4]。本研究旨在探讨卵巢癌铂耐药复发的影响因素,寻找预防卵巢癌铂耐药复发的有效方法。
纳入标准:(1)于山西省肿瘤医院接受初次手术及首次复发后治疗的卵巢上皮性癌、输卵管癌和原发性腹膜癌;(2)手术方式为早期全面分期手术、肿瘤细胞减灭术、中间型减瘤术;(3)新辅助化疗为以铂类药物为基础的化疗;(4)术后化疗为以铂类药物为基础的化疗;(5)有完整的随访资料,包括初治的末次化疗时间、术中探查情况、术后临床病理分期、疾病复发时间、化疗记录等。排除标准:(1)有其他恶性肿瘤病史;(2)收集资料期间新发其他恶性肿瘤;(3)肝、肾功能不全。回顾性分析2013年1月至2018年1月山西省肿瘤医院30例铂耐药复发性卵巢癌患者的临床病理资料,按照年龄1∶1匹配铂敏感复发性卵巢癌患者30例。根据组织病理学结果或出现下面表现中的两项考虑肿瘤复发:(1)肿瘤标志物糖类抗原125升高;(2)出现胸、腹腔积液;(3)妇科检查发现肿块;(4)影像学检查发现肿块;(5)不明原因的肠梗阻[5]。本研究符合《赫尔辛基宣言》的相关要求。
比较铂耐药及铂敏感复发性卵巢癌患者在国际妇产科联盟(FIGO)分期、病理分级、是否行新辅助化疗、手术彻底性(本研究将手术记录显示术后有残留病灶、术中探查到的病灶由于粘连等原因未处理、不满意的肿瘤细胞减灭术均记录为不满意的肿瘤细胞减灭术;手术记录显示满意的肿瘤细胞减灭术、基本满意的肿瘤细胞减灭术、术中肉眼所见的病灶均进行切除或电灼、残余病灶直径≤1 cm均记录为满意的肿瘤细胞减灭术)、肿瘤负荷(参照Fagotti评分标准进行手术探查评分,饼状大网膜、腹膜肿瘤、膈面肿瘤、肠系膜转移、肿瘤侵及肠道、肿瘤侵及胃、肝表面转移各计2分[6,7])、初诊时HE4水平方面的差异。
采用SPSS 26.0统计软件分析数据。计数资料以频数(%)表示,两组间比较采用χ2检验或Fisher确切概率法;计量资料呈非正态分布,用M(Q1,Q3)表示,两组间比较采用秩和检验。多因素分析采用二元logistic回归分析法。以P<0.05为差异有统计学意义。
60例复发性卵巢癌患者中位年龄54岁(42~72岁),FIGO分期:Ⅰ~Ⅱ期4例,Ⅲ~Ⅳ期56例;浆液性卵巢癌59例,黏液性卵巢癌1例;病理分级:高级别52例,低级别8例;中位手术探查评分为6分,<6分28例,≥6分32例;行新辅助化疗13例,未行新辅助化疗47例;行不满意的肿瘤细胞减灭术31例,行满意的肿瘤细胞减灭术29例。
铂耐药组行不满意肿瘤细胞减灭术23例(76.7%),铂敏感组为8例(26.7%),两组差异有统计学意义(χ2=15.02,P<0.001)。两组FIGO分期、病理分级、是否行新辅助化疗比较,差异均无统计学意义(均P>0.05)(表1)。铂耐药组手术探查评分为6分(4分,8分),高于铂敏感组的4分(2分,6分),两组差异有统计学意义(Z=-3.20,P=0.001)。铂耐药组HE4水平为550.76 pmol/L(286.83 pmol/L,882.65 pmol/L),高于铂敏感组的264.92 pmol/L(170.33 pmol/L,557.23 pmol/L),两组差异有统计学意义(Z=-2.50,P=0.012)。logistic回归分析结果显示,手术彻底性(OR=17.459,95% CI 3.667~83.119,P<0.001)、肿瘤负荷(OR=1.710,95% CI 1.175~2.489,P=0.005)是影响卵巢癌铂耐药复发的独立危险因素。
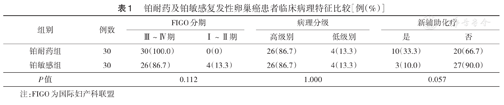
铂耐药及铂敏感复发性卵巢癌患者临床病理特征比较[例(%)]
铂耐药及铂敏感复发性卵巢癌患者临床病理特征比较[例(%)]
| 组别 | 例数 | FIGO分期 | 病理分级 | 新辅助化疗 | |||
|---|---|---|---|---|---|---|---|
| Ⅲ~Ⅳ期 | Ⅰ~Ⅱ期 | 高级别 | 低级别 | 是 | 否 | ||
| 铂耐药组 | 30 | 30(100.0) | 0(0) | 26(86.7) | 4(13.3) | 10(33.3) | 20(66.7) |
| 铂敏感组 | 30 | 26(86.7) | 4(13.3) | 26(86.7) | 4(13.3) | 3(10.0) | 27(90.0) |
| P值 | 0.112 | 1.000 | 0.057 | ||||
注:FIGO为国际妇产科联盟
铂耐药是导致卵巢癌患者死亡率高的重要原因,初治时对化疗药物敏感的卵巢癌患者多次复发后多数也会产生耐药性[8]。在分子水平上,肿瘤细胞对铂类药物产生耐药性是极其复杂的过程,可能与肿瘤微环境、PI3K-AKT信号通路、抑癌基因张力蛋白同源物、程序性死亡受体1及其配体等有关[9]。
多项研究证实肿瘤清除率越高,对卵巢癌患者越有保护作用,术中无肉眼残留对患者延长生存期、提高生存率有利[10,11,12,13]。Gao等[14]研究显示,新辅助化疗后行中间型减瘤术组无肉眼残余病灶的患者预后与直接行肿瘤细胞减灭术组残余病灶直径<1 cm的患者预后相似,但是与直接手术组残余病灶直径≥1 cm的患者相比,预后更好,而对于全部新辅助化疗后行中间型减瘤术组患者,结果也是一样的。本研究中手术彻底性是卵巢癌铂耐药复发的独立危险因素,所以术中应尽量彻底切除肿瘤,减少残留,从而降低患者铂耐药复发的可能性。
既往研究证实肿瘤负荷(腹膜癌指数)评分高与晚期卵巢癌患者无瘤生存期缩短有关[15]。Hall等[10]研究也显示肿瘤负荷(病灶累及的腹腔野数量)增加会对卵巢癌患者术后总生存产生负面影响。本研究显示肿瘤负荷是卵巢癌铂耐药复发的独立危险因素。
对于HE4对卵巢癌铂耐药的影响目前研究观点基本一致。Liu等[16]行体外试验表明耐药组肿瘤细胞HE4阳性率和表达水平均高于敏感组。还有研究显示术前HE4水平对预测卵巢癌铂耐药复发是有意义的[17,18]。本研究中铂耐药组初诊时HE4水平高于铂敏感组。HE4有望作为预测卵巢癌患者是否发生铂耐药复发的指标,临床上对于HE4水平较高的患者应适当加强随访。
综上所述,初诊时HE4水平可能是影响卵巢癌铂耐药复发的因素。手术彻底性、肿瘤负荷是影响卵巢癌铂耐药复发的独立危险因素。满意的肿瘤细胞减灭术对预防卵巢癌铂耐药复发是有必要的。本研究存在一定的局限性,期待大样本、多中心、前瞻性研究进一步证实不同临床因素对卵巢癌铂耐药的影响。
所有作者均声明不存在利益冲突



























