
探讨miRNA-221-3p(miR-221-3p)在胰腺癌细胞中的表达及其对胰腺癌细胞凋亡的影响,以及可能相关机制。
选择胰腺癌PATU8988T细胞株,使用Lipofectamine 3000分别转染miR-221-3p模拟物、miR-221-3p抑制剂及相应阴性对照序列,将PATU8988T细胞分为阴性对照组(未进行任何处理)、miR-221-3p模拟物阴性对照组、miR-221-3p模拟物组、miR-221-3p抑制剂阴性对照组、miR-221-3p抑制剂组。采用实时荧光定量聚合酶链反应(qRT-PCR)检测miR-221-3p的相对表达水平,流式细胞术检测miR-221-3p对胰腺癌细胞凋亡的影响,蛋白质印迹法检测P53、PTEN蛋白在PATU8988T细胞株中的表达情况。
阴性对照组、miR-221-3p模拟物阴性对照组、miR-221-3p模拟物组、miR-221-3p抑制剂阴性对照组、miR-221-3p抑制剂组miR-221-3p相对表达水平分别为1.02±0.18、1.50±0.33、2.96±0.70、1.62±0.30、0.36±0.05,差异有统计学意义(F=12.61,P<0.05);miR-221-3p模拟物组miR-221-3p相对表达水平与阴性对照组和miR-221-3p模拟物阴性对照组比较均升高(t=1.94,P<0.05;t=1.45,P<0.05);miR-221-3p抑制剂组miR-221-3p相对表达水平与阴性对照组和miR-221-3p抑制剂阴性对照组比较均降低(t=-0.65,P<0.05;t=-1.26,P<0.05)。阴性对照组、miR-221-3p模拟物阴性对照组、miR-221-3p模拟物组、miR-221-3p抑制剂阴性对照组、miR-221-3p抑制剂组细胞凋亡率分别为(8.60±0.20)%、(8.60±0.26)%、(4.27±0.31)%、(8.83±0.29)%、(13.63±0.60)%,差异有统计学意义(F=253.80,P<0.01);miR-221-3p模拟物组细胞凋亡率与阴性对照组、miR-221-3p模拟物阴性对照组比较均降低(t=-4.33,P<0.05;t=-4.33,P<0.05);miR-221-3p抑制剂组细胞凋亡率与阴性对照组、miR-221-3p抑制剂阴性对照组比较均升高(t=5.03,P<0.05;t=4.80,P<0.05)。miR-221-3p模拟物阴性对照组和miR-221-3p抑制剂阴性对照组P53、PTEN蛋白表达水平比较,差异均无统计学意义(P53:t=0.22,P>0.05;PTEN:t=0.33,P>0.05);miR-221-3p模拟物组与模拟物阴性对照组比较,P53、PTEN蛋白表达水平均下降(P53:t=4.31,P<0.05;PTEN:t=8.49,P<0.05);miR-221-3p抑制剂组与抑制剂阴性对照组比较P53、PTEN蛋白表达水平均升高(P53:t=5.17,P<0.05;PTEN:t=6.21,P<0.05)。
miR-221-3p在胰腺癌PATU8988T细胞中高表达,可抑制胰腺癌细胞凋亡,miR-221-3p可能通过P53和PTEN调节胰腺癌的进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胰腺癌是早期诊断困难、恶性程度极高、预后差的消化系统恶性肿瘤,绝大多数患者诊断时已处于晚期或合并远处多发转移。近年来胰腺癌的发病率越来越高,未经治疗患者的中位总生存(OS)时间为5~8个月,5年OS率<5%[1]。微RNA(miRNA)可参与肿瘤的发生及演变,并在疾病诊断、治疗及预后判断中发挥作用[2]。miRNA-221-3p(miR-221-3p)在各种癌症的异常细胞增殖和分化中起着至关重要的作用[3]。体外实验表明miR-221-3p可促进胰腺癌细胞增殖[4]。肿瘤细胞中突变P53可诱导癌细胞增殖并抑制癌细胞死亡[5]。在肝细胞癌中,P53和MDM2与患者生存率呈负相关,而癌基因MDM2是miR-221-3p的预测靶标[6]。PTEN在一些肿瘤细胞中失活,而使丝氨酸/苏氨酸蛋白激酶(Akt)过度激活,从而促进细胞的增殖,抑制其凋亡[7]。在胃肠肿瘤中,miR-221-3p可能通过磷脂酰肌醇3-激酶(PI3K)-Akt信号通路提高细胞凋亡率[8]。目前关于miR-221-3p对胰腺癌细胞的作用和机制尚不清楚。本研究分析miR-221-3p对胰腺癌细胞凋亡能力的影响,并验证miR-221-3p经P53、PTEN及潜在信号通路参与胰腺癌的进展,为胰腺癌早期诊断及靶向治疗提供理论依据。
胰腺癌细胞株PATU8988T购自武汉普诺赛生物科技有限公司;Lipofectamine 3000购自美国Invitrogen公司;P53兔抗、PTEN兔抗购自武汉爱博泰克生物科技有限公司,miR-221-3p基因购自上海吉玛制药技术有限公司,增强型RIPA裂解液、DMEM培养液、蛋白质印迹法专用一抗、二抗稀释液均购自武汉博士德生物工程有限公司,反转录试剂盒购自北京聚合美生物科技有限公司,细胞凋亡检测试剂盒购自大连美仑生物技术有限公司。
PATU8988T细胞置于含10%胎牛血清、100 U/ml青霉素和100 mg/ml链霉素的DMEM培养液中,37 ℃、5% CO2培养箱中培养。使用Lipofectamine 3000分别共转染miR-221-3p模拟物、抑制剂及其相应阴性对照序列,将PATU8988T细胞分为阴性对照组(未进行任何处理)、miR-221-3p模拟物阴性对照组、miR-221-3p模拟物组、miR-221-3p抑制剂阴性对照组、miR-221-3p抑制剂组。miR-221-3p模拟物阴性对照序列为5'-UUCUCCGAACGUGUCACGUTT-3',miR-221-3p模拟物序列为5'-AGCUACAUUGUCUGCUGGGUUUC-3',miR-221-3p抑制剂阴性对照序列为5'-UUGUACUA CACAAAAGUACUG-3',miR-221-3p抑制剂序列为5'-GAAACCCAGCAGACAAUGUAGCU-3'。转染24 h后动态观察细胞生长情况,避免培养时间过长,造成细胞过度死亡(一般转染后培养24~48 h)。
采用TRIzol试剂提取转染后各组细胞总RNA,反转录为cDNA。以cDNA为模板,U6为内参照。qRT-PCR反应体系为miRNA第1链cDNA 1 μl,惰性参比染料(ROX)10 μl,10 μmol/L上游引物0.4 μl,10 μmol/L下游引物0.4 μl,用ddH2O补足反应体系至20 μl。反应条件:95 ℃反应10 min(预变性),95 ℃ 15 s(变性),60 ℃退火、延伸1 min,循环40次。miR-221-3p正向引物:5'-AGCTACATTGTCTGCTGGG TTTC-3',反向引物:5'-GCAGGGTCCGAGGTATTC-3';U6正向引物:5'-GCTTCGGCAGCACATATACT-3';反向引物:5'-GCAGGGTCCGAGGTATTC-3'。采用2-△△Ct法计算miR-221-3p的相对表达量。
收集转染后细胞,加入非变性裂解液复合物(包含增强型RIPA裂解液、蛋白酶抑制剂)提取蛋白,BCA法检测蛋白浓度。配制由10%分离胶和5%浓缩胶组成的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)胶。恒压模式下电泳,当蛋白质浓缩时,电压恒定在80 V;当样品进入分离凝胶时,电压调整到120 V。电泳结束后用湿转法将分离的蛋白转移至聚偏二氟乙烯(PVDF)膜上。湿转结束后将PVDF膜置于5%脱脂牛奶中,室温下以60 r/min在摇床上封闭1 h。然后加入专用一抗、二抗稀释液稀释后的对应一抗(1∶1 000),用GAPDH作为内参照,置于4 ℃冰箱内过夜培养。用1×TBST缓冲液洗膜后,加入稀释后的辣根过氧化物酶(HRP)标记的二抗(1∶5 000),再次将其置于摇床上,室温下以60 r/min在摇床上培养1 h。将PVDF膜置于曝光仪内,均匀滴加现配的ECL发光液,使用Image Lab软件对条带进行曝光成像。
收集转染后的各组PATU8988T细胞,向离心管中分别加入1×binding buffer,用移液枪吹打,使其充分混匀后在显微镜下进行计数,若细胞数>1×106/ml,即可进行下一步操作。采用荧光素异硫氰酸酯(FITC)-Annexin V和碘化丙啶(PI)进行双染色,后室温下泡沫箱中避光培养15 min。随后将上述各管内悬液用移液枪吸取至流式管内,上机前向每管滴加400 μl 1×binding buffer,旋涡震荡后上机,检测细胞凋亡情况。
采用SPSS 22.0软件进行数据分析。计数资料符合正态分布,以 ±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
qRT-PCR检测结果显示,阴性对照组、miR-221-3p模拟物阴性对照组、miR-221-3p模拟物组、miR-221-3p抑制剂阴性对照组、miR-221-3p抑制剂组miR-221-3p相对表达水平分别为1.02±0.18、1.50±0.33、2.96±0.70、1.62±0.30、0.36±0.05,差异有统计学意义(F=12.61,P<0.05)。miR-221-3p模拟物阴性对照组、miR-221-3p抑制剂阴性对照组miR-221-3p相对表达水平与阴性对照组比较,差异均无统计学意义(均P>0.05);miR-221-3p模拟物组miR-221-3p相对表达水平与阴性对照组和miR-221-3p模拟物阴性对照比较,差异均有统计学意义(t=1.94,P<0.05;t=1.45,P<0.05);miR-221-3p抑制剂组miR-221-3p相对表达水平与阴性对照组和miR-221-3p抑制剂阴性对照组比较,差异均有统计学意义(t=-0.65,P<0.05;t=-1.26,P<0.05)。
流式细胞术检测结果显示,阴性对照组、miR-221-3p模拟物阴性对照组、miR-221-3p模拟物组、miR-221-3p抑制剂阴性对照组、miR-221-3p抑制剂组的细胞凋亡率分别为(8.60±0.20)%、(8.60±0.26)%、(4.27±0.31)%、(8.83±0.29)%、(13.63±0.60)%,差异有统计学意义(F=253.80,P<0.01)。miR-221-3p模拟物组较阴性对照组、miR-221-3p模拟物阴性对照组细胞凋亡率降低(t=-4.33,P<0.05;t=-4.33,P<0.05);miR-221-3p抑制剂组较阴性对照组、miR-221-3p抑制剂阴性对照组细胞凋亡率上升(t=5.03,P<0.05;t=4.80,P<0.05)。
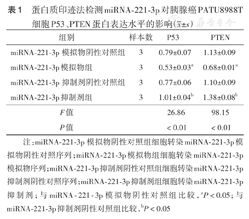
蛋白质印迹法检测结果显示,miR-221-3p模拟物阴性对照组和miR-221-3p抑制剂阴性对照组P53、PTEN蛋白表达差异均无统计学意义(P53:t=0.01,P>0.05;PTEN:t=0.25,P>0.05);miR-221-3p模拟物组与模拟物阴性对照组比较P53、PTEN蛋白表达水平均下降(P53:t=-0.25,P<0.05;t=-0.22,P<0.05;PTEN:t=-0.45,P<0.05;t=-0.48,P<0.05);miR-221-3p抑制剂组与抑制剂阴性对照组比较P53、PTEN蛋白表达水平均升高(P53:t=0.24,P<0.05;t=0.22,P<0.05;PTEN:t=0.28,P<0.05;t=0.45,P<0.05)(图1、表1)。
蛋白质印迹法检测miRNA-221-3p对胰腺癌PATU8988T细胞P53、PTEN蛋白表达水平的影响( ±s)
±s)
蛋白质印迹法检测miRNA-221-3p对胰腺癌PATU8988T细胞P53、PTEN蛋白表达水平的影响( ±s)
±s)
| 组别 | 样本数 | P53 | PTEN |
|---|---|---|---|
| miRNA-221-3p模拟物阴性对照组 | 3 | 0.79±0.07 | 1.13±0.09 |
| miRNA-221-3p模拟物组 | 3 | 0.53±0.03a | 0.68±0.01a |
| miRNA-221-3p抑制剂阴性对照组 | 3 | 0.77±0.06 | 1.10±0.09 |
| miRNA-221-3p抑制剂组 | 3 | 1.01±0.04b | 1.38±0.08b |
| F值 | 26.86 | 98.15 | |
| P值 | <0.01 | <0.01 |
注:miRNA-221-3p模拟物阴性对照组细胞转染miRNA-221-3p模拟物阴性对照序列;miRNA-221-3p模拟物组细胞转染miRNA-221-3p模拟物序列;miRNA-221-3p抑制剂阴性对照组细胞转染miRNA-221-3p抑制剂阴性对照序列;miRNA-221-3p抑制剂组细胞转染miRNA-221-3p抑制剂;与miRNA-221-3p模拟物阴性对照组比较,aP<0.05;与miRNA-221-3p抑制剂阴性对照组比较,bP<0.05
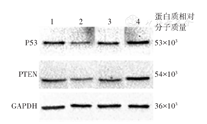

注:1为miRNA-221-3p模拟物阴性对照组(转染miRNA-221-3p模拟物阴性对照序列);2为miRNA-221-3p模拟物组(转染miRNA-221-3p模拟物序列);3为miRNA-221-3p抑制剂阴性对照组(转染miRNA-221-3p抑制剂阴性对照序列);4为miRNA-221-3p抑制剂组(转染miRNA-221-3p抑制剂)
miR-221-3p在肝癌、结直肠癌等多种肿瘤中作为致癌因子[9,10],而在胆管癌中作为抑癌因子[11]。miR-221-3p参与肿瘤恶性生物学行为进展,包括细胞增殖、凋亡、侵袭、转移,以及耐药性的产生[12]。Yang等[13]研究认为miR-221-3p可以通过PTEN-Akt途径促进胰腺癌Capan2细胞增殖。目前关于胰腺癌相关癌症通路中的miRNA研究相对较少,需要更多的研究来进一步探索胰腺癌的潜在病理机制。本研究结果发现,miR-221-3p过表达可使胰腺癌PATU8988T细胞凋亡率下降,miR-221-3p低表达促进PATU8988T细胞凋亡,提示miR-221-3p可抑制PATU8988T细胞凋亡,在胰腺癌中发挥促癌作用。
miRNA可靶向作用于目的基因,并具有多个靶基因的结合位点,使其参与肿瘤生物学行为的调控网络多变化、复杂化。P53是肿瘤抑制蛋白,可在许多不同类型的肿瘤中检测到P53突变导致野生型P53活性的丧失。突变型P53既失去了野生型P53抑制肿瘤的活性,又获得了有助于肿瘤恶性进展的功能[14]。Suzuki等[15]研究表明miRNA的成熟依赖TP53调节。PTEN亦作为一种抑癌基因,在调控细胞生长、增殖、和细胞凋亡中起重要作用[16]。PTEN在一些恶性肿瘤中失去活性,使Akt过度活化,从而促进细胞增殖,抑制细胞凋亡,增强细胞侵袭和抗放射性[7]。miR-21、miR-214为PTEN表达的调节因子[17]。Yang等[13]认为miR-221-3p可以通过PTEN-Akt信号通路促进胰腺癌Capan2细胞增殖。本研究结果提示miR-221-3p过表达时P53、PTEN蛋白表达降低,在miR-221-3p低表达时P53、PTEN表达较阴性对照组高,进一步证明miR-221-3p可以特异性靶向P53和PTEN,抑制P53和PTEN蛋白表达。由于客观条件限制,本研究只在蛋白层面验证miR-221-3p的靶基因,对其作用的具体信号通路未展开进一步深入研究。同时本研究仅在细胞水平进行验证,后续本课题组将通过动物模型与体内实验做进一步深入研究,从临床角度分析评估miR-221-3p的表达与胰腺癌的关系。
综上,胰腺癌细胞内高表达miR-221-3p可促进胰腺癌的进展,从分子水平明确胰腺癌的演变过程及潜在的信号通路,为今后胰腺癌的诊疗提供新的手段与可能。
所有作者均声明不存在利益冲突



























