
探讨深部热疗联合重组人血管内皮抑制素注射液及AP(培美曲塞+顺铂)方案治疗晚期非小细胞肺癌(NSCLC)的效果以及对患者血清肿瘤标志物水平、免疫功能的影响。
采用前瞻性随机对照研究方法,纳入河北省第七人民医院2016年1月至2022年1月收治的106例晚期NSCLC患者,按随机数字表法平均分为两组,每组53例,对照组采用重组人血管内皮抑制素注射液联合AP方案治疗,观察组在对照组基础上加用深部热疗。连续治疗4个周期后观察两组近期疗效。采用化学发光法检测治疗前后血清癌胚抗原(CEA)、糖类抗原125(CA125)及细胞角蛋白片段19 CYFR21-1水平;采用流式细胞术检测外周血T细胞亚群水平。比较两组不良反应发生情况。
观察组和对照组客观缓解率分别为58.49%(31/53)、37.74%(20/53),疾病控制率分别为92.45%(49/53)、75.47%(40/53),观察组均高于对照组(χ2=4.53,P=0.033;χ2=5.62,P=0.018)。治疗前两组血清癌胚抗原(CEA)、糖类抗原125(CA125)及CYFR21-1水平差异均无统计学意义(均P>0.05),治疗后两组均较治疗前降低(均P<0.05),且治疗后观察组均较治疗后对照组低(均P<0.05)。治疗前两组间及观察组治疗前后外周血CD3+、CD4+、CD8+ T细胞水平及CD4+与CD8+ T细胞比值(CD4+/CD8+)差异均无统计学意义(均P>0.05);对照组治疗后外周血CD3+、CD4+ T细胞水平及CD4+/CD8+均较治疗前降低(均P<0.05),外周血CD8+ T细胞水平较治疗前升高(P<0.05);治疗后观察组CD3+、CD4+细胞水平和CD4+/CD8+均高于治疗后对照组,CD8+ T细胞水平低于治疗后对照组,差异均有统计学意义(均P<0.001)。两组治疗过程中均出现了不同程度的胃肠道反应、骨髓抑制、肝肾功能损害及心脏毒性,但两组间各不良反应发生率差异均无统计学意义(均P>0.05)。
深部热疗联合重组人血管内皮抑制素注射液及AP方案治疗晚期NSCLC能有效降低血清肿瘤标志物水平改善机体免疫抑制状态,提高近期疗效,且不良反应整体可控,患者耐受性较好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
非小细胞肺癌(NSCLC)是最常见的肺癌病理类型,约占所有肺癌的85%。NSCLC在发病早期无明显症状,或仅表现为咳嗽、胸胀、喘憋、乏力等,由于临床症状不典型,使得大多数患者在确诊时病情已进展至晚期,无法行手术治疗,化疗成为其最主要的治疗手段[1,2]。AP(培美曲塞+顺铂)方案可应用于晚期NSCLC患者,尤其是肺腺癌,其在一定程度上能抑制肿瘤细胞生长,缓解临床症状,延长生存期[3]。重组人血管内皮抑制素注射液是一种重组人内皮抑素,可抑制肿瘤血管生成,阻断肿瘤细胞的营养供应,进而抑制肿瘤生长。研究表明,重组人血管内皮抑制素注射液联合化疗能有效提高晚期肺癌的治疗效果[4]。近年来,随着肿瘤热疗学的发展,热疗联合化疗被广泛应用于恶性肿瘤的治疗中。肿瘤热疗是利用物理方法将组织加热到能杀灭肿瘤细胞的温度,并维持一段时间,在破坏肿瘤细胞的同时,不会损伤正常组织细胞[5]。为进一步探讨晚期NSCLC更为有效可靠的治疗方案,本研究对我院近年来收治的此类患者给予了深部热疗联合重组人血管内皮抑制素注射液及AP方案治疗,取得了一定疗效,现报道如下。
本研究采用前瞻性随机对照研究方法。纳入标准:(1)经影像学、细胞组织学或病理学检查等确诊为NSCLC[6];(2)按国际抗癌联盟肺癌(TNM)分期(第7版)为ⅢB~Ⅳ期;(3)至少存在1个可测量病灶;(4)Karnofsky评分>60分;(5)预计生存期>3个月;(6)首次确诊,既往无肺癌手术、放化疗、抗血管生成药物等相关抗肿瘤治疗史;(7)血常规、心电图等检查无明显异常。排除标准:(1)合并严重肝、肾功能障碍;(2)伴有心脑血管疾病或自身免疫性疾病;(3)存在全身广泛转移;(4)患有其他原发性恶性肿瘤;(5)伴有精神疾病或意识障碍;(6)合并无法控制的胸腔积液。
根据纳入、排除标准,前瞻性纳入2016年1月至2022年1月在我院就诊的晚期NSCLC患者106例,以随机数字表法平均分为两组,每组53例。观察组中男性30例,女性23例;年龄(62±10)岁,年龄范围35~78岁;组织学亚型:腺癌36例,鳞状细胞癌14例,腺鳞癌3例;按TNM分期标准(第7版)分期:ⅢB期27例,Ⅳ期26例。对照组男性32例,女性21例;年龄(62±9)岁,年龄范围36~76岁;组织学亚型:腺癌33例,鳞状细胞癌16例,鳞腺癌4例;按TNM分期标准(第7版)分期:ⅢB期30例,Ⅳ期23例。两组基线资料差异均无统计学意义(均P>0.05),具有可比性。本研究经我院医学伦理委员会批准(批准文号:2020-07),患者均知情同意,并自愿签署知情同意书。
对照组:采用重组人血管内皮抑制素注射液及AP方案治疗,具体为:注射用培美曲塞二钠(四川汇宇制药股份有限公司)500 mg/m2静脉滴注,第1天;给药结束30 min后注射用顺铂(云南植物药业有限公司)75 mg/m2静脉滴注,第1天;重组人血管内皮抑制素注射液(山东先声生物制药有限公司)15 mg/次静脉滴注,1次/d,第1天至第14天。观察组在对照组用药基础上,采用HG-2000Ⅱ体外高频热疗机(珠海和佳医疗设备股份有限公司)进行热疗,热疗靶区为肺部原发肿瘤区域和纵隔淋巴结转移区域,温度设定为40~43 ℃,60 min/次,2次/周,热疗间隔至少72 h,以3周为1个周期,即连续深部热疗2周,休息1周。若热疗和化疗同日进行,则先化疗后热疗。两组均以21 d为1个周期,连续治疗4个周期。
(1)近期疗效:参照文献[7]分为4个等级,即完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),以客观缓解率(ORR)(以CR+PR计算)和疾病控制率(DCR)(以CR+PR+SD计算)作为评价指标。(2)血清肿瘤标志物:治疗前后收集受测对象空腹肘静脉血5 ml,离心半径10 cm,3 000 r/min离心15 min,取上清液分装,-70 ℃冻存待测。用Axceed 200T化学发光免疫分析仪(天津博奥赛斯生物公司)测定血清癌胚抗原(CEA)、糖类抗原125(CA125)及细胞角蛋白片段19 CYFR21-1水平,操作均按化学发光法试剂盒(北京科美生物技术有限公司)说明书进行。(3)免疫功能:治疗前后使用FACS Vantage流式细胞仪(美国BD公司)检测受检对象外周血T细胞亚群,即CD3+、CD4+、CD8+细胞水平,并计算CD4+ T细胞与CD8+ T细胞比值(CD4+/CD8+)。(4)不良反应:治疗过程中定期检测两组患者肝肾功能、血常规、心电图等,记录胃肠道反应、骨髓抑制、肝肾功能损害及心脏毒性等不良反应发生情况,按美国国家癌症研究所(NCI)不良事件通用标准(CTCAE)4.0版对各项不良反应进行分级,分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ级。
应用SPSS 23.0软件进行统计学分析。计量资料符合正态分布且方差齐,以 ±s表示,组内治疗前后比较采用配对t检验,两组间比较采用独立样本t检验;计数资料以频数(%)表示,组间比较行χ2检验。以P<0.05为差异有统计学意义。
±s表示,组内治疗前后比较采用配对t检验,两组间比较采用独立样本t检验;计数资料以频数(%)表示,组间比较行χ2检验。以P<0.05为差异有统计学意义。
观察组ORR、DCR均高于与对照组,差异均有统计学意义(χ2=4.53,P=0.033;χ2=5.62,P=0.018)(表1)。
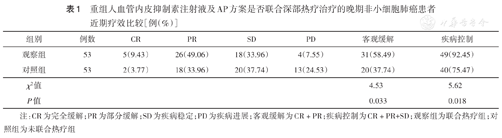
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者近期疗效比较[例(%)]
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者近期疗效比较[例(%)]
| 组别 | 例数 | CR | PR | SD | PD | 客观缓解 | 疾病控制 |
|---|---|---|---|---|---|---|---|
| 观察组 | 53 | 5(9.43) | 26(49.06) | 18(33.96) | 4(7.55) | 31(58.49) | 49(92.45) |
| 对照组 | 53 | 2(3.77) | 18(33.96) | 20(37.74) | 13(24.53) | 20(37.74) | 40(75.47) |
| χ2值 | 4.53 | 5.62 | |||||
| P值 | 0.033 | 0.018 |
注:CR为完全缓解;PR为部分缓解;SD为疾病稳定;PD为疾病进展;客观缓解为CR+PR;疾病控制为CR+PR+SD;观察组为联合热疗组;对照组为未联合热疗组
两组治疗前CEA、CA125及CYFR21-1水平差异均无统计学意义(均P>0.05);两组治疗后血清CEA、CA125及CYFR21-1水平均较治疗前降低(均P<0.05),且治疗后观察组血清CEA、CA125及CYFR21-1水平均低于治疗后对照组(均P<0.05)(表2)。
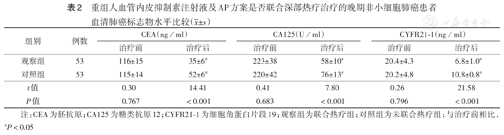
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者血清肺癌标志物水平比较( ±s)
±s)
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者血清肺癌标志物水平比较( ±s)
±s)
| 组别 | 例数 | CEA(ng/ml) | CA125(U/ml) | CYFR21-1(ng/ml) | |||
|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 观察组 | 53 | 116±15 | 35±6a | 223±38 | 58±10a | 20.4±4.3 | 6.8±1.0a |
| 对照组 | 53 | 115±14 | 52±6a | 220±42 | 76±13a | 20.2±4.8 | 10.8±0.8a |
| t值 | 0.30 | 14.41 | 0.41 | 7.80 | 0.26 | 21.58 | |
| P值 | 0.767 | <0.001 | 0.683 | <0.001 | 0.796 | <0.001 | |
注:CEA为胚抗原;CA125为糖类抗原12;CYFR21-1为细胞角蛋白片段19;观察组为联合热疗组;对照组为未联合热疗组;与治疗前相比,aP<0.05
两组治疗前外周血CD3+、CD4+、CD8+细胞水平及CD4+/CD8+差异均无统计学意义(均P>0.05);观察组治疗前后外周血CD3+、CD4+、CD8+细胞水平及CD4+/CD8+差异均无统计学意义(均P>0.05);对照组治疗后外周血CD3+、CD4+细胞水平及CD4+/CD8+均较治疗前降低(均P<0.05),CD8+细胞水平较治疗前升高(P<0.05);治疗后观察组外周血CD3+、CD4+细胞水平和CD4+/CD8+均高于治疗后对照组(均P<0.05),CD8+ T细胞水平低于治疗后对照组(P<0.05)(表3)。
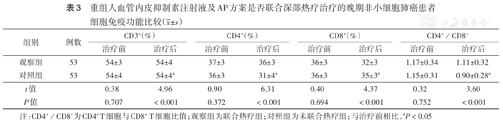
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者细胞免疫功能比较( ±s)
±s)
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者细胞免疫功能比较( ±s)
±s)
| 组别 | 例数 | CD3+(%) | CD4+(%) | CD8+(%) | CD4+/CD8+ | ||||
|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 观察组 | 53 | 54±3 | 54±4 | 37±3 | 36±3 | 36±3 | 32±3 | 1.17±0.34 | 1.11±0.32 |
| 对照组 | 53 | 54±4 | 54±4a | 36±3 | 31±4a | 36±3 | 35±3a | 1.15±0.31 | 0.90±0.28a |
| t值 | 0.38 | 4.96 | 0.90 | 6.31 | 0.40 | 4.37 | 0.32 | 3.60 | |
| P值 | 0.707 | <0.001 | 0.372 | <0.001 | 0.694 | <0.001 | 0.752 | <0.001 | |
注:CD4+/CD8+为CD4+ T细胞与CD8+ T细胞比值;观察组为联合热疗组;对照组为未联合热疗组;与治疗前相比,aP<0.05
两组治疗过程中均出现了不同程度的胃肠道反应、骨髓抑制、肝肾功能损害及心脏毒性,但两组间各不良反应发生率差异均无统计学意义(均P>0.05)(表4)。
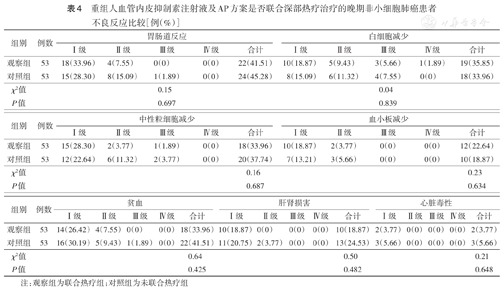
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者不良反应比较[例(%)]
重组人血管内皮抑制素注射液及AP方案是否联合深部热疗治疗的晚期非小细胞肺癌患者不良反应比较[例(%)]
| 组别 | 例数 | 胃肠道反应 | 白细胞减少 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 合计 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 合计 | ||
| 观察组 | 53 | 18(33.96) | 4(7.55) | 0(0) | 0(0) | 22(41.51) | 10(18.87) | 5(9.43) | 3(5.66) | 1(1.89) | 19(35.85) |
| 对照组 | 53 | 15(28.30) | 8(15.09) | 1(1.89) | 0(0) | 24(45.28) | 8(15.09) | 6(11.32) | 4(7.55) | 0(0) | 18(33.96) |
| χ2值 | 0.15 | 0.04 | |||||||||
| P值 | 0.697 | 0.839 | |||||||||
| 组别 | 例数 | 中性粒细胞减少 | 血小板减少 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 合计 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 合计 | ||
| 观察组 | 53 | 15(28.30) | 2(3.77) | 1(1.89) | 0(0) | 18(33.96) | 10(18.87) | 2(3.77) | 0(0) | 0(0) | 12(22.64) |
| 对照组 | 53 | 12(22.64) | 6(11.32) | 2(3.77) | 0(0) | 20(37.74) | 7(13.21) | 3(5.66) | 0(0) | 0(0) | 10(18.87) |
| χ2值 | 0.16 | 0.23 | |||||||||
| P值 | 0.687 | 0.634 | |||||||||
| 组别 | 例数 | 贫血 | 肝肾损害 | 心脏毒性 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 合计 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 合计 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 | 合计 | ||
| 观察组 | 53 | 14(26.42) | 4(7.55) | 0(0) | 0(0) | 18(33.96) | 10(18.87) | 0(0) | 0(0) | 0(0) | 10(18.87) | 2(3.77) | 0(0) | 0(0) | 0(0) | 2(3.77) |
| 对照组 | 53 | 16(30.19) | 5(9.43) | 1(1.89) | 0(0) | 22(41.51) | 11(20.75) | 2(3.77) | 0(0) | 0(0) | 13(24.53) | 3(5.66) | 0(0) | 0(0) | 0(0) | 3(5.66) |
| χ2值 | 0.64 | 0.50 | 0.21 | |||||||||||||
| P值 | 0.425 | 0.482 | 0.648 | |||||||||||||
注:观察组为联合热疗组;对照组为未联合热疗组
由于NSCLC临床症状不典型,因此大多数患者发现病情时已进展至晚期,不适宜再行手术治疗,化疗成为晚期NSCLC患者最常使用的治疗手段[8]。以铂类为基础的化疗方案在晚期NSCLC患者中应用十分广泛,尤以AP方案使用较多[9]。顺铂属于第一代铂类化疗药,可与肿瘤细胞DNA发生链内与链间交联反应,破坏其DNA的转录与复制过程。培美曲塞是一种新型多靶点抗叶酸制剂,可抑制甘氨酰胺核苷酸甲酰基转移酶(GARFT)、二氢叶酸还原酶、胸苷酸合成酶等多种叶酸依赖性酶,抑制嘌呤与嘧啶合成,干扰肿瘤细胞增殖,促进其凋亡。宣向飞等[10]报道,AP方案相对于吉西他滨联合顺铂方案能更好地缓解晚期NSCLC患者的临床症状,提高临床疗效。然而单纯化疗的抗癌效果仍有待提高。
近年研究表明,在化疗基础上联合抗血管治疗有助于进一步提高抗肿瘤疗效,改善NSCLC患者预后[11]。重组人血管内皮抑制素注射液是由我国自主研发的一种重组人血管内皮抑素,可通过影响血管内皮细胞迁移诱导细胞凋亡,进而对肿瘤血管生成起到抑制作用[12]。重组人血管内皮抑制素注射液还可促使肿瘤微环境正常化,促进血管周围毛细胞与支持细胞增殖,改善血管营养供应,促进氧及化疗药物的有效运输,进而增强放化疗的敏感性[13]。本研究中,对照组患者在采用重组人血管内皮抑制素注射液联合AP方案治疗后,ORR、DCR分别为37.74%、75.47%。肿瘤热疗是继手术、放化疗及生物治疗后的又一重要抗肿瘤治疗手段,其通过将物理能量积聚于局部组织内产生热效应,使局部肿瘤组织温度升至有效治疗温度,并持续一段时间,进而起到抑制肿瘤细胞DNA合成、有效杀灭肿瘤细胞的抗癌作用[14]。深部热疗还可促进局部血液循环,增加毛细血管血流灌注,提高化疗药物浓度,增强化疗敏感性。同时肿瘤热疗时设定的温度对于肿瘤细胞具有良好的杀灭作用,但对于正常组织细胞不会产生损害。相关报道显示,热疗联合放化疗相对于单用放化疗能有效增加人胶质母细胞瘤细胞死亡比例,是一种更为有效的治疗方案[15]。苏甲林等[16]对肺癌患者在依托泊苷联合顺铂化疗基础上联合肺部原发病灶深部热疗,缓解率达到85%,无进展生存期为6个月,均明显优于单独化疗组。本研究观察组除了给予重组人血管内皮抑制素注射液及AP方案外,还进一步给予了深部热疗。两组患者4个治疗周期后进行近期疗效评估显示,观察组ORR、DCR分别为58.49%、92.45%,较对照组均有明显上升。两组治疗过程中均出现了胃肠道反应、骨髓抑制、肝肾损害及心脏毒性,但均以Ⅰ级最为多见。可见,两种治疗方案均会引起较多的不良反应,但并不严重,整体可控,受试者多可耐受,安全性相对较高。此外观察组在联合深部热疗过程中,也未出现与热疗有关的不良反应,这与围治疗期对患者的持续监测有关。
肿瘤标志物是由恶性肿瘤细胞分泌产生或是宿主因肿瘤细胞刺激而产生的物质,在很大程度上能反映恶性肿瘤的发生、发展及转移等,是临床上恶性肿瘤诊疗及预后评估的重要参考依据[17,18]。CEA是一种非器官特异性肿瘤相关抗原,其在结直肠癌、胃癌、肺癌等恶性肿瘤患者的血清中呈高表达状态。研究显示,术前血清CEA是NSCLC预后的重要影响因素之一[18]。CA125是一种糖蛋白肿瘤相关抗原,也是广谱肿瘤标志物之一,正常情况下其水平很低,然而当肿瘤浸润导致组织结构破坏后,其血清水平会异常升高。CYFR21-1是细胞角蛋白19可溶性片段,广泛分布于肺、乳腺上皮,当细胞癌变时,CYFR21-1可释放至血液循环中,导致血清水平明显上升。郭九玲等[19]报道显示,Ⅲ、Ⅳ期肺癌患者的血清CEA、CA125、CYFR21-1水平明显高于Ⅰ、Ⅱ期肺癌,且术后复发或转移的肺癌患者术前血清CEA、CA125、CYFR21-1水平明显高于无复发或转移的肺癌患者。可见上述血清肿瘤标志物水平和肺癌肿瘤分期及预后密切相关。本研究两组患者治疗后血清CEA、CA125、CYFR21-1水平均较治疗前明显降低,但均以观察组的下降更明显。提示,深部热疗联合重组人血管内皮抑制素注射液及AP方案治疗晚期NSCLC能更有效地诱导患者体内肿瘤细胞凋亡,减轻肿瘤负荷,下调血清肿瘤标志物水平,从而利于延缓病情进展。
T细胞是来源于骨髓的多能干细胞,是人体主要的免疫细胞,可有效稳定机体免疫内环境[20,21,22]。其中CD3+ T细胞是成熟T细胞,CD4+ T细胞是辅助性T细胞,CD8+ T细胞是抑制性T细胞。机体CD4+/CD8+下降提示机体细胞免疫功能受到抑制,此时肿瘤细胞易发生逃逸。研究表明,肿瘤患者的外周血CD3+、CD4+水平和CD4+/CD8+较正常人群均有明显降低,外周血CD8+细胞水平较正常人群明显升高[23]。对于晚期NSCLC患者,化疗过程中由于化疗药物的细胞毒性作用,可使机体免疫抑制状态进一步加重。本研究中,对照组治疗后外周血CD3+、CD4+细胞水平及CD4+/CD8+明显低于治疗前,外周血CD8+细胞水平明显高于治疗前,但观察组治疗前后外周血T细胞亚群水平无明显改变。提示在重组人血管内皮抑制素注射液联合AP方案基础上,联合深部热疗能有效缓解化疗药物引起的免疫抑制,进而产生更强的抗癌能力,改善患者预后。
综上所述,深部热疗联合重组人血管内皮抑制素注射液及AP方案治疗晚期NSCLC,能有效下调血清肿瘤标志物水平,改善机体抗肿瘤免疫效应,提高近期疗效,且不良反应无明显增加,患者整体耐受性较好,值得临床推广应用。
所有作者均声明不存在利益冲突



























